注射用盐酸地尔硫 无菌方法适用性试验研究及市场质量考查
阎雅宁,曹晓云,郭福庆
(天津市药品检验研究院,天津 300070)
1 仪器与试药
1.1 试验仪器及设备 恒温培养箱(BINDER KB720),灭菌锅(Sanyo MLS-3780),超净工作台(yamato ADS161),生物安全柜(BAKER SG-403A TX-INT),自动无菌检测仪(MILLIPORE),集菌培养器(浙江泰林生物技术股份有限公司)。
1.2 验证用菌种 金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、白色念珠菌(Clostridium sporogenes)[CMCC(F)98001]、生孢梭菌(Clostridium sporogenes)[CMCC(B)64941]、黑曲霉(Aspergillus niger)[CMCC(F)98003]均购自中国食品药品检定研究院,由本院传代保存。
1.3 样品 抽样来自甲、乙、丙3个生产企业的注射用盐酸地尔硫(规格:10 mg),共34个批次样品。
1.4 验证用培养基 硫乙醇酸盐流体培养基(北京陆桥技术股份有限公司,批号190301)、胰酪大豆胨琼脂培养基(北京陆桥技术股份有限公司,批号190327)、胰酪大豆胨液体培养基(北京陆桥技术股份有限公司,批号190304)、沙氏葡萄糖液体培养基(北京陆桥技术股份有限公司,批号180724)、沙氏葡萄糖琼脂培养基(北京陆桥技术股份有限公司,批号181127)、蛋白胨(北京奥博星生物技术有限责任公司,批号20181106)、聚山梨酯80(天津市华东试剂厂,批号2018年01月19日)、氯化钠(天津市帆船化学试剂科技有限公司,批号2019年03月22日)。以上市售脱水培养基均按标签说明配制并高压灭菌后备用。
2 试验方法与结果
2.1 菌液配制与计数 取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物少许,接种至胰酪大豆胨液体培养基中,生孢梭菌的新鲜培养物接种至硫乙醇酸盐流体培养基中,32.5℃培养24 h;白色念珠菌新鲜培养物接种至沙氏葡萄糖液体培养基中,22.5℃培养48 h。取上述培养物各1 ml用0.9%无菌氯化钠溶液稀释制成不大于100 cfu/ml的菌悬液。黑曲霉新鲜培养物接种至沙氏葡萄糖琼脂斜面培养基上,22.5℃培养7 d,使大量孢子成熟,用含0.05%(V/V)聚山梨酯80的0.9%无菌氯化钠溶液洗下孢子,并稀释成不大于100 cfu/ml的孢子悬液。取上述金黄色葡萄球菌、大肠埃希菌、和生孢梭菌3种菌适宜稀释级的试验菌悬液1 ml注入到无菌平皿中,并立即倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平皿,混匀,其中生孢梭菌置厌氧罐中,置32.5℃培养48 h,计数;取上述白色念珠菌、枯草芽孢杆菌和黑曲霉3种菌适宜稀释级的试验菌悬液1 ml注入到无菌平皿中,并立即倾注沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平皿,混匀,置22.5℃培养72 h,计数。
2.2 预试验

表1 3种预试验方法
2.2.2 预试验结果 通过试验结果的观察,抽取的3个生产企业的样品按照表1方法C进行预试验时,金黄色葡萄球菌在规定时间内都能够产生菌落。阴性对照在规定时间内均无菌生长。使用方法A和方法B均不能都生长出菌落。结果见表2。

表2 3家生产企业3种预试验方法的结果
2.3 无菌方法适用性试验
2.3.1 试验组 先用少量0.1%无菌蛋白胨溶液润湿滤膜,取供试品10支,溶于100 ml 0.9%无菌氯化钠溶液中,全量滤过至一个滤器中,用0.1%无菌蛋白胨溶液300 ml分3次冲洗,在最后一次冲洗液中在加入少于100 cfu的试验菌,滤干。将硫乙醇酸盐流体培养基100 ml加至滤器内,32.5℃培养3 d;胰酪大豆胨液体培养基100 ml加至滤桶内,22.5℃培养5 d。各需验证试验菌同法操作。
2.3.2 菌液对照组 取一只装有同体积的培养基滤器,将100 ml 0.9%无菌氯化钠溶液全量滤过,用0.1%无菌蛋白胨溶液300 ml分3次冲洗,在最后一次冲洗液中在加入与试验组等量的试验菌,作为菌液对照组。按规定温度培养5 d。各试验菌同法操作。
2.3.3 阴性对照组 另取一只装有同体积的培养基滤器,将100 ml 0.9%无菌氯化钠溶液全量滤过,用0.1%无菌蛋白胨溶液300 ml分3次冲洗,将硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基各100 ml分别加至滤器内,作为阴性对照,按规定温度培养14 d。
2.4 无菌检查 按照“2.3”项下方法取规定量供试品,溶于适量的0.9%无菌氯化钠溶液中,平均过滤至3个滤器中,用0.1%无菌蛋白胨溶液900 ml分3次冲洗,其中两个滤器中分别加入硫乙醇酸盐流体培养基各100 ml,另一个滤器中加入胰酪大豆胨液体培养基100 ml,其中一个硫乙醇酸盐流体培养基加入小于100 cfu的金黄色葡萄球菌,作为阳性对照。硫乙醇酸盐流体培养基的滤器置于32.5℃培养箱培养,胰酪大豆胨液体培养基的滤器置于22.5℃培养箱培养,均培养14 d。依法检查,应符合《中国药典》2015年版规定。
3 结果
3.1 方法适用性试验结果 按照“2.3”项下的试验方法对3家生产企业的样品进行方法适用性试验,结果表明,《中国药典》规定的各试验菌均在规定的时间内能够正常生长,该试验方法适用于注射用盐酸地尔硫的无菌检查。结果见表3。
表3 3家企业生产的注射用盐酸地尔硫无菌方法适用性试验结果
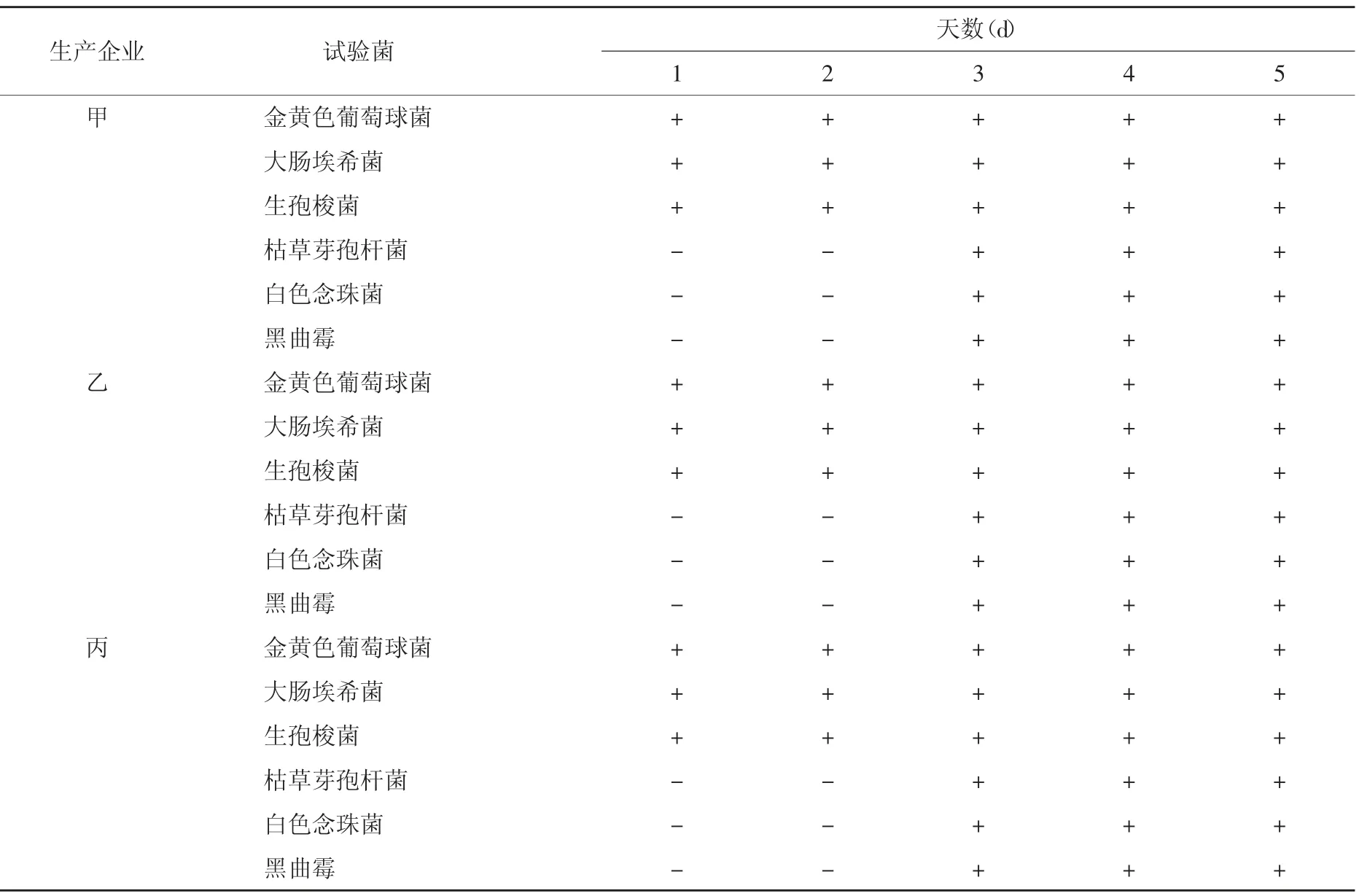
表3 3家企业生产的注射用盐酸地尔硫无菌方法适用性试验结果
注:+表示有菌落生长;-表示无菌落生长
生产企业甲乙丙试验菌金黄色葡萄球菌大肠埃希菌生孢梭菌枯草芽孢杆菌白色念珠菌黑曲霉金黄色葡萄球菌大肠埃希菌生孢梭菌枯草芽孢杆菌白色念珠菌黑曲霉金黄色葡萄球菌大肠埃希菌生孢梭菌枯草芽孢杆菌白色念珠菌黑曲霉天数(d)1 2 3+++++++++--+--+--++++++++++--+--+--++++++++++--+--+--+4++++++++++++++++++5++++++++++++++++++
3.2 无菌检查结果 按照“2.4”项下的试验方法对抽取的34批次样品进行无菌检查,培养14 d后,均无菌生长,结果均符合规定。
4 讨论
4.1 无菌方法学适用性试验条件考查 在无菌方法适用性试验的预试验中发现,注射用盐酸地尔硫有一定的抑菌性,选取了3个生产企业的3批样品进行方法学适用性试验,对比了3种试验方法A、B、C,试验得出方法C用0.1%无菌蛋白胨溶液300 ml冲洗能有效地去除药品中的抑菌成分,该方法适用于注射用盐酸地尔硫的无菌检查。
4.2 抽验结果及市场情况考查 本次国评试验抽取3个生产企业共34批次样品,涉及4个批准文号,供样单位涉及全国16个省市自治区。因此,对其进行检验和数据统计分析,可以较好地反映目前国产注射用盐酸地尔硫的质量现状和市场情况。在执行标准方面,一共涉及4个执行标准,其中2批次执行标准为《国家食品药品监督管理局标准》YBH07902005及《国家食品药品监督管理总局国家药品标准》WS1-(X-015)-2010Z-2015,2批次执行标准为《国家食品药品监督管理局标准》YBH07902005,1批次执行标准为《国家食品药品监督管理总局国家药品标准》WS1-(X-015)-2010Z-2015,29批次执行标准为《国家食品药品监督管理总局进口药品注册标准》JX20150001。各标准的无菌检查方法均参照《中国药典》2015年版四部通则无菌检查法的要求,根据各自的执行标准进行无菌检查,结果均符合规定。此次抽验结果说明注射用盐酸地尔硫在流通运输等环节稳定可靠,抽验的生产企业对该药品的原料采集、制备、工艺和生产等环节及药品的质量安全方面相对稳定。

