苦参碱经TLR4/NF-κB通路对膀胱癌小鼠免疫机制的调控作用
瞿小祥,孔东波,鲁小红,江波涛,邹伟,查文良
(咸宁市中心医院/湖北科技学院附属第一医院 泌尿外科,湖北 咸宁 437100)
膀胱癌是第二常见的泌尿系统恶性肿瘤,经尿道膀胱肿瘤切除术联合辅助化疗可以取得较好的治疗效果,但是临床研究显示膀胱癌的复发率仍高达70%,其中约15%会发展为肌肉浸润性疾病[1]。免疫抑制被认为是肿瘤发生和发展的有利特征,CD4+细胞、自然杀伤(nature kill,NK)细胞水平降低使肿瘤细胞免于被机体的免疫系统清除,研究显示核因子(nuclear factor,NF)-κB通路在膀胱癌的发生和转移中具有重要意义,并参与肿瘤的免疫逃逸机制[2-3]。近年来中药在肿瘤中的应用得到了科学家们的广泛关注,苦参碱是一种生物碱化合物,存在于中草药苦参中,据报道苦参碱具有治疗多种疾病的药理特性,如抗炎、抗病毒、抗纤维化和心血管保护作用,并且苦参碱注射液已被应用于临床[4-5]。最近的证据显示苦参碱具有抗肿瘤活性,包括乳腺癌[6]、膀胱癌[7]以及肝癌[8]等。研究表明苦参碱的抗炎和抗肿瘤作用至少部分是与NF-κB通路有关,苦参碱通过抑制Toll样受体4(Toll like receptor,TLR4)介导的NF-κB活化来减轻金黄色葡萄球菌脂磷壁酸诱导的子宫内膜炎[9]。因此,本研究主要分析苦参碱对膀胱癌小鼠模型的影响,并分析其对 TLR4/NF-κB通路和免疫水平的影响,探究其作用机制。
1 材料与方法
1.1 实验材料
人膀胱癌细胞系T24(HTB-4,ATCC公司,美国),裸小鼠(上海斯莱克实验动物中心,中国),苦参碱注射液(H2004134,广州白云山明兴制药有限公司),细胞核/胞浆细胞组分提取试剂盒(#K266-25,Biovision公司,美国),抗体和二抗(Abcam公司,美国),PVDF膜(Bio-Rad公司,美国),ECL 显色试剂盒(Thermo Fisher公司,美国),TRIzol(Sigma公司,美国),PrimeScript-RT试剂盒和SYBR Premix Ex Taq试剂盒(TAKARA公司,日本),蛋白酶K和TUNEL凋亡试剂盒(Roche公司,中国),流式细胞仪以及小鼠CD4+、CD8+、NK细胞表型抗体试剂(Becton Dickinson公司,美国),CD4+抗体(Bioworld公司,美国),IgSABC试剂盒(Spring Bioscience公司,美国)。
1.2 分组和建模
通过皮下注射的方式构建膀胱癌小鼠模型,将DMEM培养基中处于对数生长期的T24细胞重新配制成浓度为1×107个·ml-1的细胞溶液,在小鼠左侧前肢皮下注射细胞溶液0.2 ml,在建模后第7 天可以触摸到有瘤体生成,提示建模成功。随机选择36只建模成功的小鼠,随机分为对照组、苦参碱低剂量组和苦参碱高剂量组(n=12)。在建模后第8天苦参碱低剂量组和苦参碱高剂量组小鼠腹腔注射苦参碱,剂量分别为5和10 mg·kg-1[10],1次·d-1。在建模后第28天,小鼠称重,取眼眶血,然后处死小鼠。
1.3 检测指标和方法
1.3.1 肿瘤生长情况 在实验期间观察小鼠情况,并在建模后第28 天通过颈椎脱臼处死小鼠,取出肿瘤组织,称重,用游标卡尺测量皮下肿瘤并使用下式计算体积:体积=[(长度×宽度)/2]3×0.523 6。
1.3.2 细胞周期蛋白D1(Cyclin D1)、增殖细胞核抗原(PCNA)、TLR4和NF-κB蛋白表达水平的检测 采用蛋白质印迹法检测增殖相关蛋白Cyclin D1、PCNA、TLR4和NF-κB蛋白的水平来评估肿瘤细胞增殖能力。将肿瘤组织研磨后收集总蛋白,通过BCA试剂盒检测浓度。为了检测细胞核和细胞质中NF-κB蛋白的表达水平,通过细胞核/胞浆细胞组分提取试剂盒分别提取细胞质和细胞核中蛋白质。应用SDS-PAGE(120 V,90 min)分离40 μg的总蛋白。将分离的蛋白质通过湿法转移到PVDF膜上,并在膜上添加1∶500稀释的抗-CyclinD1、抗-PCNA、抗-TLR4、抗-NF-κB抗体在室温下孵育过夜。然后在室温下加入1∶5 000稀释的HRP标记的二抗,4 ℃下孵育2 h。通过ECL检测蛋白印迹带。将GAPDH作为内参,通过检测灰度分析Cyclin D1、PCNA、TLR4和NF-κB蛋白的相对表达水平。细胞质和细胞核中的NF-κB分别以GAPDH和TBP作为内参。
1.3.3 TUNEL染色检测凋亡 将肿瘤组织利用多聚甲醛固定48 h,固定后利用不同浓度的酒精进行脱水,然后加入二甲苯进行透明处理并包埋至石蜡中,使用切片机切成4 μm厚的切片。切片水化后制成玻片标本,加入蛋白酶K(20 μg·ml-1)消化,然后按照试剂盒说明书加入TUNEL试剂,于37 ℃孵育1 h。最后加入苏木精对细胞核进行复染。在显微镜下观察,计算凋亡指数(凋亡指数=凋亡染色阳性细胞数目/总细胞数目×100%),随机选择5个视野,计算均值。
1.3.4 实时荧光定量聚合酶链反应(RT-qPCR)检测mRNA 用TRIzol从肿瘤组织中提取总RNA,分别采用PrimeScript-RT试剂盒和SYBR Premix Ex TaqTM试剂盒进行逆转录(42 ℃/60 min,70 ℃/5 min,4 ℃下保存)和qPCR实验(95 ℃/10 min,94 ℃/15 s,60 ℃/1 min,60 ℃/1 min,40个循环,4 ℃下保存),内参为GAPDH。通过比较循环阈值(ΔΔCt)分析mRNA的表达水平。
1.3.5 T细胞亚群测定 采用流式细胞术检测外周血中CD4+和CD8+细胞比例,收集外周血,通过密度梯度离心法收集单个核细胞,按照试剂盒说明书分别加入CD4+和CD8+标志试剂并在避光下孵育1 h,利用FITC标记的CD4标记CD4+细胞,利用APC标记的CD8标记CD8+细胞。使用流式细胞仪测量T细胞亚群,所有实验均重复3次。
1.3.6 CD4+细胞浸润情况检测 通过免疫组化染色标记CD4蛋白检测肿瘤组织中CD4+细胞浸润情况。按照1.3.3的方法制作组织切片,将切片在-20 ℃的冷丙酮中固定15 min。然后在37 ℃下与抗小鼠CD4抗体孵育1 h,然后使用Ig SABC试剂观察,最后利用苏木精复染细胞核,棕色和黄色染色代表阳性细胞,随机选择5个视野,计算阳性染色细胞数目的平均值。
1.4 统计学处理
使用SPSS 19.0统计软件进行数据分析。计量资料以均数±标准差表示,进行ANOVA方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 苦参碱对膀胱癌小鼠模型的抑制作用
建模后第28天3组小鼠的肿瘤体积和质量比较差异有统计学意义(P<0.05),苦参碱低剂量组和苦参碱高剂量组的肿瘤体积和质量均显著低于对照组(P<0.05),苦参碱高剂量组的肿瘤体积和质量显著低于苦参碱低剂量组(P<0.05),见表1。
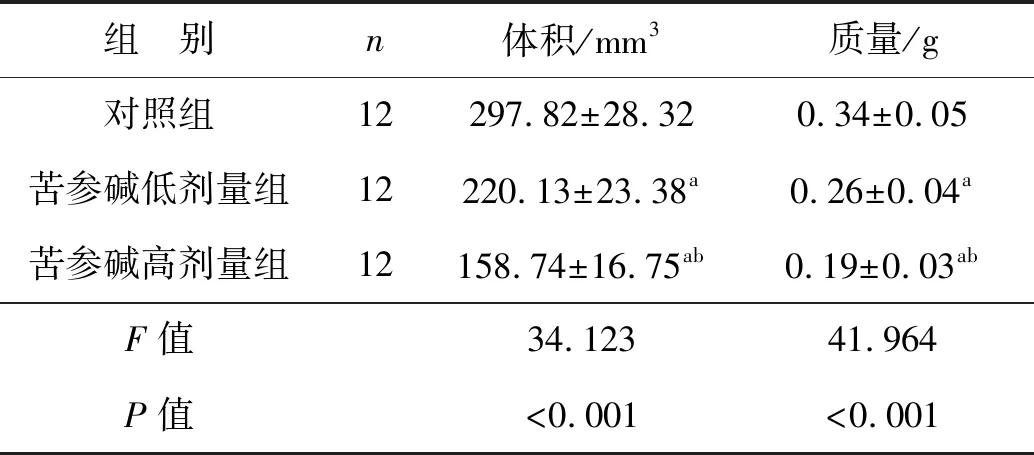
表1 苦参碱对肿瘤体积和质量的影响
2.2 苦参碱对膀胱癌小鼠模型细胞增殖的影响
3组Cyclin D1和PCNA蛋白表达水平比较差异均有统计学意义(P<0.05),苦参碱低剂量组和苦参碱高剂量组的Cyclin D1和PCNA蛋白表达水平均显著低于对照组(P<0.05),苦参碱高剂量组的Cyclin D1和PCNA蛋白表达水平均显著低于苦参碱低剂量组(P<0.05),见图1、表2。
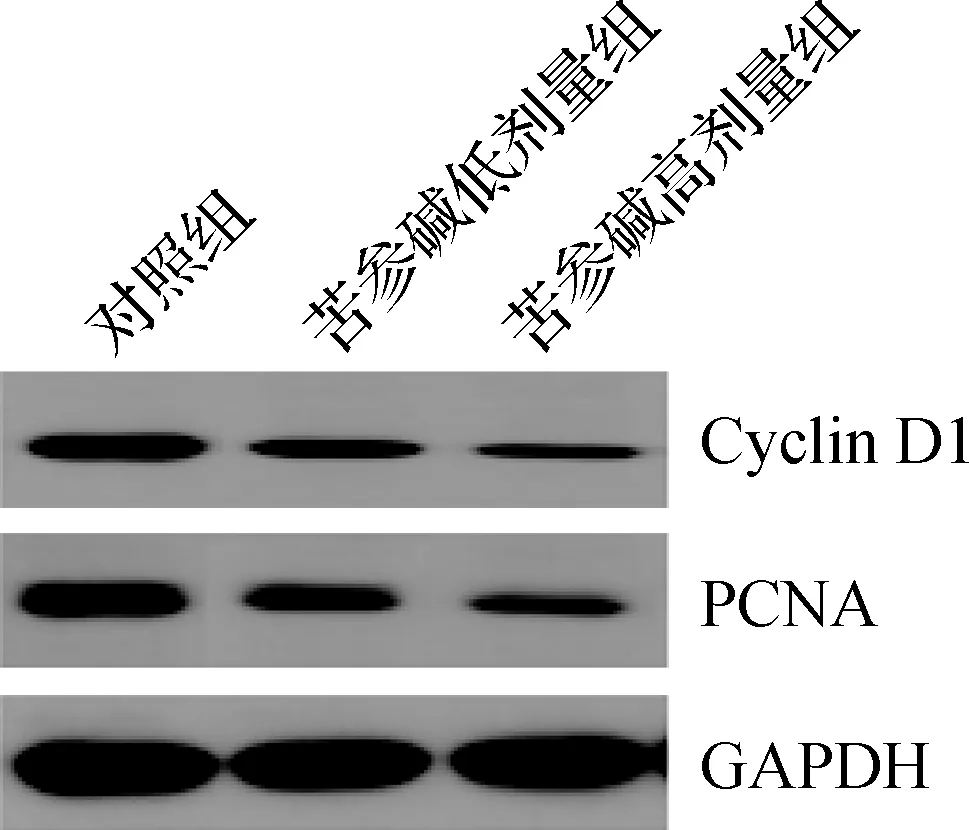
图1 蛋白质印迹法检测苦参碱对膀胱癌小鼠模型中Cyclin D1和PCNA蛋白的影响
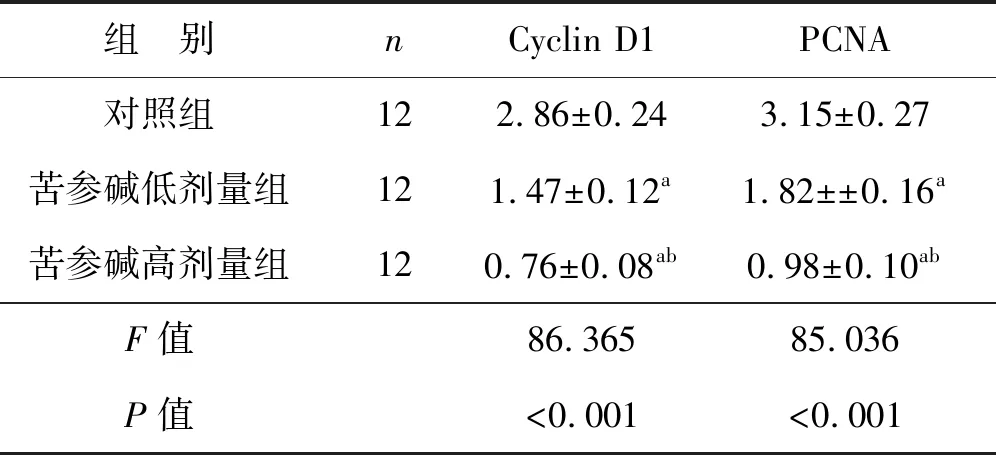
表2 苦参碱对膀胱癌小鼠模型中Cyclin D1和PCNA蛋白的影响
2.3 苦参碱对膀胱癌小鼠模型细胞凋亡的影响
如图2所示,蓝色为被染色的细胞核,棕色为凋亡细胞。3组的凋亡指数比较差异有统计学意义(P<0.05),苦参碱低剂量组和苦参碱高剂量组的肿瘤细胞凋亡指数显著高于对照组(P<0.05),并且苦参碱高剂量组的肿瘤细胞凋亡指数显著高于苦参碱低剂量组(P<0.05),见表3。
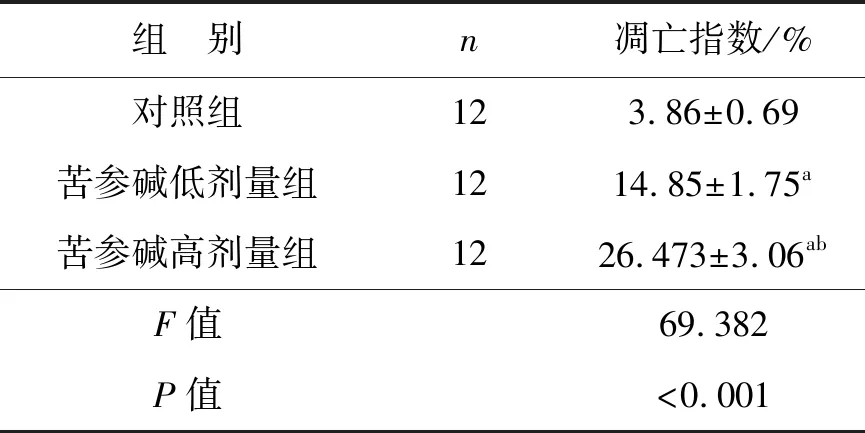
表3 苦参碱对膀胱癌小鼠模型细胞凋亡的影响

图2 TUNEL染色检测苦参碱对膀胱癌小鼠模型细胞凋亡的影响 ×200
2.4 苦参碱对膀胱癌小鼠模型肿瘤细胞TLR4/NF- κB通路中基因转录水平的影响
3组肿瘤组织中TLR4/NF-κB通路中基因转录水平比较差异有统计学意义(P<0.05),苦参碱低剂量组和苦参碱高剂量组的TLR4和NF-κB mRNA表达水平均显著低于对照组(P<0.05),苦参碱高剂量组的TLR4和NF-κB mRNA表达水平均显著低于苦参碱低剂量组(P<0.05),见表4。
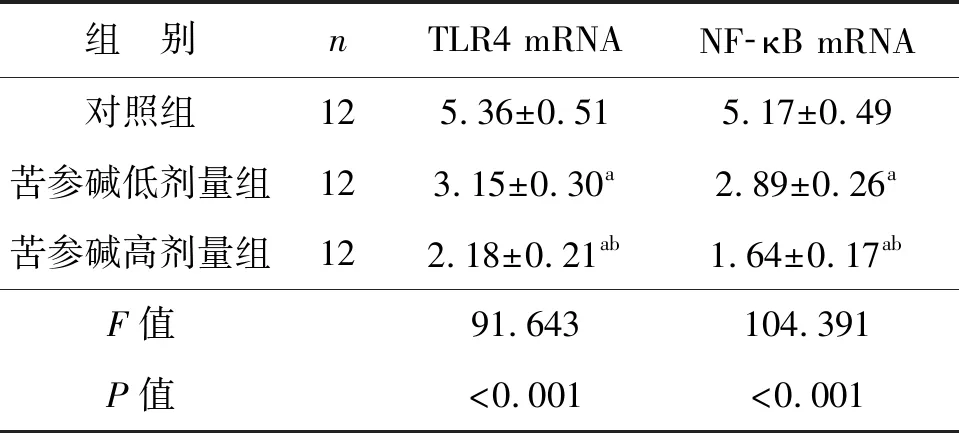
表4 苦参碱对膀胱癌小鼠模型肿瘤细胞TLR4和NF-κB mRNA水平的影响
2.5 苦参碱对膀胱癌小鼠模型肿瘤细胞TLR4和NF- κB蛋白表达水平的影响
3组肿瘤组织中TLR4和NF-κB蛋白表达水平比较差异有统计学意义(P<0.05),苦参碱低剂量组和苦参碱高剂量组TLR4和NF-κB蛋白水平均显著低于对照组(P<0.05),苦参碱高剂量组TLR4和NF-κB蛋白水平均显著低于苦参碱低剂量组(P<0.05),见图3、表5。
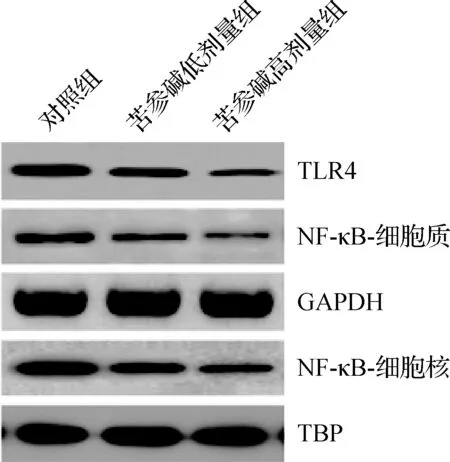
图3 蛋白质印迹法检测苦参碱对膀胱癌小鼠模型肿瘤细胞中TLR4和NF-κB蛋白水平的影响
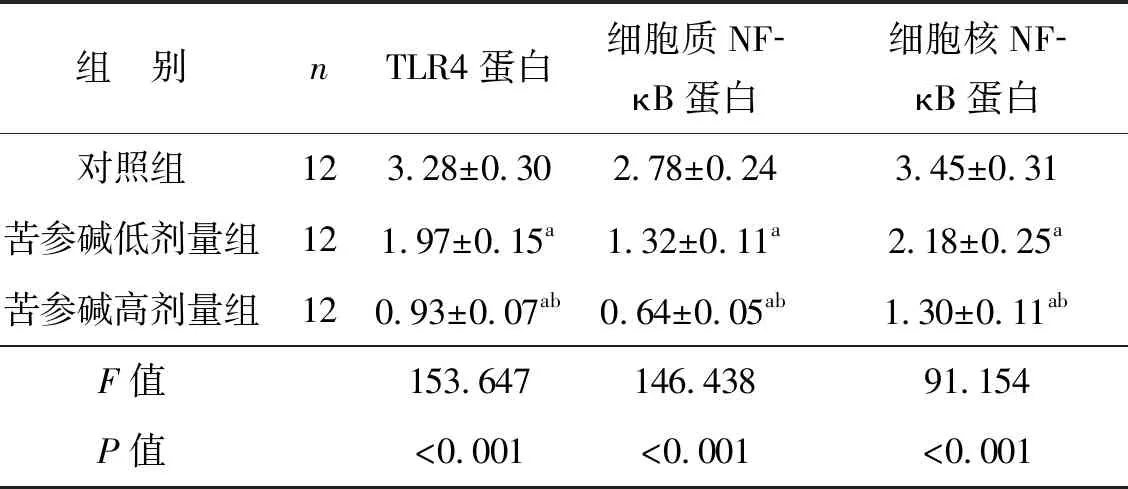
表5 苦参碱对膀胱癌小鼠模型肿瘤细胞TLR4和NF-κB蛋白表达水平的影响
2.6 苦参碱对膀胱癌小鼠模型T淋巴细胞亚群的影响
3组小鼠CD4+细胞百分比和CD4+/CD8+差异有统计学意义(P<0.05),CD8+细胞百分比差异无统计学意义(P>0.05)。苦参碱低剂量组和苦参碱高剂量组的CD4+细胞百分比和CD4+/CD8+均显著高于对照组(P<0.05),苦参碱高剂量组的CD4+细胞百分比和CD4+/CD8+均显著高于苦参碱低剂量组(P<0.05),见图4、表6。
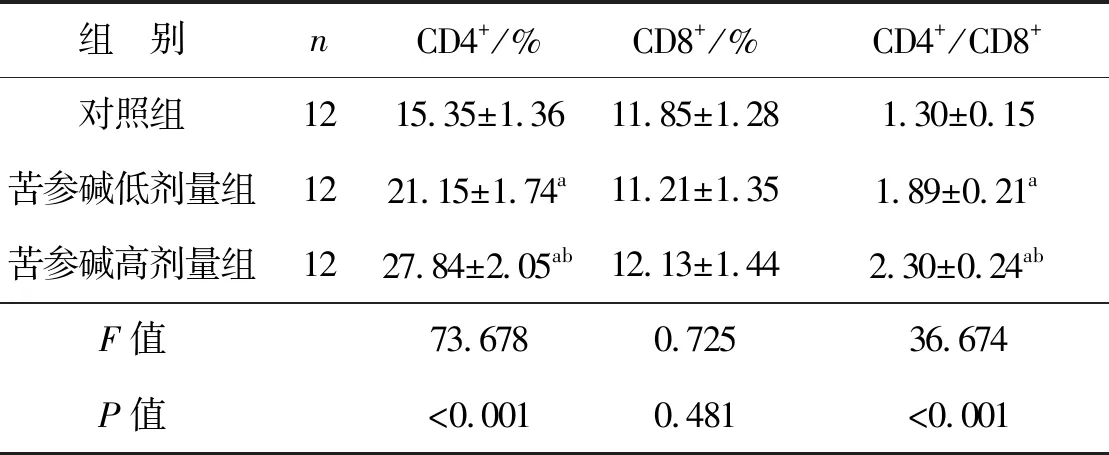
表6 苦参碱对膀胱癌小鼠模型T淋巴细胞亚群的影响
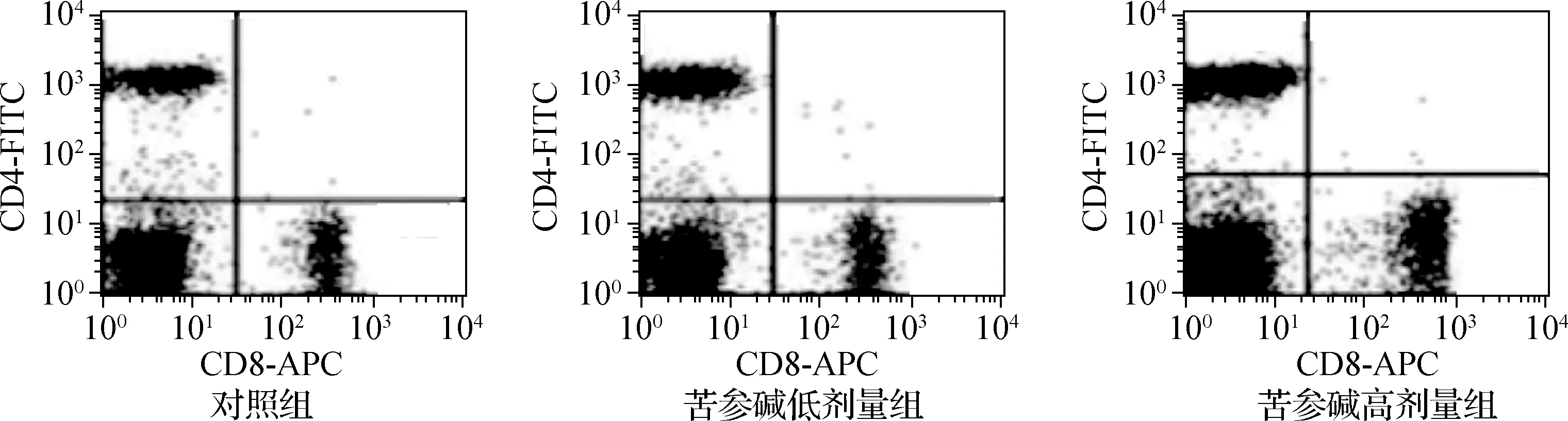
图4 流式细胞术检测苦参碱对膀胱癌小鼠模型T淋巴细胞亚群的影响
2.7 苦参碱对膀胱癌小鼠模型肿瘤组织中CD4+细胞浸润的影响
3组CD4+细胞数目比较差异有统计学意义(P<0.05)。苦参碱低剂量组和苦参碱高剂量组的CD4+细胞数目显著高于对照组[(6.47±0.85)个](P<0.05),苦参碱高剂量组的CD4+细胞数目[(59.65±5.03)个]显著高于苦参碱低剂量组[(24.24±2.76)个](P<0.05)。
3 讨 论
膀胱癌是男性最常见的恶性肿瘤之一,现阶段治疗膀胱癌的方法主要有化学疗法和根治性膀胱切除术等,尽管外科手术技术、化学疗法和放射疗法取得了重大的进步,但膀胱癌的总体生存率仍然较低[11]。寻找新的、有效的治疗膀胱癌的方法具有重要意义。
苦参碱是一种生物碱,主要来源于中药苦参以及豆科植物和槐属植物的根和茎。在临床上,苦参碱在治疗心血管疾病、炎症和神经系统疾病中有着广泛应用[12-13]。苦参碱会影响多种细胞生物学过程,包括线粒体功能、细胞氧化应激、自噬、代谢、钙平衡和内质网应激[14-15]。近年来,其抗肿瘤活性引起了广泛的关注,有体外研究发现苦参碱对膀胱癌细胞系BIU-87具有抑制作用[16]。一项最新研究结果显示苦参碱对于膀胱癌模型大鼠也具有抑制作用[17],但是相关研究极少,苦参碱是否可以剂量依赖性地抑制膀胱癌仍不明确,并且其作用机制也不清楚。本研究结果显示,苦参碱可以剂量依赖性地抑制肿瘤增殖相关蛋白CyclinD1和PCNA的表达,诱导细胞凋亡,抑制肿瘤的生长。此外,本研究还发现苦参碱可以剂量依赖性地抑制TLR4和NF-κB的转录和翻译。大量研究已经证实了TLR4/NF-κB通路在膀胱癌发生和进展中的作用,TLR4可以使NF-κB磷酸化激活,NF-κB被激活后会进入细胞核诱导促癌基因的转录[18-19]。有研究显示,苦参碱通过抑制TLR4/MyD88/NF-κB途径和NLRP3炎性小体抑制猪肺泡巨噬细胞中炎性细胞因子的分泌[20]。苦参碱可以通过抑制过氧化氢处理的胰腺细胞中cadherin和Vimentin蛋白的表达,从而抑制其迁移和侵袭能力[21]。张弦等[22]研究显示,苦参碱通过抑制TLR4信号通路的转导调控肝细胞的凋亡 。Huang等[23]通过体内研究发现苦参碱可以明显抑制前列腺癌小鼠模型中NF-κB蛋白的表达水平,从而抑制肿瘤的生长和转移。结合过往研究结果,本研究提示苦参碱可通过抑制膀胱癌细胞中的TLR4和NF-κB的转录和翻译、NF-κB蛋白的表达和激活,进而抑制促癌基因的转录水平,从而抑制膀胱癌细胞的生长并诱导凋亡。
免疫抑制是肿瘤的重要特点之一,膀胱癌患者的T淋巴细胞受到抑制,CD4+细胞比例降低,并且CD4+/CD8+值降低[24]。肿瘤组织中T细胞减少不但会直接导致肿瘤的进展和转移,其分泌的干扰素γ和白细胞介素2等水平也降低,从而抑制巨噬细胞的活化和肿瘤细胞的清除[25]。研究已经显示了CD4+T细胞可以以MHC Ⅱ类依赖性方式杀死自体肿瘤细胞,提高CD4+T细胞比例是免疫疗法的有效途径之一[26]。使用T细胞激活剂可以改善膀胱癌患者的临床结果[27]。本研究结果显示,苦参碱可以剂量依赖性的方式提高膀胱癌小鼠模型中CD4+的比例和CD4+/CD8+值,并且免疫组化染色结果也显示了苦参碱可以提高肿瘤组织中的CD4+细胞浸润。最新临床研究显示,苦参碱注射液可以通过提高免疫能力对新型冠状病毒肺炎的治疗起到辅助作用[28]。张瑞奎等[29]的研究结果显示苦参碱可以剂量依赖性地提高乳腺癌大鼠模型外周血中CD3+和CD4+细胞的比例,促进干扰素γ和肿瘤坏死因子α的表达,并抑制免疫抑制因子的表达。这提示苦参碱可通过促进CD4+细胞的水平提高机体的免疫能力,提高肿瘤组织中浸润的CD4+细胞水平,从而通过分泌干扰素γ和肿瘤坏死因子α诱导巨噬细胞的激活,进而发挥抗膀胱癌功能。
综上所述,在膀胱癌小鼠模型中,苦参碱不但可以通过抑制TLR4/NF-κB通路诱导膀胱癌细胞的凋亡和抑制增殖,还可以提高CD4+/CD8+值促进CD4+细胞的肿瘤组织浸润。但是关于苦参碱在膀胱癌中的作用和调控T淋巴细胞的分子机制还需进一步研究。

