颅内动脉瘤组织中Septin4 的表达及其通过调节自噬对人脑血管平滑肌细胞的作用研究
杨明环,张波,邓爱平,张力,曹刚
[1.十堰市太和医院(湖北医药学院附属医院),湖北 十堰 442000;2.珠海市中西医结合医院(南方医科大学附属珠海医院)脑外科,广东 珠海 519000]
颅内动脉瘤(intracranial aneurysm,IA)是一种严重的神经系统疾病,生存率低,预后差[1]。IA是由血管畸形引起的,在全世界范围内患病率为3.2%。除了先天性因素外,后天性因素如吸烟、高血压和过度饮酒等其他因素也有助于IA的形成和发展[2]。IA由于其高发病率,高致残、致死率的特点,一直以来备受人们的关注。血管细胞功能障碍、血管壁退行性改变、炎症和免疫反应等内在因素也在IA的发生中起重要作用[3]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的表型调控与IA的破裂和形成有关[4]。Septin4是Septins家族的一个亚型,具有GTPase活性,有多个剪接体。Septin4是细胞骨架的重要组成部分,参与许多重要的生理过程,如细胞运输和凋亡[5]。最近的研究[6]表明,Septin4通过调节人主动脉平滑肌细胞的表型转化调控动脉粥样硬化疾病进展。目前,关于Septin4在IA中的作用及其可能的作用机制尚不明确。因此,本研究以IA和人脑血管平滑肌细胞(human brain vascular smooth muscle cells,HBVSMCs)为研究对象,旨在探究Septin4在IA中的表达,及对HBVSMCs表型转化的作用及其可能的作用机制,以期为探明IA的发病机制及开发新的临床治疗策略提供新的科学依据。
1 材料与方法
1.1 组织样本
选取2017年1月至2018年3月行开颅动脉瘤夹闭术切除的32份IA组织样本,患者中男21例,女11例,年龄37~69岁,平均(49.69±8.26)岁。纳入标准:数字减影血管造影、CT血管成像确诊为IA患者。排除标准:(1)有高血压、糖尿病、肿瘤等病史者;(2)就诊前接受动脉瘤夹闭手术或血管治疗者;(3)有颅内多发动脉瘤者。此外,收集同期行颅内血肿清除术或内减压术的颅脑外伤患者的正常颅动脉组织32份,患者中男18例,女14例,年龄27~63岁,平均(43.38±10.09)岁。IA患者与正常颅动脉患者性别、年龄等一般情况比较差异无统计学意义(P>0.05),具有可比性。
1.2 主要材料与试剂
原代HBVSMCs购自上海信裕生物科技有限公司;平滑肌22α(SM22α)和平滑肌α肌动蛋白(αSMA)抗体购自英国Abcam公司;Lipofectamine2000TM转染试剂购自美国Thermo Fisher Scientific公司;SYBR®Premix Ex TaqTMⅡ试剂盒购自日本TAKARA公司;过表达Septin4载体(简称Septin4)及其阴性对照(NC)、Septin4 si-RNA干扰序列(si-Septin4-1和si-Septin4-2)及其阴性对照(si-NC)购自上海吉凯基因化学技术有限公司;Septin4、基质金属蛋白酶(MMP)2、MMP9、微管相关蛋白1轻链3(LC3)、sequestosome 1(p62)和磷酸甘油醛脱氢酶(GAPDH)抗体购自武汉三鹰生物技术有限公司;磷酸化腺苷酸活化蛋白激酶[p-AMPK(Thr172)]、腺苷酸活化蛋白激酶(AMPK)、磷酸化哺乳动物类雷帕霉素靶蛋白[p-mTOR(Ser2448)]和哺乳动物类雷帕霉素靶蛋白(mTOR)抗体购自美国Cell Signaling Technologies公司。
1.3 免疫组化检测Septin4蛋白表达
临床标本用4%多聚甲醛固定72 h,梯度酒精脱水,二甲苯透明,石蜡包埋、切片。常规脱蜡至水,3% H2O2避光孵育15 min,PBS清洗后5%BSA避光孵育1 h,Septin4一抗稀释液(1∶400)4 ℃孵育过夜。二抗稀释液(1∶200)避光孵育1 h。DAB显色液显色,苏木素染液染色5 min。自来水冲洗,1%盐酸酒精溶液分化10 s,0.2%氨水做返蓝处理8 s,自来水冲洗后切片进行脱水、透明处理,中性树胶封片,光学显微镜观察分析。
1.4 免疫荧光染色检测SM22α和αSMA表达
石蜡切片常规脱蜡至水,3%H2O2避光孵育15 min,PBS清洗后5%BSA避光孵育1 h。SM22α(1∶400)和αSMA(1∶200)抗体4 ℃孵育过夜。荧光标记二抗(1∶200)避光孵育30 min,DAPI室温染核20 min。防荧光淬灭剂封片,荧光显微镜观察。
1.5 细胞培养
HBVSMCs用含10% FBS的DEMD(高糖)培养基于37 ℃、5% CO2培养箱中培养。待细胞密度达到80%~90%时,0.25%胰酶液消化细胞,按1∶3比例传代培养。
1.6 细胞分组与转染
将HBVSMCs按4×105个·孔-1密度接种于6孔板,于37 ℃、5%CO2培养箱中培养24 h后将细胞随机分为空白对照组(NC组)、si-NC组、si-Septin4-1组、si-Septin4-2组,每组设置3个重复,按照Lipofectamine2000TM说明书进行si-NC、si-Septin4-1和si-Septin4-2的转染。另外,将细胞随机分为NC组、Septin4组、si-NC组和si-Septin4组,每组设置3个重复,按照Lipofectamine2000TM说明书进行NC、Septin4、si-NC和si-Septin4(干扰效率最高的si-Septin4)的转染。37 ℃、5%CO2条件下培养48 h后进行后续实验。
1.7 RT- PCR检测Septin4 mRNA表达
收集临床标本或转染后的HBVSMCs,Trizol法提取细胞总RNA,测定RNA浓度,将RNA逆转录合成cDNA。按照SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行RT-PCR实验。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。Septin4以GAPDH为内参,采用2-ΔΔCt法计算其mRNA表达。Septin4上游引物5′-CAGATCTGCTTGGGTAGATCC-3′,下游引物5′-CTCGTTCATATCGTGAGTGATGG-3′;GAPDH上游引物5′-ATCCACGGGAGAGCGACAT-3′,下游引物5′-CAGCTGCTTGTAAAGTGGAC-3′。
1.8 蛋白质印迹法检测蛋白表达
收集临床标本或转染后的HBVSMCs,RIPA裂解液裂解外泌体或细胞,取上清,BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE分离,随后将胶中的蛋白转至PVDF膜上。10%脱脂奶粉室温封闭3 h,Septin4(1∶2 500)、αSMA(1∶1 000)、SM22α(1∶2 000)、MMP2(1∶5 000)、MMP9(1∶5 000)、LC3(1∶2 000)、p62(1∶1 000)、p-AMPK(1∶2 000)、AMPK(1∶1 000)、p-mTOR(1∶1 000)、mTOR(1∶1 000)和GAPDH(1∶5 000)4 ℃孵育过夜,HRP标记二抗(1∶5 000)室温孵育1 h。ECL发光液显色,暗室曝光。
1.9 统计学处理
采用SPSS 21.0软件进行数据的统计分析,检测所得数据以均值±标准差表示,多组间比较采用单因素方差分析,若组间差异有统计学意义则采用LSD(L)检验,以双侧P<0.05表示差异具有统计学意义。
2 结 果
2.1 IA组织和正常颅动脉组织中Septin4表达水平的比较
免疫组化检测结果显示,与正常颅动脉组织相比,IA组织中Septin4阳性细胞数明显降低(P<0.05)(表1、图1A);RT-PCR和蛋白质印迹法检测结果显示,与正常颅动脉组织相比,IA组织中Septin4 mRNA和蛋白表达明显降低(P<0.05)(表1,图1B、C)。

表1 两组免疫组化检测结果比较
2.2 IA组织和正常颅动脉组织中SM22α和αSMA蛋白表达水平的比较
免疫荧光染色结果显示,与正常颅动脉组织相比,IA组织中SM22α和αSMA荧光强度明显降低(P<0.05)(表2)。

a与正常颅动脉组织比较,P<0.05

表2 两组免疫荧光染色结果比较 AU
2.3 si- RNA沉默Septin4的效率检测
RT-PCR和蛋白质印迹法检测结果显示,与si-NC组相比,si-Septin4-1组和si-Septin4-2组细胞Septin4的mRNA和蛋白表达均明显降低(P<0.05)(表3、图2),其中si-Septin4-2组细胞变化更为明显,因此选取si-Septin4-2进行后续实验,简称为si-Septin4。

表3 不同si-RNA沉默Septin4效率的比较
2.4 Septin4对HBVSMCs表型转化的影响
RT-PCR检测结果显示,与NC组相比,过表达Septin4组细胞中Septin4 mRNA表达明显升高(P<0.05);与si-NC组相比,si-Septin4组细胞中Septin4 mRNA表达明显降低(P<0.05)(表4、图3A)。蛋白质印迹法检测结果显示,与NC组相比,过表达Septin4组细胞中Septin4、αSMA和SM22α蛋白表达明显升高αSMA和SM22α蛋白表达明显降低(P<0.05),MMP2和MMP9蛋白表达明显升高(P<0.05)(表5、图3B、C)。

表5 4组 αSMA、SM22α、MMP2和MMP9的蛋白表达结果比较

a与si-NC组比较,P<0.05

表4 4组HBVSMCs表型转化的结果比较
2.5 Septin4对HBVSMCs细胞自噬的影响
蛋白质印迹法检测结果显示,与NC组相比,Septin4组细胞中LC3Ⅱ/LC3Ⅰ蛋白表达明显降低(P<0.05),p62蛋白表达明显升高(P<0.05);与si-NC组相比,si-Septin4组细胞中LC3Ⅱ/LC3Ⅰ蛋白表达明显升高(P<0.05),p62蛋白表达明显降低(P<0.05)(表6、图4)。
2.6 Septin4对AMPK/mTOR信号通路的影响
蛋白质印迹法检测结果显示,与NC组相比,Septin4组细胞中p-AMPK/AMPK蛋白表达明显降低(P<0.05),p-mTOR /mTOR蛋白表达明显升高(P<0.05);与si-NC组相比,si-Septin4组细胞中p-AMPK/AMPK蛋白表达明显升高(P<0.05),p-mTOR /mTOR蛋白表达明显降低(P<0.05)(表7、图5)。
3 讨 论
IA是由颅内动脉壁的病理性局部扩张形成的肿瘤样突起。IA的破裂是蛛网膜下腔出血的主要原因,其发病率和死亡率较高[7]。到目前为止,IA的确切发病机制仍不清楚。VSMCs具有可塑性高和收缩功能强的特点。在病理条件下,它可以从具有收缩功能的分化表型转变为具有较强增殖和迁移能力的去分化表型。VSMCs通过表型调节参与IA形成、发展和破裂的发病机理[8]。因此,本研究旨在探究Septin4对HBVSMCs表型转化的影响及其可能的作用机制,以期为IA确切发病机制的探明及治疗提供新的科学依据。
VSMCs是血管壁中主要的细胞类型,具有多种功能。VSMCs有收缩型和合成型两种不同的类型。收缩表型的标志物包括SM22α、αSMA、平滑肌肌球蛋白重链(SM myosin heavy chain,MHC)、h1-calponin和smoollin,合成型的标志物有MMPs[9]。在炎症和氧化应激等病理刺激下,收缩表型的VSMCs可以转化为合成型,SM22α和αSMA等表达下调,MMPs以及其他炎症介质的表达上调。VSMCs失去收缩能力,但有助于促炎细胞的募集和血管壁细胞外基质的重塑[10]。VSMCs表型调控与IA的形成、生长和破裂有关。氧化应激可以诱导表型转换的VSMCs刺激促炎过程、细胞外基质重塑和壁细胞凋亡,最终促进IA的形成和破裂[11]。Septins除了具有胞质分裂的作用和丝形成能力外,还参与膜动力学、细胞骨架重建、囊泡运输和肿瘤发生等生物学进程[12]。已有研究表明,Septin4参与调控VSMCs表型转化[6],该研究结果提示,Septin4可能在IA疾病进展中发挥重要作用。本研究结果显示,IA组织中SM22α和αSMA表达下调,提示IA组织中VSMCs向合成型表型转化,此外IA组织中Septin4表达下调。体外实验结果显示,过表达Septin4可上调SM22α和αSMA表达,下调MMP2和MMP9表达,而干扰Septin4后则表现相反变化,该结果表明,Septin4可促进HBVSMCs向收缩型表型转化。

a与NC组比较,P<0.05;b与si-NC组比较,P<0.05
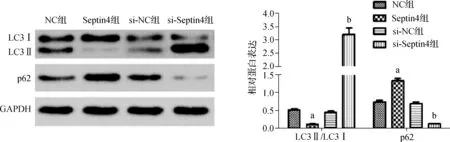
a与NC组比较,P<0.05;b与si-NC组比较,P<0.05
细胞自噬被认为是调控VSMCs表型转换的机制之一[13]。激活细胞自噬可促进VSMCs由收缩表型转化为合成表型,从而参与IA的发生发展[14]。研究表明,IA组织中miR-4735表达下调,过表达miR-4735通过靶向HIF-1α抑制HIF-1α介导的自噬,抑制VSMCs迁移和侵袭,从而抑制IA疾病进展[15]。已有研究[16]表明,Septin4可抑制VSMCs向合成型表型转化和细胞自噬。本研究结果显示,过表达Septin4可上调自噬相关蛋白p62蛋白表达,抑制LC3Ⅱ/LC3Ⅰ蛋白表达,而干扰Septin4后则表现相反作用。结果表明,Septin4可通过抑制自噬在IA中发挥保护作用。AMPK/mTOR信号通路是复杂信号网络中介导自噬的经典途径。mTOR 是一个自噬的负性调节因子,mTOR磷酸化会抑制自噬起始分子ULK1功能。此外,AMPK可通过抑制mTOR活化、磷酸化ULK1激活其活性,从而促进自噬的发生[17]。研究[18]表明,激活VSMCs中AMPK/mTOR/ULK1信号通路可激活自噬,最后诱导VSMCs表型转化。本研究结果显示,过表达Septin4可抑制AMPK磷酸化,促进mTOR磷酸化,而干扰Septin4则表现出相反变化。结果表明,Septin4可能通过调节AMPK/mTOR信号通路抑制自噬,在VSMCs中发挥重要作用。

a与NC组比较,P<0.05;b与si-NC组比较,P<0.05
综上所述,本研究结果表明Septin4在IA中低表达,其可能通过AMPK/mTOR信号通路抑制自噬和HBVSMCs向合成表型转化,阻滞IA疾病进程。该研究结果为进一步明确Septin4在IA中的作用,及开发新的临床治疗策略提供了科学依据。

