妊娠期糖尿病孕妇血清miRNA-137表达与新生儿高胆红素血症的关系研究
董小菡,王亮,杜晓琴,于文亮,高迎春
(电子科技大学医学院附属绵阳医院·绵阳市中心医院 妇产科,四川 绵阳 621000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是一种常见的妊娠期疾病,对母亲和新生儿都会造成较高的并发症风险,例如新生儿高胆红素血症[1]。修正的Pedersen 假说提出,母体的高糖环境易过度刺激胎儿胰腺 b 细胞,加速有氧代谢,增加胎儿的需氧量。但同时高糖环境又进一步减少母胎供氧量,从而造成胎儿相对缺氧的状态[2-3]。这可能是导致新生儿发生高胆红素血症的重要生理机制之一。GDM的发病原因十分复杂,其中微小RNA(microRNA,miRNAs)在其中的作用不容忽视。Peng等[4]通过多项研究证实miR-137表达上调与GDM 诱导的内皮细胞功能障碍有关,而且下调 miR-137可以保护人类胚胎免受高糖诱导的氧化应激损伤;此外Chen等[5]通过小鼠实验发现miR-137是结构性雄烷受体(constitutive androstane receptor,CAR)的抑制因子,因此是胆红素清除率的关键性决定因素,并有望成为治疗新生儿高胆红素血症的潜在分子靶点。我们在前期预实验中发现miR-137不仅在GDM孕妇的胎盘组织中有异常表达,而且也稳定存在于孕妇的血液循环中。因此本研究旨在检测GDM孕妇孕晚期血清 miR-137的表达,并探讨其是否有望成为新生儿高胆红素血症潜在的预测指标。
1 对象与方法
1.1 研究对象
选取2018年6月至2019年6月入院的73例GDM孕妇[年龄22~44岁,平均(31.62±5.03)岁]作为GDM组。纳入标准:符合美国糖尿病协会最新制定的GDM诊断标准[6],在孕24~28周完成口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),空腹血糖≥5.1 mmol·L-1,1 h血糖≥10.0 mmol·L-1或2 h血糖≥8.5 mmol·L-1,被诊断为GDM;分娩孕周37~42周;自然受孕;单胎妊娠。排除标准:有沟通障碍或严重精神疾病者;有恶性肿瘤或严重心脏、肺、肝、肾及其他功能障碍者;妊娠前合并有糖尿病、高血压或内分泌和代谢疾病史者;合并妊娠期高血压、妊娠期甲减、子痫前期等其他妊娠期合并症者。另外将新生儿宫内死亡或死胎者(缺少新生儿胆红素或葡萄糖测量数据)、产检或产后数据记录缺失、由已知溶血因素造成的高胆红素血症(如猴同种免疫接种和ABO血型不相容)者排除在本研究外。另外选择80例年龄、分娩孕周相匹配[年龄20~45岁,平均(30.49±5.33)岁]、妊娠期无GDM的孕妇作为对照组。本研究获得我院伦理委员会批准。在参与者签署同意书后获取其孕24~28周血清样本以及分娩后新鲜的胎盘组织样本。根据新生儿经皮胆红素监测和血清总胆红素(serum total bilirubin,TSB)检测结果,将GDM组分为高胆红素血症组(n=23),其诊断符合中华医学会儿科学分会新生儿学组相关诊断标准[7]:出生后7 d每日7:30进行经皮胆红素监测,黄疸指数分别为出生24 h内>6,24 h 后足月儿>12.9、早产儿>15;在出生时、光疗前测定血清总胆红素水平,以出生 24 h 内 >102 μmol·L-1,24 h后足月儿>220.6 μmol·L-1、早产儿>255 μmol·L-1作为诊断新生儿高胆红素血症的诊断标准;不符合上述高胆红素血症诊断标准的新生儿纳入非高胆红素血症组(n=50)。
1.2 孕妇血清和胎盘组织中miR- 137的测定
收集孕24~28周的肘部静脉血液样本,留取血清,保存在血液样本库中用作后续的生物学分析。另外在分娩时留取新鲜的胎盘组织样本,置于液氮中24 h 后,更换到-80 ℃保存备用。在提取总RNA前,将血清样本复溶。用Trizol试剂提取总RNA,提取后鉴定RNA浓度及纯度,确保可以用于后续样品检测。再用miRNA first-strand cDNA试剂盒进行逆转录反应,使用miRcute miRNA qPCR检测试剂盒中的试剂、各0.5 μl上下游引物、1 μl cDNA样本配制15 μl PCR反应体系,用7300型热循环仪进行反应,以小分子U6snRNA作为内参,2-ΔΔCt法计算miR-137相对表达量。试剂盒购自天根生化科技(北京)有限公司。miR-137上游引物:5′-ATA GAG CGG CCA TTT GGA TT-3′,miR-137下游引物:5′-TCA AGG CCT TTC AGT CGT TC-3′。
1.3 统计学处理
2 结 果
2.1 GDM组和对照组一般资料的比较
GDM组孕妇产前空腹血糖、新生儿出生身高以及Apgar 5 min评分<7分的新生儿比例显著高于对照组,差异具有统计学意义(P<0.05);两组孕妇年龄、体重指数、吸烟史、家族糖尿病史、收缩压、舒张压、胎儿分娩孕周、出生体重、出生头围、生产方式等差异无统计学意义(P>0.05)。见表1。

表1 GDM组和对照组一般资料的比较
2.2 GDM组和对照组孕妇血清及胎盘组织miR- 137表达水平的比较
与对照组比较,GDM组血清、胎盘组织miR-137表达水平显著升高,差异具有统计学意义(P<0.05),见表2。Pearson相关分析显示,GDM组孕妇血清和胎盘组织中miR-137表达呈正相关(r=0.623,P<0.05),见图1。

表2 GDM组和对照组孕妇血清和胎盘组织中miR-137表达水平的比较[M50(P25,P75)]
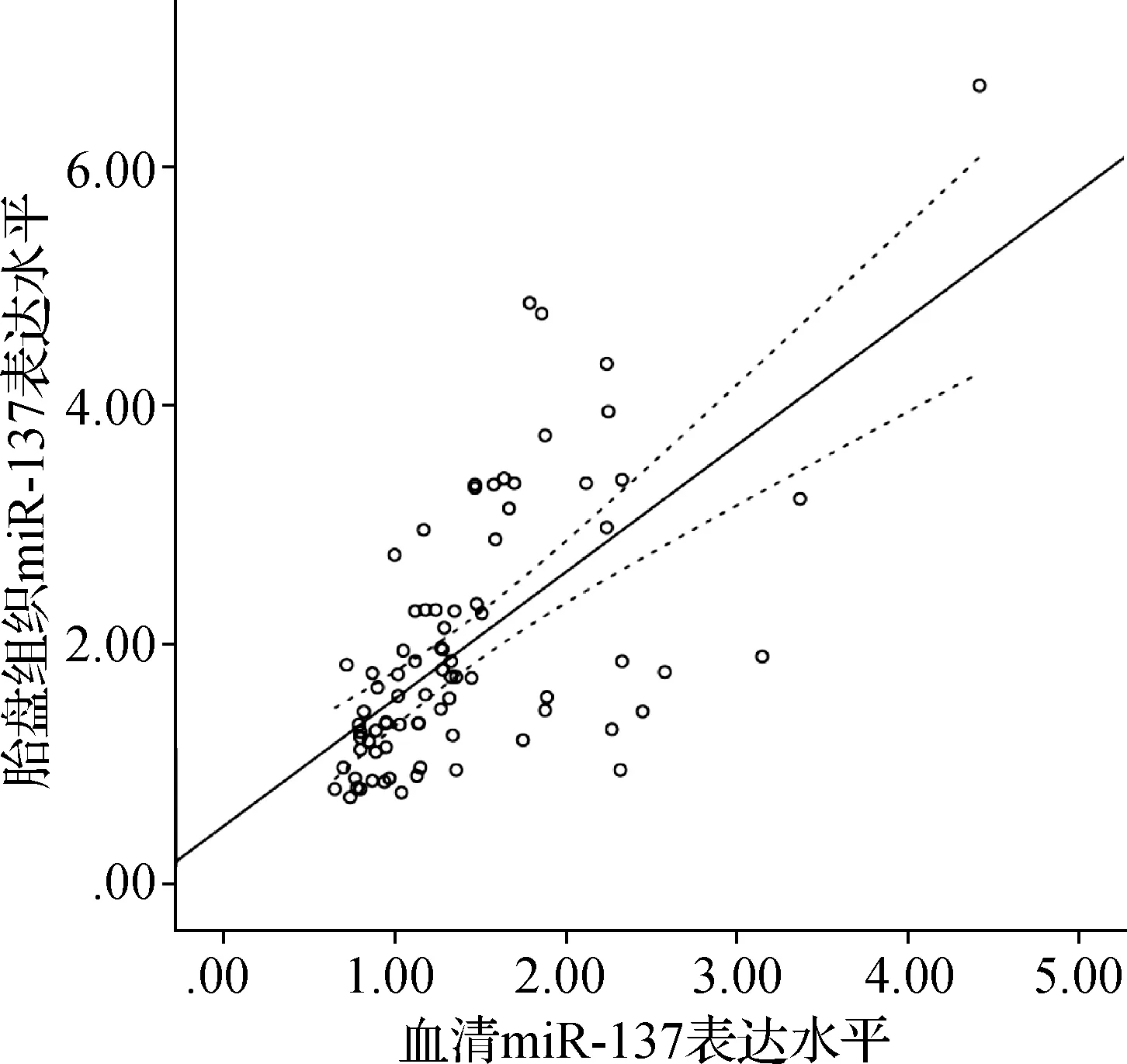
图1 GDM组孕妇血清和胎盘组织中miR-137表达的相关性
2.3 GDM组孕妇血清miR- 137表达水平与新生儿高胆红素血症的关系
GDM组有23例新生儿发生高胆红素血症,高胆红素血症组孕妇血清miR-137表达水平高于非高胆红素血症组(2.12±0.79vs.1.13±0.31),差异具有统计学意义(P<0.05)。Pearson相关分析显示,GDM组孕妇血清miR-137表达水平与新生儿血清胆红素水平呈正相关(r=0.378,P<0.05),见图2。

图2 GDM组孕妇血清miR-137表达水平与新生儿血清胆红素水平的关系
2.4 新生儿发生高胆红素血症的影响因素
以新生儿是否发生高胆红素血症为因变量,进行单因素和多因素Logistic回归分析,结果显示,孕妇吸烟史、巨大儿、新生儿Apgar 5 min评分<7分、孕妇血清miR-137水平升高都是影响新生儿高胆红素血症的独立危险因素,见表3。

表3 单因素和多因素Logistic回归分析新生儿发生高胆红素血症的影响因素
2.5 ROC曲线分析GDM孕妇血清miR- 137水平对新生儿高胆红素血症的预测价值
GDM孕妇血清miR-137水平预测新生儿高胆红素血症的曲线下面积(AUC)为0.904(0.825,0.983),截断值1.685,在该截断值下灵敏度为0.739,特异度为0.947,见图3。

图3 GDM孕妇血清miR-137水平预测新生儿高胆红素血症的ROC曲线
3 讨 论
GDM是一种常见的妊娠期疾病,对母亲和新生儿都会造成较高的并发症风险,例如肥胖、糖代谢紊乱、心血管疾病等[8]。新生儿高胆红素血症是GDM常见的并发症之一[9]。在本研究中我们发现,诊断时孕妇血清miR-137水平升高、孕妇吸烟史、巨大儿以及新生儿出生时Apgar 5 min评分<7分都是GDM组发生新生儿高胆红素血症的独立危险因素,尤其是检测孕妇血清miR-137表达水平对于预测新生儿高胆红素血症发生风险有一定的指导意义。
目前关于筛查GDM孕妇发生新生儿高胆红素血症的危险因素研究相对较少。最近Thevarajah等[10]学者开展的一项单中心大样本临床调查研究结果显示,诊断时较低的胎龄、多胎妊娠、子痫前期、巨大儿等都与高胆红素血症的发生独立相关(P<0.05)。之前Langer[11]进行临床研究发现,未经治疗的GDM孕妇的新生儿低血糖和高胆红素血症发生风险较健康对照组孕妇增加2~4倍。根据修正的Pedersen 假说,在母体高血糖情况下,母胎葡萄糖浓度梯度落差较大,葡萄糖转运蛋白1载体可将母体血清中过量的葡萄糖转移至胎盘,通过过度刺激胎儿胰腺 b 细胞,进而产生高胰岛素血症的胎儿环境。而这种高胰岛素血症环境可刺激有氧代谢,增加胎儿需氧量。但是GDM孕妇血清糖化血红蛋白升高和胎盘血流量减少则导致母胎供氧量减少,从而造成了胎儿相对缺氧的状态。高胆红素血症被认为是这种相对缺氧状态的反调节机制,它触发了红细胞分泌和促进红细胞产生。
目前已经有越来越多的研究人员证实miR-137与机体代谢调控机制密切相关。Peng等[12]学者报道,重度GDM孕妇胎盘组织和高糖环境中的滋养层细胞系HTR-8/SVneo 细胞中 miR-137表达增加,同时FNDC5蛋白表达降低,而沉默HTR-8/SVneo 细胞中 miR-137表达后,FNDC5蛋白表达量则升高,说明滋养层细胞的增殖和迁移活性受到 miR-137表达水平升高的抑制。另外同一课题组随后还证实上调人脐静脉内皮细胞(HUVECs)中miR-137表达,可以增强U937和 THP-1细胞对HUVECs的趋化性和黏附性,而高糖环境则可上调miR-137的表达,进而抑制这种黏附性,同时可抑制 HUVECs血管生成和血管活性[13]。最终,作者推断miR-137对高糖环境诱导的血管内皮功能障碍至关重要,可能参与了GDM的病理过程。在本研究中,我们分别检测了GDM诊断时血清miR-137表达水平和新鲜胎盘组织中miR-137水平,两者存在一定的相关性,且都较对照组孕妇样本中的表达量升高,说明GDM孕妇血清样本中升高的miR-137可能多数来自于胎盘组织细胞的分泌,但是这一点仍然需要进行更深入、更科学的基础实验结论支持。
高胆红素血症在新生儿中十分常见,主要表现为皮肤中大量胆红素沉积,这是红细胞破坏增加和胆红素排泄减少共同导致的结果[14]。胆红素通常是通过肝脏排泄到胆汁中。胆红素清除功能缺失导致这种黄色素在血液或皮肤中大量积累。新生儿高胆红素血症可导致脑部某些区域(特别是基底核)的胆红素积聚,从而对这些区域造成不可逆转的损害,表现为各种神经功能缺陷、癫痫、听力障碍和眼球运动[15-16]。因此,维持正常的胆红素清除率是预防新生儿高胆红素血症和相关神经毒性的关键过程,更好地了解胆红素清除率的机制至关重要。最近有研究证实胆红素解毒酶和转运蛋白的表达受到孤儿核受体(pregnane X receptor,PXR)和CAR的转录调控[17]。CAR是肝脏清除胆红素的关键调节因子,因为它调节与药物代谢、激素、能量和脂质平衡有关的基因的表达。但是CAR在新生小鼠和新生儿中的表达量极低,这在某些情况下可能产生明显的病理后果,例如新生儿高胆红素血症和相关的神经毒性。而Chen等[5]则发现,miR-137在调节 CAR表达方面起到关键作用,敲低新生小鼠和成年小鼠肝组织/细胞中 miR-137表达,可以增加胆红素清除率,这可能是因为miR-137表达的上调导致肝脏CAR表达水平降低,因此进而使新生儿胆红素的清除率降低,因此靶向 miR-137可能是一种提高肝脏组织CAR表达和加速胆红素清除的方法,以降低新生儿高胆红素血症发生风险。我们的研究结果与之相符。在本研究中,我们通过临床样本证实,在GDM组中,高胆红素血症亚组孕妇血清miR-137水平较非高胆红素血症亚组孕妇升高明显,而且孕妇血清miR-137表达水平与新生儿血清胆红素水平表现出显著的正相关性,说明GDM孕妇高糖环境导致miR-137水平升高,而母体血清中高水平miR-137可能通过某种机制进一步影响了新生儿出生后胆红素的清除率,增加了高胆红素血症的发生风险,但是这个结论尚需要扩大样本量进一步证实其可靠性。
综上所述,GDM孕妇血清miR-137表达水平明显上调,而且这也是新生儿高胆红素血症发生的独立危险因素,因此检测GDM孕妇血清miR-137有望成为预测新生儿高胆红素血症发生的有效措施。

