早期食管鳞状细胞癌患者循环血清外泌体circFNDC3B表达水平及其临床意义
白梅,余灏东,王于梅,唐尚军,孙华玲
(重庆市黔江中心医院 消化内科,重庆 黔江 409099)
食管癌是我国致死率最高的恶性肿瘤之一,其中以食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)最为常见[1]。近年来,随着精准医疗的发展,液体活检技术已经用于食管癌的临床筛查工作中。其中外泌体在肿瘤早期预警、诊断、预后评估中都表现出极大的潜力。事实上,众多研究在食管癌患者的循环血中已经发现了来源于肿瘤的外泌体,其中包含大量肿瘤相关的特异性分子,如mRNA、蛋白、脂质、非编码RNA等,使其具有强大的信号传递功能[2]。环状RNA(circRNA)是一类广泛存在于真核细胞胞浆中的非编码RNA,不同于其他非编码RNA,circRNA是以3′和5′端共价闭合的环状形式存在,因此具有更高的稳定性和保守性[3]。Ⅲ型纤维连接蛋白域蛋白3B(Fibronectin type III domain-containing protein 3B,FNDC3B)是一个新鉴定的原癌基因编码的蛋白,Luo等[4]证实FNDC3B环状RNA(circFNDC3B)可以激活多个癌变途径,促进食管癌细胞的生长和转移。目前关于circFNDC3B在早期食管癌中的表达意义尚缺乏研究。本研究旨在分析癌前病变和早期ESCC患者循环血浆外泌体中circFNDC3B水平的差异,从而为ESCC发病机制的研究及早期筛查工作提供新的生物学标志分子。
1 资料与方法
1.1 一般资料
2019年3月至2020年12月共收集了年龄40~72岁的74例早期ESCC患者、72例食管鳞状上皮内瘤变(esophageal Intraepithelial neoplasia,EIN)患者和75例健康志愿者的的血清样本,分别作为ESCC组、EIN组和正常组。所有患者均符合普通白光纤维内镜筛查标准,随后经内镜下卢戈染色联合异常区域靶向活检明确诊断为ESCC或EIN。其中低级别EIN 42例,高级别EIN 30例;ESCC组病例均为早期/表浅(TisN0M0期或T1N0M0期)食管浸润性癌。在收集血清样本之前,所有患者从未接受过任何抗肿瘤治疗,具有完整的临床资料。正常组健康志愿者从常规体格检查中招募,排除有重大疾病和长期用药的受试者。所有受试者都有规律的饮食习惯。排除合并有其他类型恶性肿瘤、自身免疫性疾病、感染性疾病、严重肝肾功能不全、高血压、糖尿病、妊娠或哺乳期人群。所有参与者均对本研究知情,并签署书面同意书。本研究经我院伦理委员会批准。
1.2 方法
1.2.1 资料收集 收集所有研究对象的临床资料,包括年龄、性别、体重指数、吸烟史、饮酒史、饮食习惯以及肿瘤大小、组织学分型、分化程度、TNM分期。其中吸烟定义为平均每天吸烟≥1支,连续或累积≥1年;饮酒定义为平均每周饮酒≥1次,连续或累积≥1年。
1.2.2 血清外泌体获取 每个实验对象在采血前禁食8~10 h,早晨餐前用非抗凝真空管(5 ml)采集血样。静置30 min后,以2 000 r·min-1的速率离心10 min。将上清液转移至-80 ℃储存,直至分析。使用InvitrogenTM总外泌体分离试剂(美国Invitrogen公司),取500 μl血清与外泌体分离试剂混合,混合物在10 000 r·min-1、4 ℃下一次离心30 min,15 000 r·min-1二次离心30 min,去除细胞碎片;120 000 r·min-1超速离心60 min,获得外泌体沉淀,洗涤后用60 μl PBS重悬,通过Tecnai G2 Spirit(美国FEI公司)透射电镜观察外泌体的形态和粒径分布。利用NanoSight NS300系统(英国Malvern公司)进行纳米颗粒跟踪分析,检测分离出的外泌体的浓度、大小分布和ζ电势。通过流式细胞术检测CD63和CD81外泌体标记膜蛋白。
1.2.3 提取外泌体circRNAs[5]使用Trizol试剂和蛋白分离试剂(美国Invitrogen公司)从外泌体中分离出circRNAs,其RNA纯度和浓度由紫外分光光度计测定。
1.2.4 CircRNAs微阵列分析[6]从ESCC组、高级别EIN组、低级别EIN组、正常组血清外泌体样本中随机选取4例血清样本,进行基因芯片分析。委托上海生物芯片有限公司基于Agilent circRNA表达谱芯片平台完成检测任务。简单地说,每个样本的总RNA被扩增,并使用非特异性引物合成荧光标记的cRNA。将标记的cRNA与Agilent circRNA阵列杂交。在清洗完载玻片后,数组被Agilent G2565CA扫描系统获取。然后将扫描图像导入到Agilent 特征提取v10.7系统中,用于网格对齐和数据提取。采用Edger软件包(R3.4.4)对数据进行规范化处理,并进行分析,确定不同分子间的差异表达。
1.2.5 外泌体circFNDC3B水平检测[4]采用实时荧光定量PCR法检测外泌体circFNDC3B水平。以500 ng RNA为模板,采用逆转录技术,以Prime Script RT Master Mix试剂盒(美国Takara公司)和随机引物进行cDNA合成。在Real-Time PCR系统(美国Thermo公司)中使用SYBR Select Master Mix试剂盒(美国Applied Biosystems公司)完成实时荧光定量PCR反应。用反向引物和发散引物分别对线性和环形RNA进行分析。采用GAPDH作为内部控制。circFNDC3B正向引物5′-CATCTCCATTCACCAAGTGGGG-3′,反向引物5′-AGCAGGTTATTCTCGTTCAAG-3′;GAPDH正向引物5′-GAGTCAACGGATTTGGTCGT-3′,反向引物5′-GACAAGCTTCCCGTTCTCAG-3′。反应条件:95 ℃反应15 min,1次循环;95 ℃反应30 s、55 ℃反应34 s,50次循环。
1.3 统计学处理
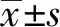
2 结 果
2.1 3组一般资料的比较
3组年龄、性别、体重指数、饮酒史、喜食辛辣食物及蔬菜水果等资料比较,差异均无统计学意义(P>0.05),具有可比性;而EIN组和ESCC组吸烟者、喜食腌制食物者比例高于正常组,差异有统计学意义(P<0.05)。见表1。
表1 3组一般资料的比较
2.2 循环血清外泌体获取及鉴定
经透射电镜观察,循环血清外泌体是一个双层膜状结构的微小囊泡,粒径大小为50~150 nm,符合外泌体的形态特征(图1A)。经NTA追踪技术分析,外泌体平均粒径为(89.50±5.33)nm(图1B)。经流式细胞术检测,外泌体标志蛋白CD63、CD81呈阳性表达,确定成功分离并纯化外泌体囊泡(图1C)。
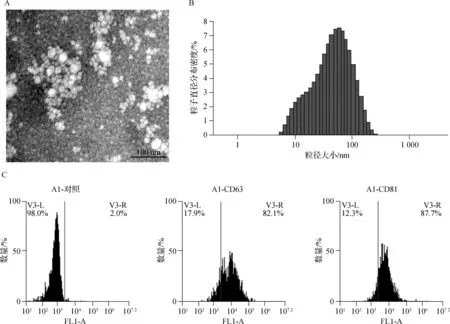
A.具有代表性的离体外泌体透射电镜照片;B.NTA追踪技术分析典型样品外泌体大小分布直方图;C.流式细胞术测定外泌体表面标志物(CD63和CD81的检出率均在80%以上)
2.3 血清外泌体差异性circRNAs筛选
ESCC组与正常组比较,有2 293个circRNA表达上调和15 707个circRNA表达下调。ESCC组与低级别EIN组血清外泌体circRNAs表达谱比较,有1 101个circRNA表达上调,8 384个circRNA表达下调。ESCC组与高级别EIN组比较,有258个circRNA表达上调和181个circRNA表达下调。其中有106个差异性circRNA表达谱重叠,在变化倍数≥3.0和P<0.05的标准下,我们选择了变化倍数较大的circFNDC3B作为目标物进行进一步研究。见图2。
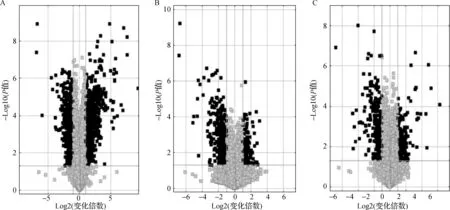
A.ESCC组vs正常组;B.ESCC组vs低级别EIN组;C ESCC组vs高级别EIN组
2.4 3组循环血清外泌体circFNDC3B表达水平比较
正常组、EIN组、ESCC组循环血清外泌体circFNDC3B表达水平分别为0.87(0.71,1.38)、1.43(0.91,2.19)、2.68(1.89,3.83),EIN组和ESCC组患者血清外泌体circFNDC3B表达水平均高于正常组,且ESCC组患者血清外泌体circFNDC3B表达水平高于EIN组,差异有统计学意义(P<0.05)。
2.5 单因素和多因素Logistic回归分析早期ESCC发生的影响因素
经单因素和多因素 Logistic 回归分析,年龄、性别、吸烟史、饮酒史、家族肿瘤史、喜辛辣食物、喜腌制食物、喜蔬菜水果、Charlson合并症指数与早期ESCC发生无关(P>0.05),而血清外泌体circFNDC3B表达水平升高是早期ESCC发生的独立危险因素(P<0.05)。见表4。
表4 单因素和多因素Logistic回归分析早期ESCC发生的影响因素
2.6 ROC曲线分析血清外泌体circFNDC3B水平对早期ESCC的诊断效能
血清外泌体circFNDC3B水平诊断早期ESCCROC曲线下面积为0.870(95%CI0.823~0.917),对应截断值为1.553,在该截断值下特异度为72.1%,敏感度为87.8%,见图3。
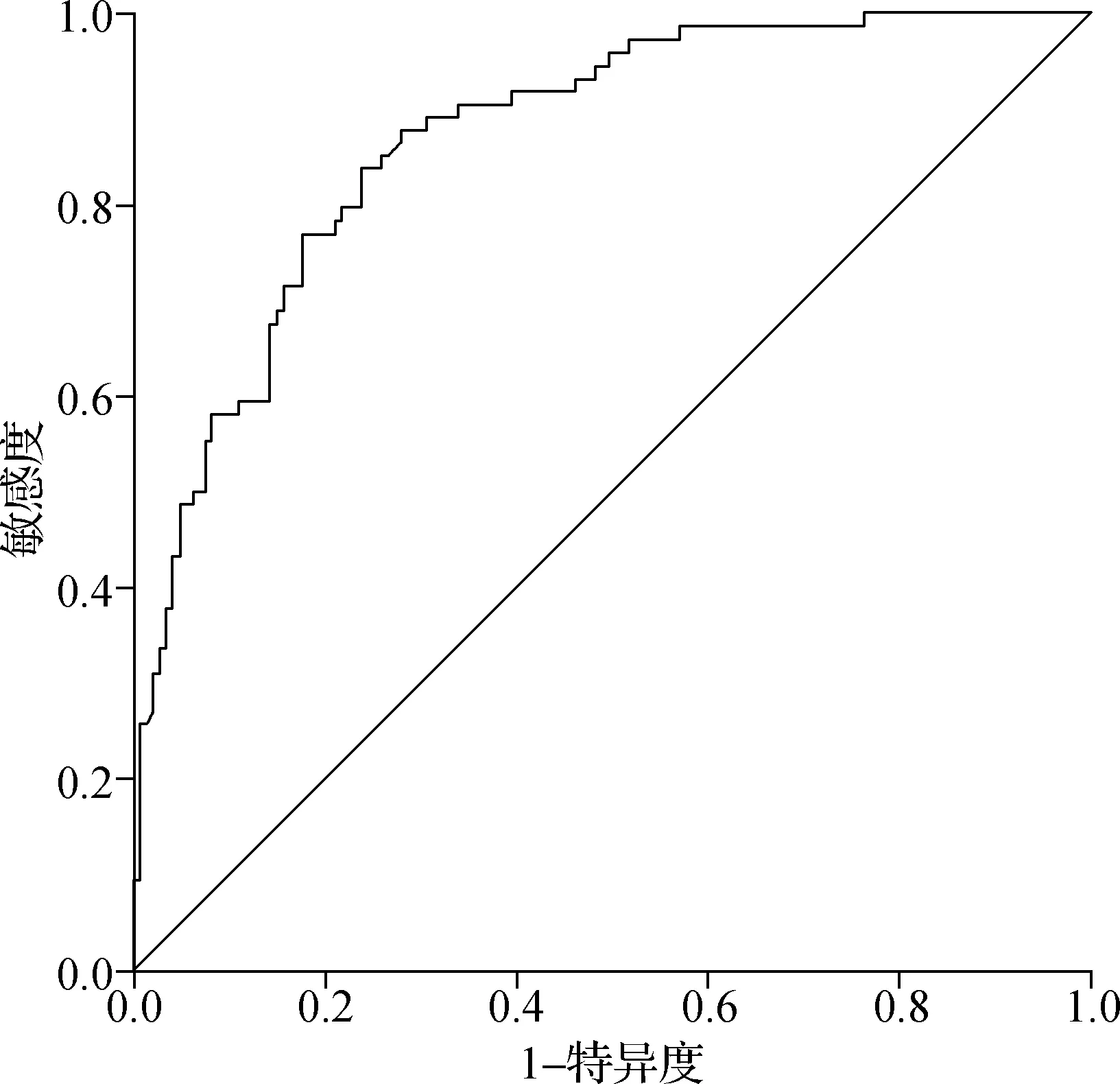
图3 血清外泌体circFNDC3B水平对早期ESCC诊断的ROC曲线
3 讨 论
对于ESCC的预防和控制在我国已成为一个日益重要的公共卫生挑战,因为其预后和5年存活率仍然不能令人满意[6]。到目前为止,虽然已经进行了大量蛋白组学和代谢组学研究,以确定差异生物标志物对于早期ESCC的诊断价值,但是得到的生物学信息有限。circRNAs在食管癌组织和细胞中的表达已经被一些先前的研究所证实,但是关于它们作为食管癌生物标志物的表达特异性和敏感性,以及它们的功能网络和机制的信息还远远不够。在本研究中,我们发现循环血清外泌体circFNDC3B对于早期ESCC具有良好的鉴别诊断能力,在常规体格检查中也更具临床实用性。
circRNA是一大组共价闭合的连续环,通常在人类细胞中表达,循环血清外泌体circRNA的引入,为新型生物标志物的发现提供了更多启示[7]。近年来circRNA功能分析的研究进展表明,circRNA可以通过与海绵状miRNAs相互作用以及调节RNA结合蛋白的活性,进而影响基因的表达来发挥其生物学作用[8]。此外它们还被证实可以调节基因转录,并被转化成功能蛋白质或多肽。这些结果表明,circRNAs可能主要作为基因转录和转录后修饰的调节因子,通过它们可能影响与各种生物过程相关的多个基因[9]。circRNAs在食管癌中异常表达,这将为诊断和治疗提供重要参考,可能用作新型食管癌生物标志物。最近circFNDC3B已被证明通过不同的机制参与了各种生物学过程[10-11]。circFNDC3B是由位于人类基因组第7个染色体上的FNDC3B基因产生的,与线性形式相比,circFNDC3B结构更稳定,且具有更长的半衰期[12]。CircFNDC3B长215个碱基,由FNDC3B基因的第2和第3外显子通过反向剪接编码和生成。已有较多研究发现circFNDC3B与癌症密切相关,例如,Garikipati等[13]证实,在缺血性心肌病患者或动物模型的心肌组织中,circFNDC3B表达均明显下调。而心脏内皮细胞过度表达circFNDC3B可增加血管内皮生长因子-A的表达,增强其血管生成活性,减少心肌细胞和内皮细胞凋亡,因此靶向circFNDC3B可能是心肌梗死后促进心功能和重塑的一个潜在策略。此外Hong等[14]发现circFNDC3B上调时通过circFNDC3B-IGF2BP3-CD44 mRNA三元复合物的形成和E-钙黏着蛋白在胃癌中的调节而促进胃癌细胞的迁移和侵袭。最近Luo等[4]发现通过基因沉默的方式抑制了Eca109和KYSEL150食管癌细胞的表达,结果证明circFNDC3B是ESCC细胞增殖、凋亡、迁移和侵袭的重要调节因子,这些都是与细胞恶性转化有关的重要细胞过程。这表明circRNAs作为一个群体,可能作为复杂信号网络的重要上游组成部分,负责启动和促进食管癌的发生过程。本研究中,早期ESCC患者和EIN组患者血清外泌体circFNDC3B表达水平较正常组升高,且ESCC患者升高更明显,说明circFNDC3B在食管鳞状上皮细胞癌变过程中,circFNDC3B扮演着关键角色,有望成为ESCC早期诊断的生物标志物,这为早期EC的准确诊断和精准医疗提供了一定基础。
外泌体与circRNA紧密相连,是近年来的一个研究热点。外泌体是可以从大多数细胞类型产生的纳米级膜囊泡[15]。细胞间信息传递对于微环境中的肿瘤进展至关重要,这是外泌体的主要功能[16]。研究表明,许多循环circRNA是被动地从凋亡和坏死细胞释放,且易被RNA酶降解,这可能不能真正反映肿瘤细胞的生物学变化[17]。而外泌体中的circRNA不仅含量丰富且结构稳定,在外泌体被周围细胞吸收后可以继续发挥作用,这为外泌体circRNA在食管癌中具有作为生物标志物的潜在能力提供了基础[18]。在本研究中,我们分析了ESCC组、EIN组、正常组循环外泌体circRNAs微阵列,证实circFNDC3B在各组之间均存在差异性表达。进一步通过实时荧光定量PCR法检测,提示循环血清外泌体circFNDC3B高表达水平与ESCC上皮组织癌变有关,是发生ESCC的独立危险因素。经ROC曲线分析显示,血清外泌体circFNDC3B水平对早期ESCC具有一定的诊断效能。
综上所述,本研究鉴定了血清外泌体circFNDC3B可用于ESCC的早期诊断,为ESCC的筛查工作和精准医疗提供了一定的参考信息。但本研究仍处于初步探索阶段,未来需要一个更大更多样化的群体来进一步验证新发现的生物标志物的特异性和敏感性。本研究的策略也适用于其他临床应用。

