与NLRP3炎性小体通路相关感音神经性聋的研究现状*
翟思佳 尹时华
核苷酸结合寡聚结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)作为模式识别受体,可识别各种危险信号,帮助炎症小体组装,促使半胱氨酸天冬氨酸蛋白酸1(caspase-1)前体成熟并释放白介素-1β(IL-1β)、白介素-18(IL-18),间接促进肿瘤坏死因子(tumor necrosis factor α,TNF-α)等炎症因子上调。越来越多的研究证实NLRP3炎性小体与多种感音神经性聋的发生发展密切相关。最早有报道指出NLRP3 炎性小体与一些家族性遗传性疾病的发病有关,如:家族性地中海发热和Muckle-Wells 综合征[由NLRP3突变而引起在螺旋神经节(spiral ganglion,SGN)高表达]等,后来又发现与老年性聋、巨细胞病毒(CMV)感染诱发感音神经性听力损失有关。本文对感音神经性聋疾病中有关NLRP3的研究进行综述,对已开发的分子靶向治疗药物进行分类介绍,为未来开展相关研究提供参考。
1 NLRP3炎性小体及相关通路
NLRP3炎性小体是一种细胞内先天免疫传感器,主要在粒细胞、单核/巨噬细胞、小胶质细胞、Kupffer 细胞、树突状细胞、B 细胞和T 细胞等免疫细胞以及肝细胞、上皮细胞和角细胞等非免疫细胞中表达[1~3],其主要分布在口咽、食管、宫颈和阴道粘膜的非角质化上皮,膀胱和输尿管的上皮细胞也能表达NLRP3 炎性小体[4]。NLRP3蛋白作为炎症小体传感器分子模式识别受体,包含一个吡啶结构域(PYD),一个核苷酸结合位点(NACHT)以及一个富含亮氨酸的重复序列(LRR)[5]。
当NLRP3炎性小体被激活时,一方面上游的传感器分子模式识别受体NLRP3通过PYD域与凋亡相关斑点样蛋白(ASC)相互作用,另一方面ASC通过CARD域介导效应蛋白caspase-1前体的募集,最终形成NLRP3炎性小体复合物,该复合物可启动caspase-1的自我切割和活化caspase-1的形成。活性caspase-1可以加工前体IL-1β成为成熟IL-1β,因而NLRP3炎性小体的激活导致炎性细胞因子IL-1β的分泌[1,6,7]。NLRP3编码的蛋白质对于关键炎性细胞因子IL-1β的分泌、免疫反应、炎症反应和细胞凋亡均非常重要。NLRP3炎性小体的激活受到严格调控,其激活需要至少两个信号[8],第一信号包括Toll样受体配体,例如:细菌脂多糖(LPS)[2];第二信号可以是液晶分子、成孔毒素、三磷酸腺苷(ATP)或细胞外钙等[9,10]。随着研究的深入,不断有文献报道多种内外因素均可使NLRP3 炎性小体组装活化,比如通过促进钾离子外流和诱导线粒体产生大量活性氧(ROS),可使NLRP3 炎性小体活化,激活caspase-1,使IL-1β成熟并分泌。成熟的IL-1β与靶细胞的IL-1β 受体结合后,激活下游信号转导因子,如:核转录因子NF-κB 等,生成大量炎症介质,进一步加重其诱导的炎症反应[11]。
2 NLRP3炎性小体在感音神经性聋发生发展过程中的相关作用机制
NLRP3炎性体可在内耳中激活,耳蜗中的一些巨噬细胞和/或单核细胞样细胞可能与先天免疫应答和听力下降有关,这在小鼠模型中也进行了验证;巨噬细胞样细胞散布在所有耳蜗组织中,包括听觉神经、螺旋神经节、基底膜、血管纹和螺旋韧带[12],巨噬细胞可能通过影响血管纹的功能而影响听力[13],其中螺旋神经节细胞更是联系耳蜗与听觉中枢的枢纽。由于NLRP3基因在小鼠整个内耳的免疫细胞(巨噬细胞/单核细胞)中表达,当受到危险信号的刺激时(如LPS和ATP),耳蜗可以通过激活NLRP3炎症小体、分泌更高水平的IL-1β来介导自身局部炎症,从而引发听力下降。所以NLRP3炎症小体的激活可能影响耳蜗和听觉功能,导致内耳、听神经或中枢神经系统的听觉通路功能障碍,造成感音神经性聋的发生。结合NLRP3炎症小体的相关通路,推测感音神经性聋发生发展过程中NLRP3炎性小体通路的可能作用机制如图1所示。
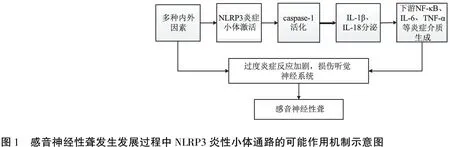
感音神经性聋的发生过程与年龄、暴露于耳毒性药物、噪声、核或线粒体基因突变等因素相关,如NLRP3基因突变可导致感音神经性听力损失[14]。免疫染色显示NLRP3在小鼠耳蜗螺旋神经节神经元中强烈表达,其在螺旋神经节神经元中可能具有特定功能,并且可能与综合征及非综合征型感音神经性聋相关[15]。
2.1NLRP3与CMV感染诱发感音神经性听力损失(SNHL) 先天性巨细胞病毒(congenital cytomegalovirus,CMV)感染是儿童感音神经性听力损失最常见的感染原因,同时也是感音神经性听力损失的重要原因,在CMV小鼠巨细胞病毒(murine congenital cytomegalovirus,MCMV)感染后听力损失小鼠模型的发病机理和炎症反应作用的机制研究中,发现CMV依次诱导耳蜗炎症小体相关因子caspase-1、下游炎性因子IL-1β和IL-18激活增加,并可能进一步上调IL-6和TNF-α的表达,这些炎性因子具有神经毒性,可能会导致听力受损[16]。在耳蜗螺旋神经节神经元中的炎性小体相关因子增加,并且MCMV增加了活性氧(ROS)的含量,说明NLRP3炎性小体通路作为一种新型的固有免疫机制,可能会导致听力障碍[17]。
2.2NLRP3与老年性聋 老年性聋是一种与年龄相关的双侧对称性感音神经性听力损失(不包括任何其他原因)[18],主要与周围和中枢听觉系统的感觉或转导神经细胞变性有关。既往研究发现衰老的耳蜗中ROS的产生增加并有炎症反应[19],而免疫细胞中ROS积累可能是NLRP3炎症小体激活的原因[20]。最新研究发现,与年轻小鼠相比,衰老小鼠内耳中激活的NLRP3、caspase-1、IL-1β和IL-18的水平显著增加,此外,NLRP3作为ROS的传感蛋白,其相关炎症小体的激活还会导致耳蜗炎症反应[21]。总而言之,衰老小鼠耳蜗中NLRP3炎性小体激活引发的炎症似乎在年龄相关性听力损失(age related hearing loss,ARHL)的病理过程中起着重要作用,这可能是老年性聋的潜在原因。
2.3NLRP3突变导致冷炎素相关周期热综合征(CAPS) 当1号染色体上编码NLRP3 的Cias1 基因发生突变时,突变患者的免疫细胞中NLRP3不能自我抑制,只需要初始启动信号,无需第二个激活信号,始终处于激活状态[23],通过组装活化NLRP3 炎性小体,持续地将pro-IL-1β 和pro-IL-18 剪切为成熟的IL-1β 和IL-18,诱导IL-1β大量分泌,引起机体过度的炎症反应[5]。这种NLRP3炎性小体的功能获得性突变会导致一系列常染色体显性遗传的系统性自身炎症性疾病,被称为冷炎素相关周期热综合征,是一种罕见的单基因自身炎症性疾病;包括3种临床亚型: 新生儿多系统炎性疾病或慢性婴儿神经皮肤关节综合征(NOMID/CINCA)、Muckle-Wells综合征(MWS)、家族性寒冷性自身炎症综合征(FCAS);其共有的临床特征是反复发作的多系统炎症,主要表现为发热、关节痛及荨麻疹,可累及皮肤、肌肉、骨骼、关节、眼、耳以及中枢神经系统。所有CAPS亚型均包括全身炎症的血清学证据。
听力损失是CAPS的最常见表现之一[23],据Ahmadi等[24]报道在诊断为CAPS的57例患者中,NOMID、NOMID / MWS、MWS和FCAS受试者的听力损失患病率分别为76%、86%、33%和25%。可见听力损失是NOMID和MWS的特征,但在FCAS中较少[24,25],通常高频听力损失更严重,且随着年龄的增长加重,其中感音神经性聋占绝大多数。
对NOMID或MWS患者的听力学和放射学研究表明,NLRP3突变通过影响耳蜗功能而导致听力下降。MRI造影检测到耳蜗病理性信号增强,并伴有液体衰减反转恢复(MRI-FLAIR)[24],说明耳蜗有炎症反应,其血流量、血管通透性均增加[26]。在此疾病中,耳蜗可能是系统性自发炎症的外围次要靶标,但也可能疾病本身就是起源于内耳局部的自发性炎症,耳蜗中巨噬细胞和/或单核细胞的自身免疫炎症也在slc26a4基因缺陷所致耳聋小鼠模型中得到验证[13,27,28]。
2.4NLRP3突变导致非典型CAPS和非综合征型听力损失 部分综合征型聋除表现为听力下降外,还伴有其他表型,MWS等表型的伴随症状通常较轻,且无明显特异性,常被忽视而误诊为非综合征型聋,如:已经报道的携带NLRP3的p.Arg918Gln功能突变的LMG446家族,即为非典型CAPS表型,患者有进行性双侧感音神经性听力减退和全身自发性炎症的症状和体征,但没有血清学的炎症迹象,不满足NOMID、MWS或FCAS的诊断标准。MRI-FLAIR造影显示治疗前所有受试者耳蜗的信号异常增加[29],说明耳蜗发生了炎症反应。
而另一携带相同p.Arg918Gln突变的LMG113家族,其听力损失是双侧对称进行性的,由于没有任何其他CAPS靶器官表现,因而诊断为常染色体显性遗传非综合征型听力损失,颞骨MRI-FLAIR检查后发现,耳蜗的病理性信号增强与在NOMID或MWS感音神经性听力损失患者中观察到的相似,但不严重[29],可以作为耳蜗炎症反应的放射学证据,表明该家族患有NLRP3炎性小体相关的感音神经性听力损失。
3 针对NLRP3炎性小体通路的分子靶向治疗药物
多种内外因素引发NLRP3炎性小体的活化、IL-1β产生增加造成感音神经性听力损失[5,22,30~32],IL-1β通过与I型IL-1受体及IL-1受体辅助蛋白的结合来完成信号转导。由于IL-1β在整个NLRP3炎症小体通路中发挥关键效应作用,目前已批准了三种能阻滞IL-1β作用的治疗药物:anakinra(重组IL-1受体拮抗剂),rilonacept(IL-1受体阻滞剂)和canakinumab(抗IL-1β单克隆抗体)。这些IL-1受体拮抗剂目前已用于治疗CAPS患者的感音神经性听力损失,结果显示用药后其临床症状、体征、炎性标志物水平以及生活质量均获得了显著改善[23,33,34]。
有关IL-1受体拮抗剂成功治疗NLRP3炎症小体介导的感音神经性听力损失的临床报道显示,对26例NOMID患者用anakinra治疗60个月后,大多数患者的感音神经性聋得以稳定,30%患者的听力改善,通过MRI-FLAIR观察到耳蜗异常信号增强的患者异常信号均减弱[35]。而anakinra治疗后听力不完全改善可能反映了先前慢性炎症已引起了耳蜗不可逆的损害,因此在感音神经性听力损失发生后,迅速开展针对NLRP3介导自体炎症的治疗,对逆转其耳蜗损害至关重要[23,26,34]。Marchica等[36]的病例报道显示,一例MWS患儿抗IL治疗后其单侧感音神经性听力损失达到了听力学痊愈。作为非典型CASP,LMG446家族接受了5个月的皮下注射anakinra治疗,纯音测听阈值恢复到正常范围内[29]。这些结果表明,由NLRP3炎性小体激活引起的耳蜗炎症反应所导致的感音性听力损失可通过IL-1β阻断疗法所逆转或改善,并且听力损失恢复程度与年龄相关,年龄较小听力损失更明显[37]。
NLRP3信号通路机制可能是NLRP3炎症小体相关感音神经性听力损失的基础,针对此信号通路的相关靶点开展阻断疗法可能会对这些疾病十分有效。
4 小结与展望
NLRP3 炎性小体是目前比较热门的研究领域,随着研究的深入,大家对它的认识愈发全面。在不同类型耳聋疾病小鼠模型中,NLRP3在耳蜗螺旋神经节等部位激活,依序激活caspase1、IL-1β等相关炎症因子,引起多种感音神经性聋疾病。NLRP3炎性小体可能在多种听力疾病中影响耳蜗和听觉功能,但其具体机制仍未明确,比如不同的内外激动因素是否有最终的共同通路能够使其活化?NLRP3 炎性小体与其它炎性小体是否有着复杂的相互作用?因此,关于NLRP3 炎症小体信号通路的相关靶点作为治疗听觉疾病分子靶向治疗药物开发的突破点有待进一步更广泛的研究。

