兰紫解毒糖浆联合磷酸奥司他韦治疗小儿甲型H1N1流感的疗效及免疫稳态影响
孙树雅,郭翠芳,寇学冬,李永春,史霄雯
(沧州中西医结合医院儿科,河北 沧州 061000)
甲型H1N1流感病毒是A型流感病毒,属于正粘病毒科甲型流感病毒属,具有亚洲猪流感和非洲猪流感病毒特征,是禽流感、猪流感和人流感三种流感病毒基因重组后产生的新毒株[1]。甲型H1N1流感与普通流感相似,具有一定的传染性,人群普遍易感,尤其是抵抗力较差的儿童,主要症状表现为发热、咽痛、流涕、鼻塞等,部分患者病情进展较迅速,若无有效治疗易继发严重肺炎、肺出血、肾功能衰竭甚至死亡,病死率约为6.77%[2]。目前尚没有针对儿童甲型H1N1流感病毒的特异性药物,治疗手段主要是进行解热镇痛、防治继发性细菌感染等对症治疗。磷酸奥司他韦是一种神经氨酸酶抑制剂,适用于成人和1岁及1岁以上儿童的流感治疗,具有良好的抗病毒效果,是美国疾病预防控制中心推荐用药,但对于发病时间超过48 h的患者,效果并不明显[3]。甲型H1N1流感在中医中属于“疫病”范畴,是新发温病,主要与感受疫邪深浅及本身正气盛虚有关,邪遏肺卫而发病,临床治疗根据小儿生理、病理特点,严格遵循辩证施治原则,通过清热解毒、宣肺透邪、化湿和中等措施进行治疗,达到增强患儿免疫力,改善相关症状的目的[4]。兰紫解毒糖浆配方来源于《中药大全》中的抗毒汤,主要由板蓝根、大青叶、紫草、山豆根、茵陈、金银花等中药材组成,具有清热解毒的功效,适用于急性上呼吸道感染、病毒性肺炎等疾病[5]。本研究采用兰紫解毒糖浆联合磷酸奥司他韦治疗小儿甲型H1N1流感,探究其临床效果,现报道如下。
1 资料与方法
1.1 一般资料以2018年12月-2019年12月沧州中西医结合医院儿科收治的120例甲型H1N1流感患儿为研究对象,随机分为对照组与研究组,每组60例。两组患儿一般资料比较无差异(P>0.05),具有可比性,见表1。本研究经沧州中西医结合医院伦理委员会批准同意(编号:2018036),患儿家属均签署知情同意书。

表1 两组患儿一般资料比较
1.2 诊断标准西医诊断标准参照《儿童流感诊断与治疗专家共识(2015年版)》[6]:具有发热、咽痛、流涕、咳嗽等临床表现;外周血象检查显示白细胞总数正常或降低,血生化检查显示天门冬氨酸氨基转移酶、丙氨酸氨基转移酶等指标升高;病毒核酸检测呈阳性,呼吸道标本中可分离出甲型H1N1流感病毒,血清抗体检查显示甲型H1N1流感病毒特异性抗体水平呈4倍或4倍以上升高;X线胸片检查表现肺内片状影。中医诊断标准参照《温病学》[7]风温的诊断标准:主症:发热、鼻塞、咳嗽、肌肉酸痛、体倦乏力;次症:舌质红,苔黄或腻,脉滑数。
1.3 纳入与排除标准纳入标准:符合《儿童流感诊断与治疗专家共识(2015年版)》[6]和《温病学》[7]中相关诊断标准;患儿年龄3~14岁,发病时间≤48 h;入组前未经过相关药物治疗;无本研究药物相关过敏反应;患儿家长均同意参与本研究。排除标准:诊断为由其他病原菌引起的呼吸道感染;合并严重心肝肾等器官功能障碍;合并小儿肺炎、肺结核、毛细支气管炎等其他肺部疾病;入组前接受过相关药物治疗;合并胃肠道疾病。
1.4 治疗方法入院后两组患儿均给予退热、基础补液、纠正水电解质平衡等常规基础治疗。对照组患儿口服磷酸奥司他韦颗粒(宜昌东阳光长江药业股份有限公司,国药准字H20093721,规格:25 mg)治疗,给药剂量:患儿体质量≤15 kg,30 mg/d;16~23 kg,45 mg/d;24~40 kg,60 mg/d;>40 kg,75 mg/d,均分为2次口服。研究组患儿在对照组基础上给予兰紫解毒糖浆治疗,药物组成为板蓝根、大青叶、紫草各150 g,山豆根、茵陈各90 g,金银花20 g,清洗干净后加8倍量的水浸泡,煎煮过滤两次,浓缩至适量,加蔗糖450 g,搅拌溶解后加热煮沸30 min,加苯甲酸钠2 g,加纯净水至1 000 mL,混匀分装即可,于饭后口服,5~30 mL/次,3次/d,两组患儿均连续用药5 d。
1.5 观察指标
1.5.1 相关症状缓解情况统计两组患儿治疗后症状(扁桃体红肿、咳嗽、鼻塞)改善时间、体温恢复正常时间、病毒核酸转阴时间、住院时间,病毒核酸检测方法:采集鼻咽拭子,采用荧光定量PCR仪检测甲型H1N1流感病毒核酸。
1.5.2 中医症候积分[8-9]主症包括发热(0~3分)、鼻塞(0~3分)、咳嗽(0~3分)、肌肉酸痛(0~3分)、体倦乏力(0~3分);次症包括舌质红(0~3分)、苔黄或腻(0~3分)、脉滑数(0~3分),其中0分表示正常,1分表示轻度,2分表示中度,3分表示重度。
1.5.3 免疫相关指标分别于治疗前后采集患儿外周静脉血2 mL,收集细胞5×106个/mL,1 000 r/min离心5 min,弃去培养液,3 mL PBS洗涤1次,离心去PBS,加入预冷的70%乙醇固定1 h,离心弃去固定液,3 mL PBS重悬5 min,400目筛网过滤1次,1 000 r/min离心5 min,弃去PBS,用1 mL PI染液染色,4℃避光30 min,24 h内使用FACSCalibur流式细胞仪(美国Becton Dickinson公司)检测CD3+、CD4+、CD8+、CD4+/CD8+T淋巴细胞比例,采用WinMD 2.9软件对所得数据进行分析。
1.5.4 血清炎症细胞因子水平分别于治疗前后采集患儿空腹静脉血2 mL,1 000 r/min离心10 min,取上层血清,采用ELISA法[10]按照试剂盒说明书操作测定肿瘤坏死因子-α(tumor necrosis factor-α,TNFα)、白细胞介素-6(interleukin-6,IL-6)水平。
1.5.5 不良反应发生情况统计两组患儿治疗期间及治疗后发生恶心呕吐、腹泻、皮疹等不良反应率。
1.6 统计学方法采用SPSS 26.0统计学软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,两组治疗前后比较采用配对样本t检验;计数资料以例(%)表示,两组间比较采用χ2及Fisher确切概率法检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿相关症状的缓解情况的比较与对照组比较,研究组症状改善时间、体温恢复正常时间、病毒核酸转阴时间及住院时间均缩短,差异有统计学意义(P<0.05),见表2。
表2 两组患儿相关症状的缓解情况的比较(±s,d)

表2 两组患儿相关症状的缓解情况的比较(±s,d)
注:与对照组比较,*P<0.05。
组别研究组对照组t值P值例数60 60症状改善时间4.36±0.59*5.17±0.61 7.393<0.001体温恢复正常时间1.86±0.23*2.74±0.31 17.659<0.001病毒核酸转阴时间3.15±0.41*4.08±0.42 12.273<0.001住院时间4.35±0.46*5.14±0.53 8.720<0.001
2.2 两组患儿中医症候积分的比较治疗前两组中医症候积分比较差异无统计学意义(P>0.05);与对照组治疗后比较,研究组治疗后中医症候积分降低,差异有统计学意义(P<0.05),见表3。
表3 两组患儿中医症候积分的比较(±s,分)

表3 两组患儿中医症候积分的比较(±s,分)
注:与本组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05。
组别研究组对照组t值P值例数60 60治疗前18.63±2.15 18.59±2.09 0.103 0.918治疗后2.51±0.28*3.16±0.34*#11.431<0.001
2.3 两组患儿免疫相关指标的比较治疗前两组CD3+、CD4+、CD8+、CD4+/CD8+比较差异无统计学意义(P>0.05);与对照组治疗后比较,研究组CD3+、CD4+、CD8+升高,差异有统计学意义(P<0.05);治疗后两组CD4+/CD8+比较均无差异(P>0.05),见表4。
表4 两组患儿免疫指标的比较(±s,%)

表4 两组患儿免疫指标的比较(±s,%)
组别研究组对照组t值P值例数60 60 CD3+治疗前55.68±6.34 56.12±5.85 0.395 0.693治疗后72.96±7.38*61.68±6.41 8.938<0.001 CD4+治疗前22.18±2.43 22.42±2.35 0.550 0.583治疗后38.41±4.16*31.58±3.47 9.766<0.001
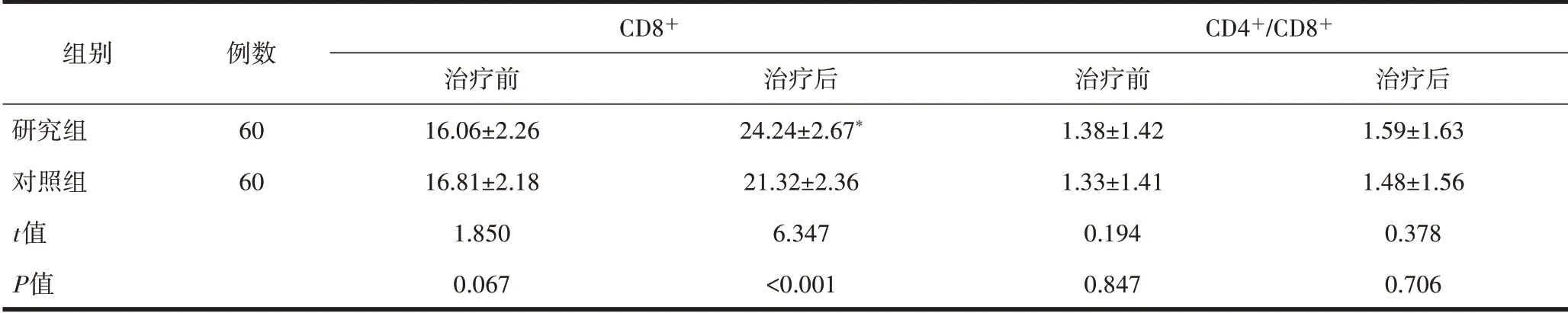
续表
2.4 两组患儿血清炎症细胞因子水平的比较治疗前两组TNF-α、IL-6水平比较均差异无统计学意义(P>0.05);与对照组治疗后比较,研究组TNF-α、IL-6水平降低,差异有统计学意义(P<0.05),见表5。
表5 两组患儿血清炎症细胞因子水平的比较(±s,ng/L)

表5 两组患儿血清炎症细胞因子水平的比较(±s,ng/L)
注:与对照组比较,*P<0.05。
组别研究组对照组t值P值例数60 60 TNF-α治疗前251.23±20.15 249.69±18.67 0.434 0.665治疗后89.96±8.45*125.43±12.58 18.130<0.001 IL-6治疗前162.35±15.47 161.43±14.64 0.335 0.739治疗后51.23±5.26*81.25±5.67 30.066<0.001
2.5 两组患儿不良反应发生情况的比较研究组出现恶心呕吐2例,腹泻2例,皮疹1例,总不良率为8.33%(5/60);对照组出现心呕吐1例,腹泻2例,总不良率为5.00%(3/60),两组不良反应发生率比较差异无统计学意义(χ2=0.134,P=0.714)。
3 讨论
甲型H1N1流感病毒通过飞沫传播进入人体后,与呼吸道的黏膜上皮细胞结合,进入细胞内,释放病毒RNA合成病毒蛋白,导致宿主细胞凋亡,引起免疫应答反应,激活机体保护机制释放出多种趋化因子和炎症因子,使机体产生一系列症状[11]。磷酸奥司他韦是临床常用的抗流感病毒药物,进入人体后其活性代谢产物奥司他韦羧酸能够与流感病毒神经氨基酸酶活性位点相结合,选择性较高,可干扰病毒在宿主细胞内的释放,进而阻止病毒扩散,达到抗病毒效果[12-13]。
中医将流感归于“疫毒”范畴,戾气病邪多从口鼻侵入人体,其病机为热毒袭肺致肺失宣肃,升降失常,出现高热、咽痛、咳嗽、气喘等症,宜采用表里双解,以辛凉清解、宣肺透邪为法,因势利导,尽快驱邪外出[14]。中医通过辩证施治给药,兼顾标本,药源及抗病毒谱广泛,在选配药方上采用多靶向治疗,且不良反应少,不易产生耐药,现已成为临床研究热点。兰紫解毒糖浆具有抗病毒、解热、抗炎、镇痛、止咳、增强免疫力的功效,对病毒感染性疾病具有良好效果[15]。牟淑娟等[16]研究发现兰紫解毒糖桨与利巴韦林联合治疗小儿手足口病具有良好治疗效果,可改善患儿免疫力,加快患儿康复时间,弥补了单一药物治疗的局限性。罗豫川等[17]报道,奥司他韦胶囊与金叶败毒颗粒联合治疗甲型H1N1流感总有效率高达97%,总不良反应发生率为24%,且不会对患者肝肾功能产生影响。李永春等[18]研究发现紫解毒糖浆联合磷酸奥司他韦治疗甲型H1N1流感具有较好的临床疗效,其机理与调节血清TGF-β1,γ-GT表达有关。本研究表明兰紫解毒糖浆联合磷酸奥司他韦治疗小儿甲型H1N1流感效果优于单独用药,可显著提升治疗效果。兰紫解毒糖浆方中的板蓝根、大青叶味苦性寒,具有清热解毒、利咽止痛、凉血消斑的功效,能抑制和杀灭多种病原微生物,对血小板聚集也具有一定抑制作用,且毒性极小,为君药;山豆根具有清热解毒、消肿利咽之功效,适用于火毒蕴结、咽喉肿痛、口舌生疮等症,为臣药;紫草具有补中益气、活血凉血、解毒化瘀功效,兼有透疹化斑作用,适用于血热毒盛,麻疹、斑疹透发不畅等症,为佐药;茵陈具有散热发表功用,可预防流感;金银花主治温病发热、热毒血痢,对多种细菌及上呼吸道感染致病病毒具有良好抑制能力,清热解毒,抗炎消肿,还能增强免疫力,为使药,诸药合用使药理作用得以加强,共奏清热解毒之效,发挥抗菌抗病毒,调节机体免疫功能的作用[19]。
综上所述,兰紫解毒糖浆联合磷酸奥司他韦治疗小儿甲型H1N1流感疗效确切,能缩短患儿病程,减轻患儿症状,增强患儿免疫力,值得临床推广。

