理冲汤干预卵巢癌肿瘤微环境的机制研究
王冬梅,庞 瑞
(新疆医科大学附属肿瘤医院中西医结合科,乌鲁木齐 830011)
卵巢癌是妇科最常见的恶性肿瘤之一,其死亡率在妇科恶性肿瘤中居首位[1]。虽然新的辅助化疗已在临床得到应用,但并没有扭转临床结局。随着研究的不断深入,肿瘤免疫治疗在恶性肿瘤的治疗中具有良好的应用前景。然而,只有少数抑制剂对卵巢癌有效,其中一个主要原因是卵巢癌本身诱导的免疫抑制微环境[2]。近年来,肿瘤的发生发展与肿瘤微环境(tumor microenvironment,TME)的密切关系已被越来越多的学者所认识和证实。肿瘤血管生成与微环境中的血管内皮生长因子密切相关。实体肿瘤的发生发展过程伴随细胞外基质的过量沉积,基质金属蛋白酶(matrix metalloproteinases,MMPs)则与细胞外基质相关。MMPs降解胞外基质同时释放或活化大量与胞外基质结合的细胞因子和趋化因子,在另一个层面影响了炎症细胞向肿瘤的浸润[3]。在卵巢癌肿瘤微环境复杂的免疫网络中,调节性T细胞(Tregs)是关键的免疫抑制因子。
给予晚期卵巢癌患者理冲汤加减联合化疗治疗可改善其临床症状,其中血流变指标和高凝状态改善最为明显,改善免疫功能,并且可以延长患者的生存期[4]。扶正培本方药在调节肿瘤微环境免疫系统及促血管正常化的有显著作用[5]。
因此,本研究探讨理冲汤含药血清对小鼠卵巢上皮癌ID8细胞抑制增殖和促进凋亡的作用,并观察理冲汤含药血清对于脐静脉内皮细胞(human umbilical vein endothelial cell,HUVECs)血管成形过程的作用,现报道如下。
1 材料与方法
1.1 细胞株与实验动物小鼠卵巢上皮癌细胞株(ID-8)和脐静脉内皮细胞株(HUVECs)均购自上海中桥新舟生物科技有限公司。40只2月龄SPF级BALB/C小鼠20只,雌性,体质量(20±2)g,购自新疆医科大学实验动物中心[实验动物生产许可证号:SCXK(新疆)2014-0004SYXK]
1.2 药品理冲汤(黄芪30 g、党参15 g、白术12 g、山药30 g、天花粉12 g、知母12 g、三棱9 g、莪术9 g、鸡内金10 g)均由新疆医科大学附属肿瘤医院中药房提供,中药经本院陈新萍主任药师鉴定符合2015年版《中国药典》规定。每味中药均来自同一批次。由我院中药房一次性按常规方法煎煮,根据等效剂量系数折算法得出小鼠的灌胃剂量[6],将中药水煎剂用水浴浓缩为含生药5.2 g/mL,4℃保存备用。
1.3 试剂1640培养基(美国HyClone公司),澳洲胎牛血清(美国Gibco公司),胰蛋白酶(美国Gibco公司),双抗(美国Gibco公司),matrige胶(美国BD公司);细胞增殖试剂盒(MTT,北京Solarbio公司);CD4+CD25+regulatory T cell isolation Kit(德国Miltenyi公司);淋巴细胞提起试剂盒(天津灏洋生物制品科技有限公司);抗VEGF单克隆抗体(美国Abcam公司);凋亡试剂盒(美国BD公司,批号);免疫荧光抗体VEGF(美国Abcam公司)、MMP-2和MMP-9(美国Revolution公司)。
1.4 仪器CO2恒温培养箱(日本SANYO);离心机(日本SONY公司);酶标仪(美国Thermo公司);流式细胞仪DXflex(美国Beckman Coulter公司)。
1.5 方法
1.5.1 ID8细胞与HUVECs细胞株的复苏、培养及传代将液氮中冻存的细胞取出后于37℃水浴锅中迅速化开,PBS洗两遍,完全培养基重悬细胞,于含5%CO2的37℃培养箱中培养。待细胞生长汇合度为80%左右时,用胰酶将细胞消化下来,分装于2~3个培养瓶中,加入培养基继续传代培养。
1.5.2 理冲汤含药血清制备和浓度筛选灌胃药物及剂量:理冲汤等效剂量换算[6]:按照小鼠等效剂量=人临床常用量(g/kg)×15,以70 kg成人体重计算,予7.62 mL/(kg·d)理冲汤药液灌胃。灌胃:将20只体重为18~20 g,雌性、约2月龄的BALA/C小鼠,按照体重随机分为两组(每组10只),理冲汤含药血清组按2 mL/100 g/次灌胃,每天2次;空白组灌服等量清水。取血:灌胃饲养3 d后,撤去鼠饲料,停止进食12 h后灌胃1次,于2 h后灌胃第2次;第2次灌胃后1 h,刺破眼眶静脉丛进行静脉采血,注入2 mL离心管,3 000 r/15 min离心,取血清。为了减轻小鼠的个体差异,同组动物血清合并。血清灭活及保存:用0.22 μm的滤膜过滤血清,56℃水浴灭活血清并分装冻存于-80℃冰箱。将含药血清以5%、10%、20%、40%、80%、100%的浓度与完全培养基进行配置,用3-(4,5-二甲基噻唑-2)-2,5二苯基四氮唑溴盐(MTT)法检测其对ID8细胞的抑制率,测算IC50后,选择1/2的IC50即25%的含药血清浓度作为后续实验剂量。
(1)由表中极差值的大小可以看出,激励信号频率的极差最大而热处理的极差最小;由此可知激励信号频率对检测的影响程度最大,油样的初始制冷温度对检测的影响程度较小。其他两种因素对检测的影响程度基本相近。
1.5.3 细胞增殖抑制率的观察实验分组为空白组(未加任何干预)和理冲汤含药血清组,取处于对数生长期的卵巢癌ID8细胞,制备成细胞浓度为104个细胞每孔,接种于96孔板中,每孔体积200 μL。每组6个复孔,空白组未加任何干预,之后含药血清组加入25%理冲汤含药血清,干预24 h、48 h、72 h、96 h后,向每个孔中分别加入20 μL的MTT溶液(5 g/L),并将96孔板在于培养箱中孵育4 h。后吸出每个孔中液体,向每个孔中加入150 μL二甲基亚砜(DMSO),低速摇动10 min。在490 nm波长处测量每个孔的吸光度值A。细胞抑制率=(1-A给药孔/A空白孔)×100%。
1.5.4 细胞凋亡的观察采用流式细胞术检测卵巢癌ID8细胞空白血清组和含药血清组细胞凋亡的改变。取处于对数生长期的卵巢癌细胞,接种于6孔板中,分组同1.5.3项,收集1~5×105个细胞,PBS洗涤2遍。离心后加入0.5 mL的Binding Buffer悬浮细胞。加入5 μL AnnexinⅤ-FITC和5 μL PI,混匀。室温下,避光孵育15 min,PBS洗2遍后上流式细胞仪检测。
1.5.5 Tregs分选及细胞共培养首先取新鲜正常小鼠的抗凝全血累计5 mL,利用淋巴细胞分离液提取外周血单个核细胞(Peripheral blood mononuclear cell,PBMC),后用PBS洗2遍。将离心好的细胞用Miltenyi CD4+CD25+Regulatory T Cell Isolation Kit提取Tregs。洗脱细胞,用完全培养基重悬后将细胞按照0.8×105个/mL分为4份 接种于24孔板中。将HUVECs和Tregs分为8组进行共培养:A,空白组(完全培养基);B,抗VEGF组(完全培养基+VEGF抗体);C,理冲汤含药血清组(理冲汤含药血清培养基);D,抗VEGF+理冲汤含药血清组(VEGF抗体+理冲汤含药血清培养基);E,Tregs组(完全培养基+Tregs);F,Tregs+抗VEGF组(完全培养基+Tregs+VEGF抗体);G,Tregs+理冲汤含药血清组(Tregs+理冲汤含药血清培养基);H,Tregs+抗VEGF+含药血清组(Tregs+VEGF抗体+理冲汤含药血清培养基)。其中,完全培养基为含10%胎牛血清和双抗的1640培养基;抗VEGF组加入的VEGF抗体体积为20 μL。
1.5.6 小管形成检测Matrigel基质胶在4℃下过夜溶解;将枪头盒、EP管、96孔板放入4℃冰箱预冷过夜;第二天在冰盒上铺胶,在96孔板中加入Matrigel基质胶,每孔50 μL,37℃孵育30 min,根据1.5.5项实验分组,制备细胞悬液,细胞消化后调节细胞悬液浓度至1×105个细胞/mL。每孔接种1×104细胞/mL,在培养箱中培养24 h。在倒置显微镜下观察拍照。
1.5.7 细胞免疫荧光按照1.5.5项分组,将HUVECs接种在放置了盖玻片的24孔板中,待汇合度在80%左右时,从培养箱中取出。用预温的PBS洗涤3次,每次10 min。4%多聚甲醛固定,室温30 min。PBS洗涤3次,每次10 min。0.25%Triton X-100透化细胞,室温20 min。PBS洗涤3次,每次10 min。1%BSA室温封闭30 min。加一抗(用1%BSA稀释,1:200)放在湿盒里,4℃过夜。PBS洗3次,每次10 min。加二抗(用1%BSA稀释),室温闭光60 min。PBS洗3次,每次10 min。加入DAPI染核,室温5 min。PBS洗3次,每次10 min,荧光拍照。
1.6 统计学分析用SPSS 23.0软件进行统计学分析,计量资料以均数±标准差(±s)表示。采用独立样本t检验做组间比较分析。流式数据用kaluza流式细胞仪分析软件分析做图。以P<0.05为差异有统计学意义。
2 结果
2.1 理冲汤含药血清培养后不同时间点的ID8细胞增殖改变与空白组相比,理冲汤含药血清组对ID8细 胞 在24 h、48 h、72 h和96 h分 别 为9.310%、14.627%、22.170%和27.029%,随着作用时间延长而抑制率逐渐增高(P<0.05)。见表1。
表1 理冲汤含药血清对ID8细胞增殖抑制的影响(±s)

表1 理冲汤含药血清对ID8细胞增殖抑制的影响(±s)
注:与空白组比较,*P<0.05。
组别空白组理冲汤含药血清组24 h 0.581±0.022 0.526±0.098 48 h 0.793±0.082 0.617±0.017*72 h 0.857±0.066 0.667±0.036*96 h 0.973±0.126 0.710±0.019*
2.2 ID8细胞经理冲汤含药血清作用48 h后细胞凋亡的改变流式细胞术检测结果显示理冲汤含药血清组卵巢癌ID8细胞凋亡率为(12.52±0.23)%,而空白组ID8卵巢癌细胞的凋亡率为(4.46±0.54)%,差异有统计学意义。提示,理冲汤含药血清可促进ID8细胞凋亡作用。见图1。

图1 空白组和理冲汤含药血清组48h时的细胞凋亡
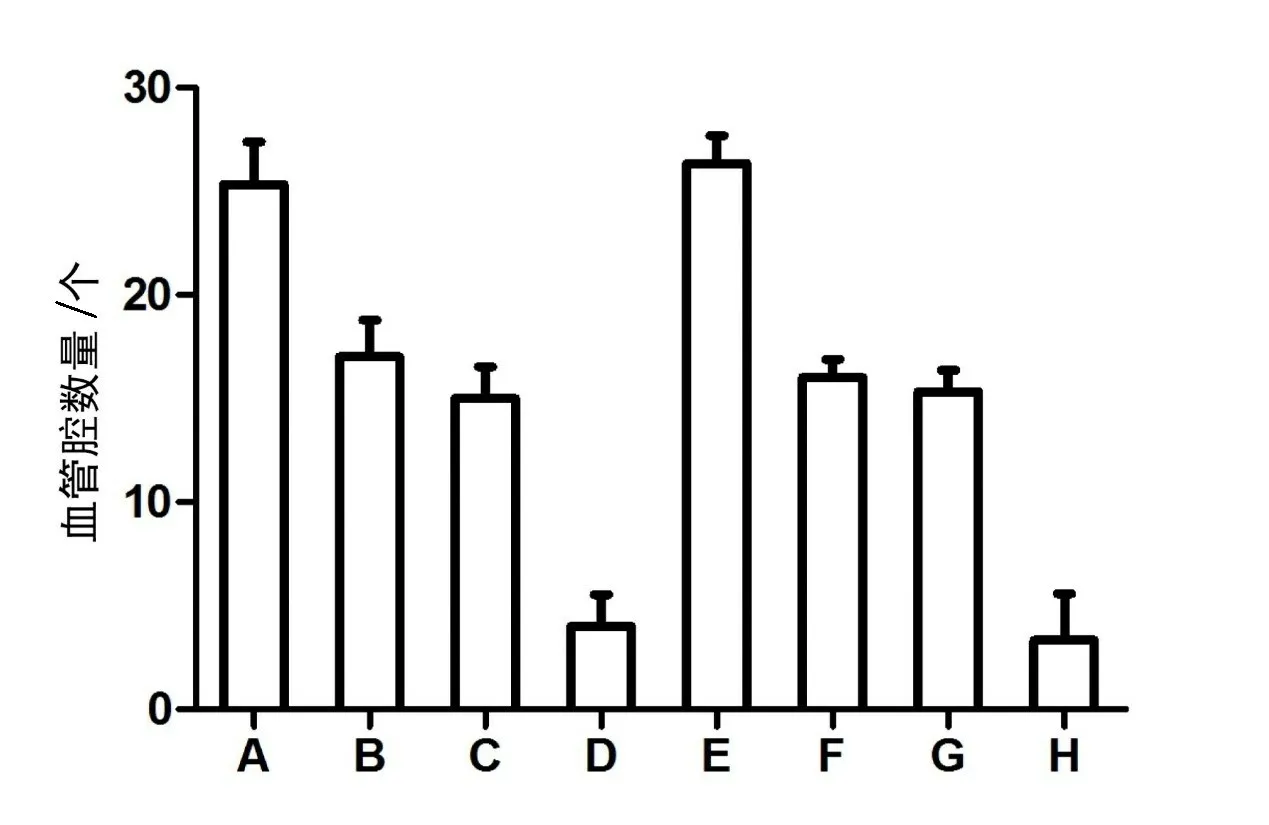
图2 理冲汤对HUVEC血管生成数量的影响
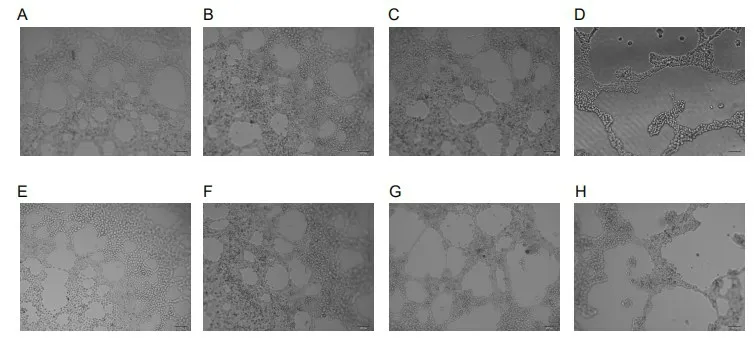
图3 理冲汤对HUVEC血管生成的影响(×100)
2.4 理冲汤对HUVEC的VEGF、MMP-2和MMP-9表达的影响与未加入Tregs分组(A、B、C、D组)比较,加入Tregs各组(E、F、G、H组)HUVEC的VEGF、MMP-2和MMP-9表达明显增高。其中,A、E组中HUVEC的VEGF、MMP-2和MMP-9表达明显高于其它组。与抗VEGF抗体(B、F组)或理冲汤含药血清(C、G组)共培养的HUVEC的VEGF、MMP-2和MMP-9表达则较低。理冲汤含药血清+抗VEGF组(D、H组)二者联合时,VEGF、MMP-2和MMP-9表达分别较A、E组显著减少。见图4。

图4 理冲汤对HUVEC细胞MMP-2、MMP-9和VEGF表达的影响(×100)
3 讨论
肿瘤微环境(tumor microenvironment,TME)是肿瘤细胞赖以生存的局部生态环境,与肿瘤的生长、侵袭及转移密切相关,由基质细胞(包括巨噬细胞、Tregs、成纤维细胞等)和细胞外基质组成。大多数实体肿瘤形成病理生理微环境,其特点是微血管网和血流模式不规则,在肿瘤的恶性进展、免疫逃逸和治疗抵抗中TME均发挥关键作用[7]。目前,卵巢癌的发病机制尚不完全清楚。探索改变卵巢癌免疫微环境和逆转免疫抑制的新机制是卵巢癌免疫治疗的研究策略和热点。
Tregs作为免疫系统中的基本细胞,在免疫稳态和诱导机体免疫耐受中扮演重要角色,且在感染、肿瘤、器官移植、预防自身免疫性疾病和维持机体免疫平衡方面发挥重要作用。在肿瘤微环境中,T细胞能诱导和分化Tregs,其通过对自身抗原的免疫耐受来防止自身性免疫疾病的发生。然而,通过免疫抑制作用,Tregs可促使肿瘤发生免疫逃逸,抑制抗肿瘤免疫,从而促进肿瘤的发生及发展[8]。血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR-2)在肿瘤血管生成中起重要作用,有研究表明VEGFR-2信号通路可以增加Tregs对肿瘤的浸润。通过阻断VEGF-VEGFR2信号减少免疫抑制细胞在TME中的积累并抑制肿瘤生长。因此,靶向激活Tregs表达的VEGFR2分子或阻断VEGF-VEGFR2信号可抑制Treg进而促进肿瘤免疫[9]。
目前,针对Tregs的细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)、程序性细胞死亡蛋白-1(programmed death-1,PD-1)抑制剂[10]在临床试验中取得了一定疗效,然而由于此类药物无选择性地“攻击”Tregs,会导致人体免疫微环境稳态的破坏,进而产生严重的毒副作用,限制了此类药物的应用。因此,当下免疫治疗的关键应当是通过合理调节Tregs,将病人自身固有的、在肿瘤生长过程中被弱化的免疫反应恢复至常态,从而恢复免疫微环境的稳态平衡。中医药治疗疾病的特点在于整体性、平衡性、多系统、多靶点,其与肿瘤微环境的基本特点相似[11]。肿瘤微环境中存在的主要“免疫抑制”机制是Tregs介导的恶性肿瘤细胞在肿瘤微环境中的免疫逃逸,而这种免疫抑制的肿瘤微环境,也就相当于中医的“正气虚损”为主的环境。临床实践中,采用扶持正气为主的中医药治疗方案对于肿瘤免疫微环境的调控和防治肿瘤的复发转移具有确切的临床意义[12]。中医药治疗卵巢癌是多途径、多层次及多靶点的整体综合治疗[13]。中药对肿瘤微环境的调节作用包括减少血管生成细胞、降解细胞外基质、调节免疫细胞(包括T淋巴细胞、B淋巴细胞、自然杀伤细胞等)[11]。扶正固本、活血化瘀等中药的活性成分具有抑制增殖、抑制侵袭和迁移,诱导细胞凋亡,阻断血管及抑制有氧糖酵解等作用[14]。
理冲汤出自张锡纯《医学衷中参西录》治疗妇科肿瘤的名方,具有益气养阴和祛瘀消癥作用。方中黄芪、党参、白术及山药可扶正益气;天花粉和知母可清热养阴;三棱和莪术具有行气破血,消积止痛之效;鸡内金健胃消食,并化瘀血且不伤气分[15]。黄芪、山药、五味子等药物通过提高荷瘤小鼠T、B淋巴细胞比例和活化水平来抑制血管内皮细胞的生长和肿瘤细胞的迁移,进而增强抗肿瘤作用[16]。天花粉蛋白对癌细胞有放射增敏作用,其机制可能与增加凋亡相关[17],三棱莪术组方的辅助治疗有利于减轻胃癌患者化疗期间的中医证候,降低肿瘤相关标志物水平,提高患者免疫功能[18]。
本研究结果显示,理冲汤不仅可以抑制卵巢癌细胞的增殖,还可以促进其凋亡。同时通过细胞共培养及血管成形实验还发现,Tregs共培养各组与Tregs未共培养各组相比,血管成网明显,说明Tregs能够促进血管生成,这与文献[19]的研究结果一致。VEGF能促进血管生成,导致肿瘤血管畸形,造成TME中缺氧和低PH,从而促进局部和系统性免疫抑制,进而导致肿瘤进展[20]。Tregs共培养各组中添加理冲汤中药含药血清以及抗VEGF抗体后,呈现不同程度血管结构疏松破坏,提示理冲汤含药血清能够发挥抑制HUVEC的血管生成,可能有与抗VEGF抗体类似的作用,理冲汤发挥抗血管疗效可能是与拮抗Tregs的作用相关。MMPs降解细胞外基质(extracellular matrix,ECM)是肿瘤细胞侵袭和转移的关键环节之一。MMPs的表达水平与促进肿瘤细胞侵袭和迁移的炎症程度密切相关。在乳腺癌、结直肠癌、胃癌、肝癌、卵巢癌中都发现有MMPs的高表达[21]。在卵巢癌离体标本中,MMP-2抗原与血管生成拟态(vasculogenic mimicry,VM)数量呈正相关,MMP-2与VM的形成密切相关,且在卵巢癌细胞围成的管状结构中存在大量MMP-2棕褐色颗粒[22]。理冲汤可通过抑制MMP-2、MMP-9的活性来改善肿瘤的发生发展[23-24]。本研究结果显示,理冲汤可能通过抑制VEGF的表达和降低MMP-2、MMP-9的活性来达到抗血管生成的目的,从而达到抑制肿瘤生长的效果。
综上所述,理冲汤可能是通过调控卵巢癌微环境中免疫抑制和新生血管来达到治疗卵巢癌的疗效。此外,理冲汤中含有多种活性成分,需要今后进一步研究其活性成分对机体的主要作用及其作用机制。

