金鱼草AmPIF4基因克隆及调控花香物质合成释放功能分析
李 彤,邵慧慧,韩嘉宁,王雪莲,胡增辉,吴 静*
(1 北京农学院 园林学院,北京 102206;2 北京林木分子设计育种高精尖创新中心,北京 102206)
花香不仅是植物重要的观赏特性,也是植物体内重要的次级代谢产物,对植物的防御和繁衍有重要意义。光照作为重要的环境因子,对花香成分的合成和释放起着调控作用[1]。研究发现,‘金盏银台’水仙花香中的化合物数量随着光强的增加表现先增大后减小的规律,在低光强下花香成分更多,而花香中不同化合物种类的相对含量随光强则表现不同的变化规律[2]。黑暗条件下桂花清香、甜香气息不足可能是持续黑暗导致芳樟醇及其氧化物、反式-β-罗勒烯等萜烯类物质释放比例降低的原因[3];栀子的香气成分种类随着遮光率的增加而减少,其中萜烯类物质随着遮光率的增加先增加后减少[4];蓝光也能够促进萜烯类挥发物的合成和释放,茶叶中的挥发性萜烯在蓝光照射下显著增加,蓝光处理下墨西哥薄荷精油主要成分倍半萜的合成途径也更加活跃[5-6]。但是光调控花香挥发性物质合成和释放的机制及信号途径尚不清楚。
PIFs(phytochrome-interacting factors)是一种bHLH型转录因子,作为光形态建成的负调控因子[7],主要响应温度及红光信号。PIF4是高温条件下促进拟南芥生长必不可少的转录因子,PIF5在高温诱导的适应机制中也有一定作用[8]。PIFs与(远)红光受体PHYA/B(Phytochromes A/B)形成的模块具有多种调控功能,研究发现拟南芥表皮可通过phyB-PIF4-生长素途径控制植株心皮和气孔发育等[9]; PIFs也可与蓝光受体光敏色素CRYs(cryptochromes)相互作用调节一系列转录过程,PIF4被证明可与CRY1、CRY2相互作用以调节植物荫蔽反应,调控拟南芥下胚轴伸长[10-11]。而且PIFs在植物的次生代谢调控中也发挥重要的作用,MEP(methylerythritol phosphate)和MVA(mevalonate)是植物萜烯合成的两条关键途径[12]。研究表明PIF5可对萜烯的生物合成进行调控[13],在pif1、pif3、pif4、pif5单突变体和pifQ突变体中,DXS1、DXR、HDR基因表达水平显著升高,提示PIFs是负调控因子,ChIP-qPCR进一步证实了PIFs对DXS1和DXR的直接调控[14]。在更早的研究中发现PIFs可能是通过直接结合DXS、DXR、HDS、HDR启动子的PBE-BOX原件来参与MEP途径的调控[15]。
金鱼草 (AntirrhinummajusL.)是玄参科金鱼草属多年生草本植物,因其花色艳丽、品种丰富、生长周期短而成为研究花卉的模式植物[16]。金鱼草花香的主要物质有萜烯物质月桂烯、罗勒烯和苯甲酸甲酯等苯环型/苯丙素类物质[17]。课题组前期工作表明,用不同光强、光质处理金鱼草花朵会使其花香释放量差异变化,基于PIF4对光信号的响应以及对萜烯合成途径的调控作用,本实验以‘马里兰’金鱼草为实验材料,运用病毒诱导基因沉默 (virus-induced gene silencing,VIGS)技术,将AmPIF4基因编码区片段构入烟草脆裂病毒载体获得重组DNA,侵染金鱼草并测定基因表达量;烟草是外源基因瞬时表达的首选植物,目前已在多个方面优化条件,烟草叶片能瞬时表达 GFP[18],从而检测蛋白在细胞中的定位;以自动热吸附气相色谱-质谱联用(automatic thermal desorption gaschromatography/mass spectrome,ATD-GC/MS)检测金鱼草主要花香物质的变化,为后续研究金鱼草花香代谢的调控奠定基础。
1 材料和方法
1.1 实验材料
‘马里兰’金鱼草的栽培与养护方法同韩嘉宁等[19],本氏烟草(Nicotianabenthamiana)种子由本实验室收集并常温保存。实验所用pNC-Green-SubC、pNC-GFP、pTRV载体均为北京农学院园林学院分子生物学实验室现有保存材料,pclone007 Blunt Simple载体和大肠杆菌(E.coli)感受态DH5α购于北京擎科生物科技有限公司,农杆菌GV3101菌株购于上海唯地生物技术有限公司。
1.2 实验方法
1.2.1AmPIF4基因片段克隆金鱼草RNA提取、cDNA合成及反转录、qRT-PCR检测方法及反应体系同韩嘉宁等[19]。在金鱼草基因组数据库(http://bioinfo.sibs.ac.Cn/Am/download-v2.php)内查找AmPIF4基因序列(登录号Am03g17770),选取AmPIF4基因编码区为目标片段,用Snapgene设计含有BamHⅠ和XbaⅠ酶切位点的同源臂引物pTRV2-AmPIF4-F和pTRV2-AmPIF4-R(表1),以cDNA为模板进行克隆,扩增程序:98 ℃预变性3 min;98 ℃ 10 s;56 ℃ 15 s;72 ℃ 1 min,进行35个循环; 72 ℃延伸3 min。琼脂糖凝胶电泳验证并纯化回收PCR产物。

表1 引物序列
1.2.2AmPIF4基因表达分析AmPIF4基因时空表达分析:(1)采集花蕾期、初开期、半开期和盛开期4个时期的花朵,以AmUBI(ubiquitin)为内参基因进行定量分析,引物见表1;(2)采集金鱼草植株不同器官及组织样品[根、茎、叶、萼片、子房、花药、花丝、雌蕊、上瓣与下瓣(将金鱼草花瓣三瓣部分定义为上瓣,两瓣部分为下瓣)、花筒],进行qRT-PCR检测;侵染后AmPIF4基因表达分析:提取侵染后金鱼草花瓣上下瓣混样作为样品,方法同上。
1.2.3 侵染后金鱼草花香成分测定植株在培养间生长 7 d,观察表型变化即花瓣周边有卷曲、质感变硬,但生长状态良好。为了不损伤植物,采用顶空套袋方法收集花香挥发物,GC-MS 分析花香,具体步骤同赵静等[17]的实验方法。
1.2.4AmPIF4基因生物信息学分析在NCBI上使用blast对AmPIF4基因序列全长进行同源检索,下载相似性较高的物种蛋白序列,使用DNAMAN和MAGA7对序列进行同源比对和进化树分析;使用ExPASy分析蛋白一级结构及理化性质,并使用 SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测二级结构。
1.2.5 AmPIF4亚细胞定位及pNC-Green-SubC-AmPIF4重组载体构建通过网站(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测AmPIF4定位在细胞核。根据AmPIF4 的CDS序列设计去终止子引物Z-AmPIF4-F和Z-AmPIF4-R,即反向引物中不包含终止密码子。克隆并回收PCR产物,连接pclone007后转入DH5α,经鉴定后提取阳性质粒进行测序,得到去除终止子的质粒。使用带有通用接头的引物JT-AmPIF4-F和JT-AmPIF4-R进行扩增,同时使用SfiI (TaKaRa公司)1 μL,Cut Smart Buffer 5 μL, pNC-Green-SubC 载体3 μL,补充无菌水至20 μL,50 ℃条件酶切 1.5 h。
使用回收扩增产物0.75 μL和酶切产物1.75 μL,2×Seaming Less Mix (TaKaRa公司)无缝连接酶预混液2.5 μL,50 ℃条件连接15 min后转入DH5α,涂布于含卡那霉素(50 μg/mL)的平板37 ℃过夜培养。挑取单菌落经PCR鉴定提取阳性质粒进行测序比对,显示成功构建pNC-Green-SubC-AmPIF4重组载体。使用pNC-GFP空载体作为阴性对照。
1.2.6 病毒重组载体pTRV2-AmPIF4的构建对pTRV2载体进行酶切,酶切及连接体系同上。pTRV载体构建如图1所示。

35S.35S启动子;CP.外壳蛋白; Rz.自裂核酶;NOSt. 硝酸钾合酶终止子图1 pTRV2-AmPIF4重组载体示意图35S. 35S promoter; CP. Coat protein; Rz. Self-cleaving ribozyme; NOSt. Nopaline synt hase terminatorFig.1 Schematic diagram of the recombinant vector pTRV2-AmPIF4
1.2.7 农杆菌转化与侵染将pTRV2-AmPIF4与pTRV质粒采用冻融法分别转入农杆菌GV3101后涂布于含卡那霉素(50 μg/mL)与利福平(100 μg/mL)的平板,倒置于28 ℃恒温培养箱培养48~96 h。挑取单菌落于相应抗性及浓度的LB培养基25 mL,28 ℃、200 r/min培养12~24 h。6 000 r/min集菌5 min后加入侵染液(含10 mol/L MgCl2、MES,200 μL/L AS)振荡悬浮菌体,调整菌液OD600为1.0左右。将含有pTRV2-AmPIF4、pTRV2与pTRV1的侵染液以1∶1比例混合,黑暗3 h。用一次性注射器对金鱼草花瓣、茎、叶进行注射。
pNC-Green-SubC-AmPIF4和pNC-GFP质粒的转化方式同上,菌液OD600为0.8,通过注射烟草叶片背部进行侵染。侵染后的植株在21 ℃、湿度30%培养间黑暗放置12 h后,进行16 h光照/8 h黑暗培养7 d。
1.2.8 统计分析选择长势良好且一致的实验材料,从不同植株采集混样,均进行3个生物学重复。所有实验数据采用Excel进行统计分析,以SPSS22.0 one-way ANOVA进行差异显著性分析。
2 结果与分析
2.1 AmPIF4基因的克隆与分析
琼脂糖凝胶电泳结果(图2)显示,在约1 500 bp附近出现明亮的条带,条带清晰且单一,纯化回收目的条带,测序结果表明成功克隆AmPIF4基因编码区序列全长,可用于构建pTRV2-AmPIF4重组载体。

图2 AmPIF4基因扩增结果Fig.2 PCR detection result of AmPIF4 gene
AmPIF4基因CDS全长1 498 bp,由498个氨基酸组成,预测其编码产物分子量为55.58 kD,等电点为6.44,呈弱酸性。20种氨基酸参与该蛋白的编辑,其中丝氨酸(Ser)含量最高,占11.6%,脯氨酸(Pro)次之,色氨酸(Trp)含量最少,仅有1.2%;AmPIF4包含113个氨基酸残基的α-螺旋,占总氨基酸残基总数的22.69%;包含24个氨基酸残基的延伸链,占总氨基酸残基的4.82%;包含10个氨基酸残基的β-折叠,占氨基酸残基数的2.01%;包含351个无规则卷曲,占总氨基酸残基数的70.48%。
将AmPIF4完整的开放阅读框推测的氨基酸序列与其他植物进行同源检索(图3),该序列与芝麻(Sesamumindicum)、旋蒴苣苔(Dorcocerashygrometricum)的相似性分别达到58.32%和52.30%。用MEGA7.0构建进化树,将AmPIF4蛋白与其他18种植物进行比对(图5),金鱼草与旋蒴苣苔聚为一类,与芝麻、丹参(Salviamiltiorrhiza)亲缘关系较近。
2.2 AmPIF4亚细胞定位分析
从GFP信号检测可知,对照pNC-GFP定位于细胞的整个原生质体(图4,A),而pNC-Green-SubC-AmPIF4定位于烟草表皮细胞的细胞核(图4,B),表明AmPIF4特异定位在细胞核中。

A. pNC-GFP;B. pNC-Green-SubC-AmPIF4图4 AmPIF4蛋白的亚细胞定位Fig.4 Subcellular localization of AmPIF4 protein
图5 AmPIF4蛋白与其他18种植物PIF4蛋白的系统进化分析Fig.5 Phylogenetic analysis of PIF4 proteins of snapdragon and other 18 plants
2.3 AmPIF4时空表达分析
由花朵形态特征的变化将金鱼草发育时期分为4个阶段:花蕾期、初开期、半开期和盛开期(图6,A)。从花蕾期到盛开期,AmPIF4基因的相对表达量逐渐增加,在盛开期达到最高(图6,B),花蕾期、初开期相对表达量相差不大,而相比于半开期、盛开期达到显著差异水平。
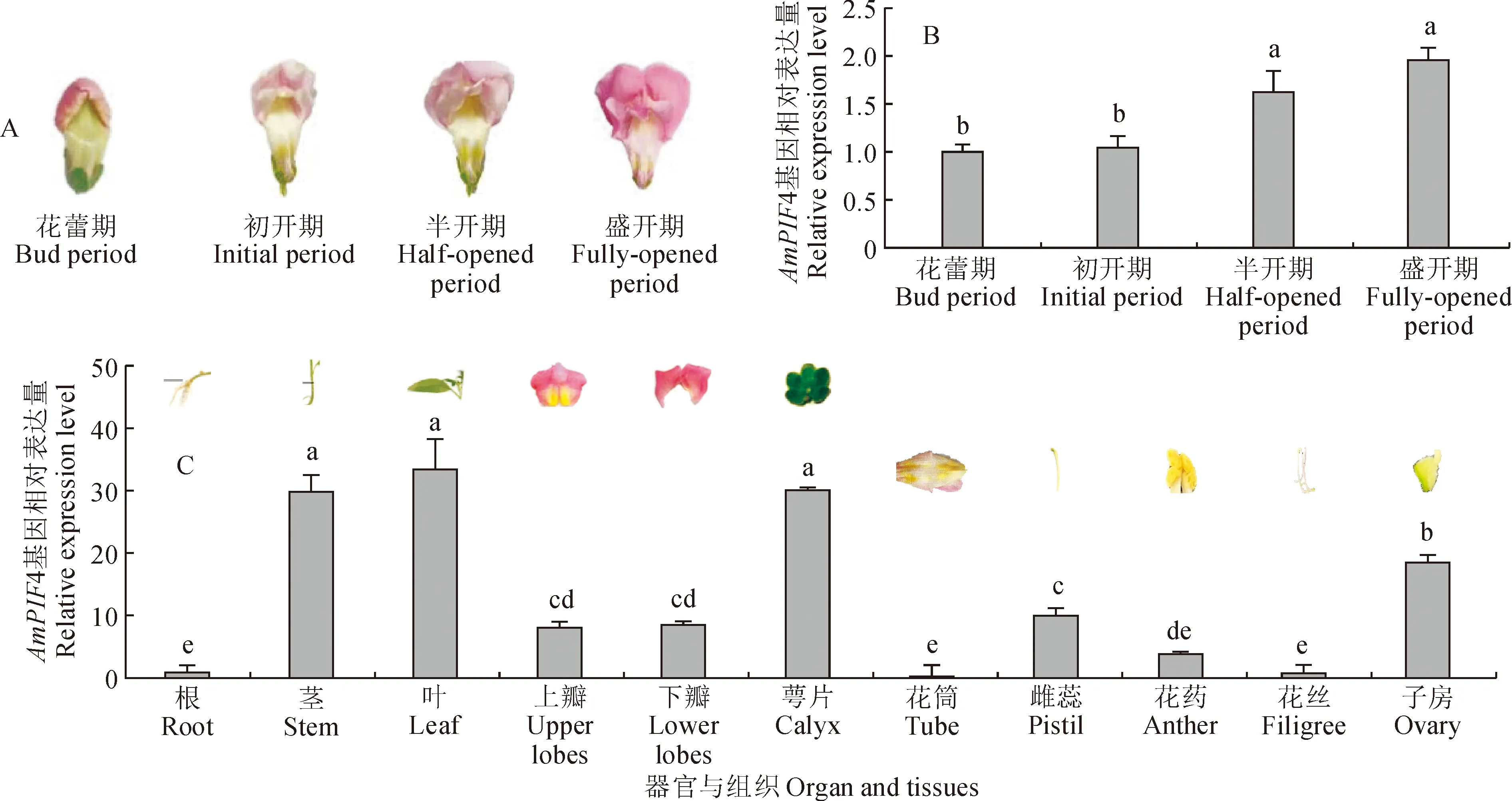
A. 金鱼草花朵不同发育时期;B. 不同发育时期AmPIF4基因的相对表达量;C. 盛开期金鱼草花朵不同器官及组织中AmPIF4基因的相对表达。不同小写字母表示差异显著 (P<0.05),下同图6 AmPIF4基因的表达A. Different developmental stages of snapdragon flowers;B.Relative expression level of AmPIF4 gene at four flower developmental stages; C.Relative expression of AmPIF4 gene in different organs of fully opened flower and tissues. Different normal letters on the bar represent significant difference (P<0.05), the same as belowFig.6 qRT-PCR qualitative analysis of AmPIF4 gene
盛开期花朵不同组织中,萼片中AmPIF4基因的相对表达量最高,其次是子房、雌蕊,差异均达显著水平;上瓣与下瓣次之,且上下瓣AmPIF4基因的相对表达量基本一致;金鱼草花朵其他组织中花药的相对表达量最高,花丝次之,而花筒最低,差异显著。
盛开期花朵以外其他器官,即根、茎、叶中AmPIF4基因的相对表达量的结果表明,叶片中AmPIF4基因的相对表达量在盛开期金鱼草植株中最高,与茎中的相对表达量差异不显著,而与根中差异十分显著(图6,C)。
综上所述,AmPIF4基因在盛开期金鱼草植株叶片中相对表达量最高,花筒中最低。
2.4 沉默后金鱼草AmPIF4基因表达分析
由图7可得,在花瓣中重组病毒载体pTRV2-AmPIF4侵染组的AmPIF4基因相对表达量较WT下降65%,较阴性对照组下降45%,差异达到显著水平(P<0.05),表明AmPIF4成功被沉默。

WT.野生型;pTRV.阴性对照;pTRV2-AmPIF4.重组病毒载体图7 沉默后AmPIF4基因的qRT-PCR结果WT. Wild type; pTRV. Negative control; pTRV2-AmPIF4. Recombinant virus vectorFig.7 qRT-PCR qualitative analysis of AmPIF4 gene silencing
2.5 AmPIF4的沉默对金鱼草主要花香成分的影响
以WT野生型组、pTRV阴性对照组和pTRV2-AmPIF4重组病毒载体组植株为实验材料,图8显示了侵染前后金鱼草释放的主要花香物质中苯甲酸甲酯、月桂烯和罗勒烯的相对含量。其中,pTRV2-AmPIF4重组病毒载体组植株释放的罗勒烯和苯甲酸甲酯含量与WT野生型组、pTRV阴性对照组相比均显著增加,并以罗勒烯的含量增加尤其显著。
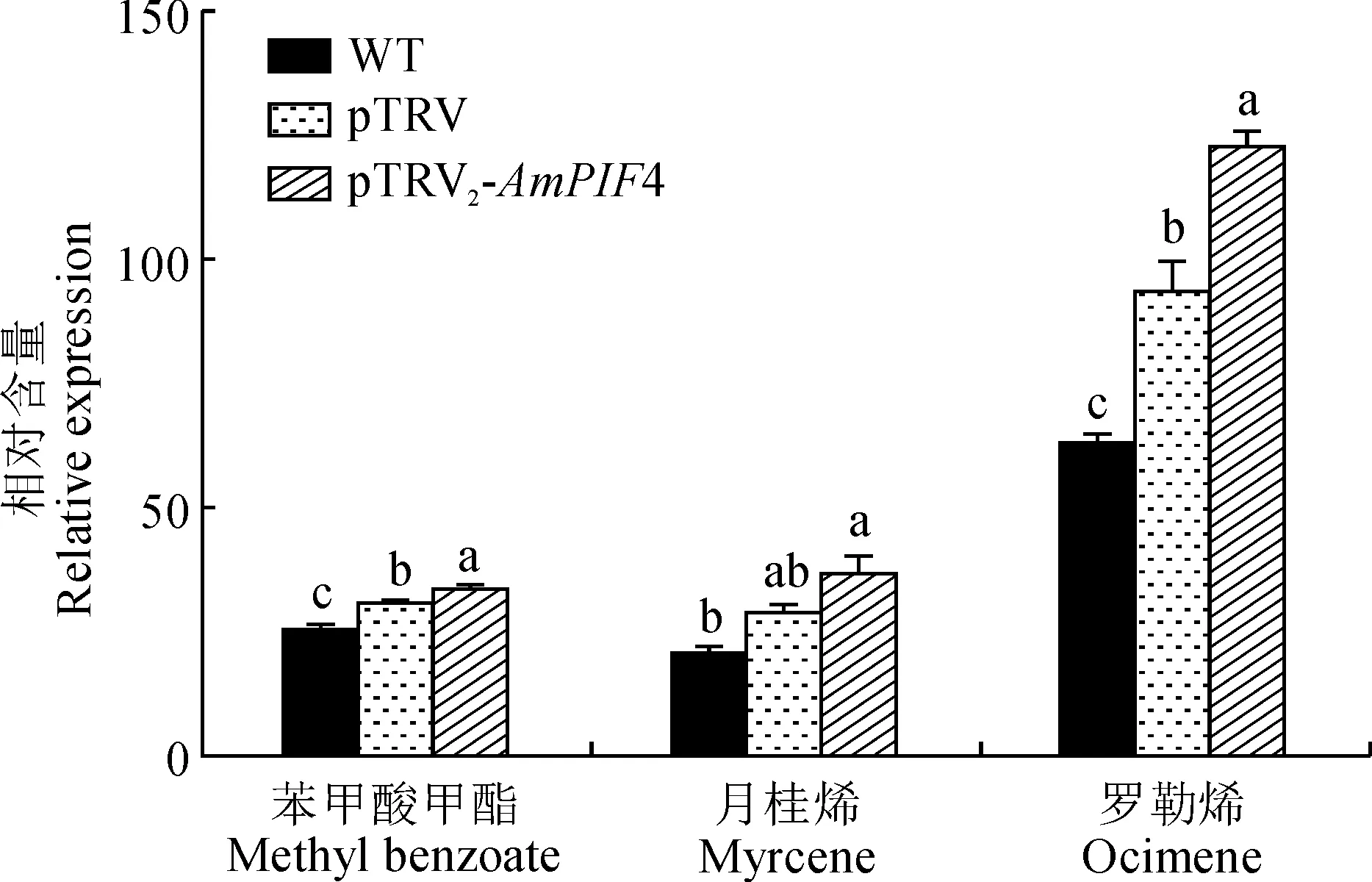
图8 金鱼草花瓣中各类花香物质的含量Fig.8 Relative contents of the floral substance in snapdragon petals
另外,由图8可得,与阴性对照相比,沉默AmPIF4后金鱼草花瓣主要花香挥发物成分月桂烯、罗勒烯和苯甲酸甲酯释放量分别上升了 22%、24%和12%,花香释放量总体含量上升。说明AmPIF4对金鱼草主要花香成分的合成释放存在负调控作用。
3 讨 论
PIFs转录因子已经在多种植物中得到克隆,研究明确MdPIF4在苹果温度响应中的作用具有重要意义[20],GmPIF1在大豆形态建成中起作用,且促进黄酮类物质的产生[21],ZmPIFs是植物避荫反应的正调控因子,在调节玉米光信号和光形态建成中具有保守和独特的分子特性[22],而PIFs在金鱼草中的作用还未曾报道。
本研究克隆了金鱼草AmPIF4基因编码区序列,农杆菌介导法转化烟草细胞瞬时表达结果显示AmPIF4蛋白定位在细胞核;检测到AmPIF4基因在不同的发育时期及各个组织中均有表达,金鱼草花香成分主要在花瓣中合成释放[17],而不同组织及器官的qPCR结果显示AmPIF4在金鱼草植株的叶片、茎等绿色组织及器官中的表达量高于花瓣,这与MdPIF4在苹果叶片中的表达量最高,其次为根、茎、花,在果实中的表达量最低的结果一致[20]。
最近研究发现,PIFs可通过光信号传导参与植物形态建成,控制植物生长发育。拟南芥在受光后,蓝光和红光激活的光感受器通过抑制转录因子PIFs的活性使下胚轴停止伸长[23]。同样,PIFs可以响应光及温度的变化进一步影响植物开花以及次生代谢等,PIF4转录因子与植物控制开花的基因如ELF、FT等形成复杂的基因网络,研究证明其参与调控日变温条件下植物早花[24],AtPIF4通过抑制拟南芥AtPAP1的转录而负调控花青素的积累[25],PIF3也被证明与草莓花青素的积累有关[26],PIF4和PIF5调控拟南芥油菜素内酯合成[27]。
目前关于PIFs转录因子的研究仍然集中在逆境应答和形态建成方面[28],且PIFs对光信号响应的报道全部来自叶片,花瓣中少见。本研究成功地利用同源重组的方法构建了pTRV2-AmPIF4载体,使AmPIF4基因在金鱼草植株有效沉默,经过GC-MS花香挥发物质测定,结果分析表明,沉默后的金鱼草主要花香物质罗勒烯、月桂烯与苯甲酸甲酯含量有不同程度的增加,说明AmPIF4对萜烯类花香成分以及苯甲酸甲酯的合成释放存在负调控的作用。
研究为PIF4转录因子的功能研究提供信息,同时对光诱导的花香代谢调控的研究提供新的思路。植物花香物质前体来自叶片光合产物,而后续代谢途径在花瓣中进行,PIFs介导的光信号途径是否直接调控萜烯合成途径与苯丙氨酸代谢途径仍需进一步工作证实,后续仍需要对AmPIF4进行生物学功能、调控途径以及作用机制等方面的研究。

