Fe对Ni/SBA-16催化CO低温甲烷化促进作用的研究
高文莉,辛忠,2
(1华东理工大学化工学院,上海市多相结构材料化学工程重点实验室,上海 200237;2华东理工大学,化学工程联合国家重点实验室,上海 200237)
引 言
“碳达峰”“碳中和”双碳目标的提出,标志着我国的能源结构将从以煤炭作为主要能源向清洁能源如天然气、光能、风能等迈进。在碳中和的宏伟目标下,我国的能源结构变化将会有三步走:(1)从高碳到零碳,即到2028 年左右实现新能源平价;(2)在非电领域完成天然气代替石油煤炭,在电力领域进行新能源存量替代;(3)实现氢能平价,最终实现能源碳中和目标。因此,经由煤的合成气制备天然气成为了实现“碳中和”目标的重要途径,而其中合成气制备天然气的关键技术是甲烷化催化剂的开发。
CO甲烷化反应除了主反应外,伴随着许多副反应的发生[1-3]。

CO 甲烷化主反应是一个强放热反应,每增加1%的转化量,会使甲烷化反应器床层温度升高74℃[4-6]。同时,许多副反应也随之发生,导致复杂的包括CO2及Cn(n≥2)在内的产物分布。基于CO加氢反应的这种强放热特性,Ni 基催化剂由于其较低的价格及较高的催化活性而备受关注[7-8],因此许多研究致力于Ni 基CO 甲烷化催化剂的研究[7,9-12]。然而Ni 基CO 甲烷化催化剂也存在许多问题。在反应器中由于CO 转化会放出大量热,很容易造成催化剂局部过热,在较高的温度下Ni金属颗粒容易团聚形成大颗粒,导致催化剂失活[13-17],因而缩短了催化剂的使用寿命。此外,高温下积炭反应的发生会生成惰性炭覆盖在催化剂表面,然后不可避免地阻碍反应的进一步进行[18]。最重要的是,高温高压的反应条件存在反应设备要求高、操作成本高、能耗大、安全性低等缺陷。
简而言之,CO 甲烷化反应在高温条件下反应时平衡转化率会降低,并且高温条件很容易造成催化剂失活。因此,开发对反应设备要求较缓和、操作成本低、能耗小、流程短、安全性高的低温甲烷化催化剂有重要意义。其中介孔材料如MCM-41[6]、SBA-15[19]、KIT-6[11,20-21]因具有大的比表面积、较多的孔道而能够很好地进行传质传热,避免导致催化剂局部过热,从而使反应体系保持在较低的温度范围以最大限度降低催化剂失活。然而,单金属Ni 负载在分子筛上并不能很好地解决催化剂的失活问题。因此有研究表明,双金属Ni 基催化剂活性优于单金属Ni 催化剂的活性,如Mo[22]、La[23]、Ru[24]、Ce[5,25-27]、Zr[3,28-30]、Fe[31-34]等的加入与Ni 形成双金属催化剂的活性都高于单金属催化剂,其中Fe 由于低廉的价格及与Ni 较强的结合能力而广泛应用。但Fe 对Ni 基分子筛催化剂CO 甲烷化催化剂促进作用的机理还没有完全清晰。
本文采用介孔二氧化硅分子筛SBA-16 作为载体,Fe 作为第二活性金属通过共浸渍法来制备Ni-Fe/SBA-16 双金属催化剂。希望通过研究Fe的加入对Ni/SBA-16 催化剂的活性组分结构的影响、对催化剂理化性质的影响及对催化剂性能的影响,构建Ni-Fe/SBA-16 双金属催化剂的构效关系。
1 实验材料和方法
1.1 材料
F127(EO106PO70EO106),购于Sigma-Aldrich 公司,平均分子量为13000。硫酸钾(K2SO4),六水合硝酸镍[Ni(NO3)2•6H2O],九水合硝酸铁[Fe(NO3)3•9H2O],正硅酸乙酯[TEOS,(C2H5)4SiO4],盐酸(HCl),购于上海凌峰试剂有限公司。其中,盐酸质量分数为36%~38%。实验用水为去离子水,由和泰超纯水机生产,电阻>17 MΩ。
1.2 载体及催化剂的制备
采用水热合成方法制备介孔二氧化硅分子筛SBA-16,各原料F127∶TEOS∶H2O∶HCl∶K2SO4的摩尔比为0.0035∶1∶166∶6∶1.5。具体过程如下:在38℃恒温水浴下,将2.5 g三嵌段表面活性剂F127和15 g 硫酸钾(K2SO4)溶于125 g 去离子水中,然后加入HCl 35.6 g。继续搅拌2 h 后,缓慢滴加12 g TEOS,保持剧烈搅拌24 h。将混合液转移到聚四氟乙烯反应釜中,在均相反应器中100℃晶化24 h,然后过滤、洗涤、干燥,最后将干燥所得的产物在550℃下焙烧5 h(升温速率为1℃/min)除去模板剂,过200 目(颗粒直径≤74 μm)筛后即得到SBA-16 介孔分子筛白色粉末。
采用等体积共浸渍法制备Ni-Fe/SBA-16 催化剂,具体过程为:称取相对应Ni(NO3)2•6H2O 和Fe(NO3)3•9H2O 溶解在1.2 g 去离子水中,称取1.0 g SBA-16 白色粉末,边超声边将溶液滴加到载体中,室温下静置8 h后于60℃真空干燥8 h,然后在500℃空气中焙烧5 h(升温速率1°C/min),自然冷却至室温,即制得不同含量的Ni-Fe/SBA-16 双金属催化剂。催化剂中Ni的金属负载量控制为10%,Fe的金属负载量分别控制为0,1%,2%,3%,分别记为NixFe/S16,其中x=0,1,2,3。
1.3 催化剂结构表征
Ni-xFe/S16 催化剂的比表面积、孔容及孔分布采用Micromeritics 公司的ASAP 2020 在液氮温度(-196°C)下的N2物理吸附-脱附实验进行测定。在进行吸附-脱附实验之前,样品在300℃温度下进行脱气处理4 h,以除去样品中吸附的水及其他杂质。催化剂的晶相结构通过采用Bruker 公司的Advanced D8 粉末X射线衍射仪[XRD,带有CuKα射线,石墨单色器(λ=0.15418 nm)]在管电压为40 kV,管电流为40 mA时扫描得到。催化剂的微观形貌及金属颗粒的分散情况可以通过JEM-2100 型场发射电子显微镜(TEM)来观察,加速电压为200 kV。催化剂的晶格衍射条纹及元素分布通过高分辨率透射电子显微镜(HRTEM)及EDS-mapping 表征。催化剂中金属含量通过电感耦合等离子体发射光谱仪(Agilent 725 ICP-OES)测定。催化剂的还原性能(H2-TPR)通过Micromeritics 公司的Auto Chem Ⅱ2920 仪器进行测定。催化剂的金属分散度及金属比表面积采用Micromeritics 公司的Auto ChemⅡ仪器通过H2脉冲化学吸附(H2-pulse chemisorption)测定计算。Ni-xFe/S16 催化剂对反应气氛(CO 和H2)的吸附解离采用Micromeritics 公司的Auto ChemⅡ2920 仪器通过CO-TPD 和H2-TPD 来测定。催化剂中金属的结合能及两种金属之间的相互作用通过ESCALAB 210Xi X 射线光电子能谱仪(XPS)表征,其能谱仪的参数信息为:单色化Al Kα射线,hν=1486.6 eV。
1.4 催化剂性能表征
Ni-xFe/S16 催化CO 甲烷化反应在一个内径为8 mm 的Micromeritics 不锈钢固定床加压微反应器中进行,催化剂装填在反应管的中部。在活性表征之前将0.2 g 催化剂先在10 ml/min N2氛围下以20℃/min的升温速率升温至500℃后,换用20 ml/min的H2预还原2 h,在N2氛围下降温至200°C,然后将气体切换为反应混合气,V(H2)∶V(CO)∶V(N2)为3∶1∶1,混合气的空速为150000 h-1,温度每隔10℃保持稳定。1 h 后采用气相色谱在线分析产物组成。反应器内的温度由内置于反应器中催化剂内部的K型热电偶及一个空气冷凝系统来控制。反应器的出口产物通过空气冷凝装置降温进行气液分离后,气相部分通过在线气相色谱(GC7900,Techcomp)分析产物的组成。气相色谱装备有一个plot-Q 毛细管柱的氢火焰离子检测器(FID1)用于检测C2~C4的烷烃和烯烃产物,一个装有TDX-01填充柱的热导池检测器(TCD)来检测高浓度CO、CH4及CO2,此外产物中较低浓度的CO、CH4和CO2则通过转化炉后由FID2 检测。催化剂的活性通过CO 的转化率(XCO)、产物的收率(YCH4)及CH4、CO2、C2~C4的选择性(SCH4,SCO2,SC2~C4),分别通过式(9)~式(13)计算:

2 实验结果与讨论
2.1 Ni3Fe合金的形成
为了解Ni-xFe/S16 催化剂中金属与金属之间的相互作用,采用XPS 来探测还原前催化剂中金属元素的结合能及化学环境,结果见图1。图1 分析了Ni/S16 及Ni-2Fe/S16 催化剂中Ni 元素结合能变化,及Fe/S16、Ni-2Fe/S16 催化剂中Fe 元素的结合能变化。在结合能分别为855 和873 eV 左右属于Ni2+2p3/2轨道和Ni2+2p1/2轨道峰,而在结合能分别为862 及880 eV 左右则属于Ni2+2p3/2轨道及Ni2+2p1/2轨道的卫星峰。在Ni 元素的XPS 解卷积图中可以看出,Ni/S16 催化剂中Ni2+2p3/2轨道的结合能为855.3 eV,而在Ni-2Fe/S16 催化剂中则为856.1 eV,Ni2+2p3/2轨道结合能的增加说明了Ni2+附近电子云密度的降低,因此可以说明在Ni 元素与Fe 元素之间存在较强的相互作用力[35-36]。同时,在Fe 元素的XPS 解卷积图中可以看出,结合能为712 及726 eV 左右,分别属于Fe 2p3/2及其卫星峰。在Fe/S16 催化剂中Fe 2p3/2轨道的结合能为712.0 eV,而在Ni-2Fe/S16 催化剂中则为712.5 eV,Fe 2p3/2轨道结合能的降低意味着Fe 周围电子云密度的增加[12]。XPS 中元素结合能的变化说明了在Ni 与Fe 之间存在电子转移,这与Ni-Fe 合金的形成有关。

图1 催化剂的XPS谱图Fig.1 XPS patterns of catalysts
Ni-xFe/S16 在还原前、还原后及反应后的晶相结构通过XRD 进行表征,结果如图2 所示。催化剂的XRD 谱图中在23°附近出现的宽峰为无定形二氧化硅的峰,属于载体SBA-16。在还原前的XRD 谱图中,根据JCPDS PDF# 47-1049 卡片,在37.2°、43.3°、62.9°、75.4°、79.4°出现的衍射峰分别属于NiO(111)、(200)、(220)、(311)、(222)面,而在还原后及反应后催化剂的XRD 谱图中,根据JCPDS PDF# 04-0850 卡片,衍射峰为44.5°、51.8°、76.4°分别属于Ni(111)、(200)、(220)面。这说明了在还原前金属以氧化物形式存在,在还原后以金属态单质存在。在所有催化剂的XRD 谱图中没有出现Fe 单质或者其氧化物的特征衍射峰,这是由于Fe 含量太低而导致其衍射峰被Ni 的强衍射峰遮挡。从还原后催化剂的41°~47°慢扫XRD 谱图中可以清晰看出,Ni(111)面的特征衍射峰向低2θ角移动,根据JCPDS PDF #38-0419 卡片在2θ=44.3°的衍射角意味着Ni3Fe 合金的形成。
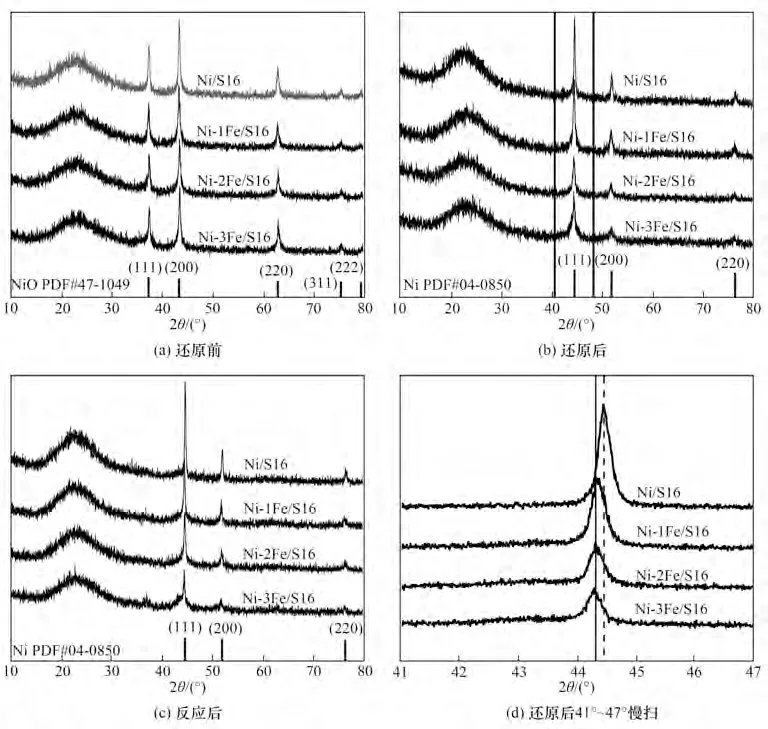
图2 催化剂的XRD谱图Fig.2 XRD patterns of catalysts
对还原后的Ni-2Fe/S16 催化剂进行了HRTEM 及EDS-mapping 表征,结果如图3 所示,从图中可以看出,Ni 元素与Fe 元素在载体上的分布呈现高度的一致性,并且Ni 元素和Fe 元素叠加后形成了明显的金属颗粒形状。HRTEM 图中计算得到Ni-2Fe/S16 催化剂中金属晶格衍射条纹间距约0.204 nm,由PDF #38-0419 卡片可知属于Ni3Fe合金的(111)衍射晶面。结合XPS、XRD、HRTEM及EDS-mapping 表征可知,Fe 加入后与Ni 形成了Ni3Fe 合金。

图3 Ni-2Fe/S16催化剂的HRTEM及EDS-mapping图Fig.3 HRTEM and EDS-mapping images of Ni-2Fe/S16 catalyst
2.2 Ni3Fe合金对催化剂性质的影响
2.2.1 催化剂理化性质 对载体进行了TEM 和XRD 表征,结果如图4 和图5 所示。由载体的TEM图(图4)可以看出,载体具有规整的孔道结构,且孔径大小在6~7 nm。由载体的XRD 谱图(图5)可以看出,在广角XRD 谱图中23°附近出现了宽峰,小角XRD 谱图中出现了尖锐的特征峰,说明载体具有短程无序长程有序的特征。由载体的小角XRD 谱图可以看出,在衍射角分别为0.8°和1.1°附近时出现了属于载体SBA-16(110)及(200)面的特征衍射峰,说明成功合成了载体SBA-16。

图4 载体SBA-16的TEM图Fig.4 TEM images of support SBA-16
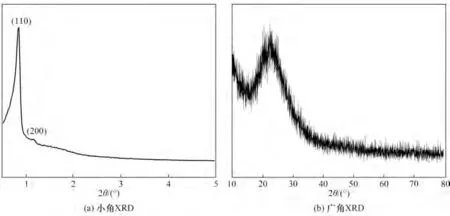
图5 载体SBA-16的XRD谱图Fig.5 XRD patterns of the support SBA-16
载体及Ni-xFe/S16 催化剂的等温吸脱附曲线、孔结构及孔径分布见图6。等温线在相对压力(P/P0)较低的部分(P/P0=0~0.1)有稍微上升,说明在材料中存在少许的微孔;等温线在中间相对压力(P/P0=0.4~0.7)出现了回滞环,说明材料中存在介孔;等温线在相对压力较高的部分(P/P0=0.7~1.0)达到了吸附饱和,说明材料中没有大孔出现。所有曲线均呈现出具有H2型回滞环的典型的Ⅳ型等温线,说明材料中存在墨水瓶状孔,这是载体SBA-16 的特殊孔[12,37]。由孔径分布图也可以看出,载体SBA-16 在1~2 nm 处出现了微孔,并且主要的孔在6~7 nm,这与墨水瓶状孔的结构是一致的。当载体负载了金属以后,随着金属负载量的增加,催化剂的等温线类型及孔径分布图均与载体相似,并且载体的孔径大小几乎没有改变,说明金属的负载并不影响载体的孔道结构,因此金属的添加不会破坏分子筛的有序结构,并且金属颗粒并没有进入分子筛载体的孔道内。载体及催化剂的详细理化性质数据列于表1 中,从表中可以看出,随着金属含量的增加,催化剂的比表面积及孔容逐渐减小,这是由于不同金属含量的催化剂密度不同[38]。同时,催化剂中Ni 金属及Fe 金属的含量通过ICP-OES 测定,结果列在表1 中。从表中可以看出,Ni 金属及Fe 金属的实际含量稍低于理论值,很可能是浸渍法制备的催化剂中金属颗粒的不均匀分布造成的。

图6 由N2物理吸附脱附仪测得的载体及催化剂的孔道结构Fig.6 Pore structures of support and catalysts tested by N2-physical adsorption-desorption
2.2.2 催化剂金属颗粒尺寸 催化剂中Ni 金属分散度及由H2脉冲化学吸附估算得到的金属颗粒大小列于表1 中。从表中可以看出,随着Fe 含量的增加,Ni金属分散度及Ni金属比表面积呈现出先增加后降低的趋势,在Fe 含量为2%时达到最大(3.85%及2.89 m2/g)。同时,由H2脉冲化学吸附估算得到的金属颗粒大小呈现出相同的规律,说明Fe的加入能够在一定程度上促进Ni金属分散,减小金属颗粒尺寸。
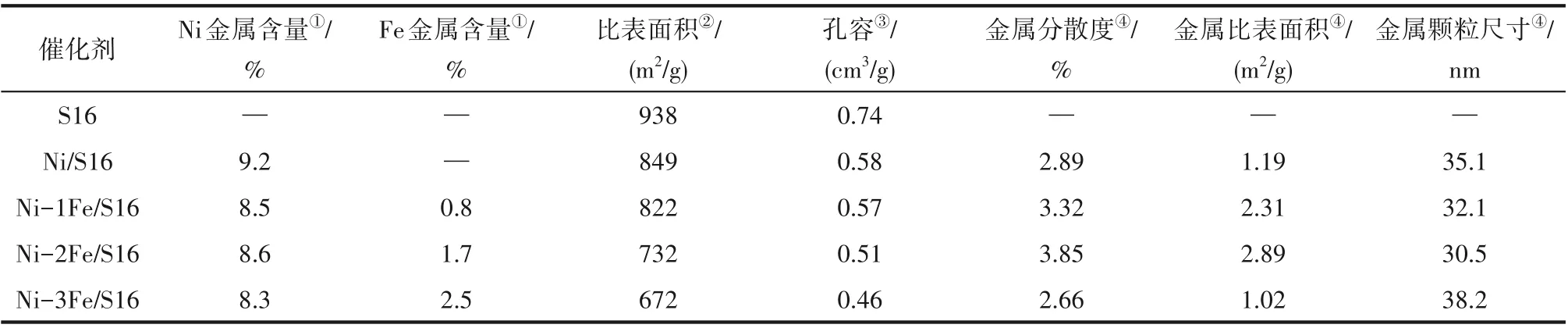
表1 载体及催化剂理化性质Table 1 Physical and chemical properties of support and catalyst
还原前NiO 颗粒的平均尺寸、还原后Ni 颗粒的平均尺寸以及反应后Ni 颗粒的平均尺寸采用广角XRD 通过Debye- Scherrer 方程计算,结果列于表2中。从中可以看出,Fe的添加能够减小Ni金属颗粒尺寸,并且随着Fe含量的增加,金属颗粒尺寸减小,说明第二金属的添加能够促进主金属的分散。此外,还原前NiO 颗粒的平均尺寸为22.2 nm,还原后Ni 颗粒尺寸增加为27.9 nm,反应后Ni 颗粒尺寸增加到30.1 nm,说明金属颗粒在没有第二金属存在时在还原过程及反应过程中均会团聚成较大的颗粒。当第二金属Fe 加入体系中与Ni 相互作用时,Ni 金属颗粒尺寸在还原过程及反应过程中没有发生明显的变化,说明第二金属Fe的加入能够抑制金属颗粒在还原过程及反应过程的团聚。XRD 计算结果与H2脉冲化学吸附测定的结果在Ni-xFe/S16 中Fe对Ni 颗粒团聚的抑制作用导致更高的Ni 金属分散度是一致的。

表2 金属Ni及其氧化物颗粒平均尺寸Table 2 The crystalline size of metal and its oxide
还原后及反应后催化剂中金属颗粒在载体上的分散情况通过TEM 来观察,结果如图7 和图8 所示。从还原后及反应后催化剂的TEM 图中可以看出,Ni 金属颗粒呈现出六方晶相(hexagonal centred phase,HCP),而当Fe 加入催化体系中,金属颗粒晶相不再是规整的六方晶相。此外,反应前Ni金属颗粒平均尺寸为50 nm,对Ni-1Fe/S16,Ni-2Fe/S16 和Ni-3Fe/S16,金属颗粒平均尺寸分别为35、30、40 nm,远小于Ni/S16 催化剂中金属颗粒尺寸,说明了Fe 的促进作用确实减小了金属颗粒尺寸。与XRD 结果稍有不同的是,Ni-3Fe/S16 中金属颗粒平均尺寸稍大于Ni-1Fe/S16 及Ni-2Fe/S16 中金属颗粒平均尺寸,这可能是过多Fe的加入遮掩了Ni的特征衍射峰,从而使得XRD 计算得到的金属颗粒尺寸偏小。从反应后催化剂的TEM 图中可以看出,Ni/S16 中金属颗粒平均尺寸增加到60 nm,而Ni-xFe/S16 催化剂中金属颗粒平均尺寸在反应前后变化不大,说明了Fe 的存在能够在一定程度上抑制金属颗粒的团聚。TEM 的结果与XRD 中Fe的加入可以抑制Ni 颗粒的团聚,使金属颗粒均匀分散的结果是一致的。总之,Ni3Fe 合金的形成抑制了Ni 颗粒的团聚,使得金属颗粒在载体上均匀分散。

图7 还原后催化剂的TEM图及金属颗粒尺寸分布Fig.7 TEM images and the particle size distribution of catalysts after reduction
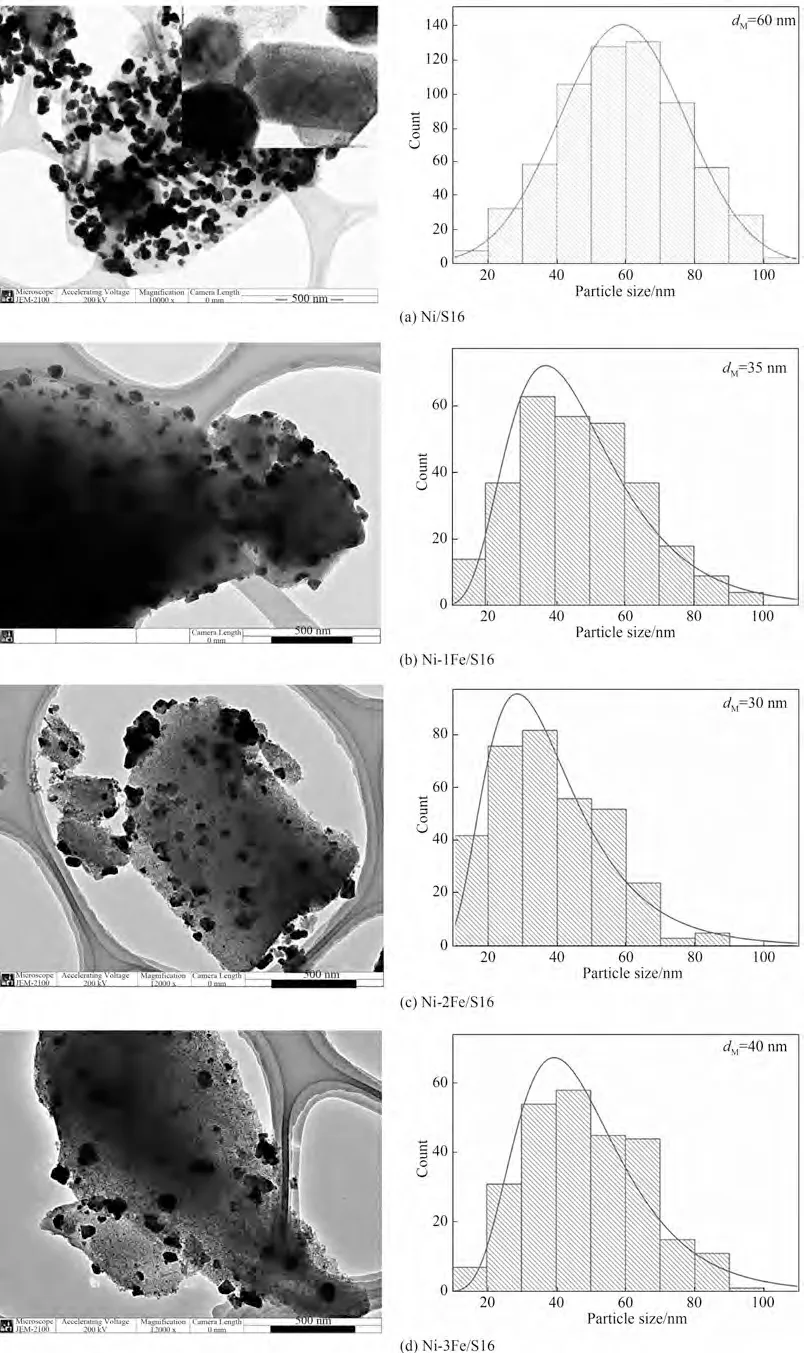
图8 反应后催化剂的TEM图及金属颗粒尺寸分布Fig.8 TEM images and the particle size distribution of catalysts after reaction
2.2.3 催化剂的还原性能及金属-载体相互作用
催化剂的还原性能、金属-载体的相互作用可以通过H2-TPR 表征,结果列于图9中。所有催化剂均呈现出两个还原峰,其中低温区(250~400℃)的还原峰归属于与载体相互作用较弱的NiO-Fe2O3还原为金属单质的峰,而在高温区(400~600℃)则属于具有强的金属-载体相互作用(SIMS)的NiO-Fe2O3的还原[39-42]。从H2-TPR 图中可以看出,与Ni/S16 催化剂相比,所有Ni-xFe/S16催化剂的两个还原峰均向高温区移动,说明了Fe的存在能够增强金属与载体之间的相互作用。同时,Ni金属与Fe金属之间强的相互作用也会增加金属还原的难度,导致金属还原温度的升高。H2-TPR 的分峰结果及由此计算出的金属在500℃的还原度列于表3 中。可以明显看出,Ni/S16催化剂中低温还原峰的面积比Ni-xFe/S16催化剂中要高,并且Ni-2Fe/S16 催化剂的低温还原峰面积占比最小,高温还原峰面积占比最大。同时,Ni/S16催化剂在500℃时有超过96%的金属氧化物被还原,然而当Fe加入后,Ni-xFe/S16催化剂在500℃时的还原度降低,并且Ni-2Fe/S16 催化剂具有最低的金属还原度(68.0%)。H2-TPR 的结果表明,Fe 的加入增强了金属-载体相互作用,降低了金属还原度。

图9 催化剂的H2-TPR图Fig.9 H2-TPR profiles of catalysts

表3 催化剂的H2-TPR 分峰分析结果Table 3 The peak analysis result of H2-TPR of catalysts
2.3 Fe助剂对催化剂性能的影响
2.3.1 催化剂活性表征 Ni-xFe/S16 催化剂在200~300℃对CO 甲烷化的催化性能见图10。从图中可以看出,CO 转化率及CH4收率呈现出随温度升高而增加的趋势。Ni/S16 及Ni-3Fe/S16 催化剂的CO 最低完全转化温度为300°C,而Ni-2Fe/S16 催化剂的CO 最低完全转化温度降低至250℃,因此可以看出,Ni3Fe 合金的形成可以促进CO 甲烷化在较低温度下的活性。然而,当催化剂中Fe 的加入量过多时(3%),在反应条件下Ni 保持金属单质态或者以Ni3Fe 合金的形式存在,但多余的Fe 则是处于部分氧化的状态,而Fe 氧化物的存在能够降低表面CO 的吸附能,导致CO 更容易脱附而不是随后的甲烷化[26]。因此,适量Fe 的存在能够大幅度降低CO 甲烷化的最低完全转化温度。
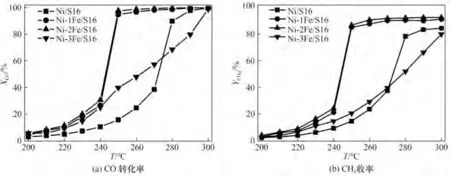
图10 Ni-xFe/S16催化剂的催化活性Fig.10 Catalytic performance of Ni-xFe/S16 catalysts
图11(a)、(b)呈现了Ni-xFe/S16 催化剂CO 甲烷化在240和300℃时的产物分布。可以看出,在较低温度下(240℃),C2~C4副产物的量高于CO2的量,而在较高温度下(300℃),副产物中主要为CO2,几乎无C2~C4产物。在较低的温度下,CO 的解离是甲烷化反应的控速步骤,根据著名的火山形曲线[43-44]可以得知,Fe 在火山形曲线的顶端而具有更好的解离CO 的能力,因此Fe的存在能够促进CO 的解离脱附,形成活性C*和O,其中O 可以与吸附的CO 结合形成CO2,而C*通过加氢形成CH4,或者通过碳碳偶联形成C2~C4产物。然而,在较低温度下通过碳碳偶联形成C2~C4产物的活化能低于CO与O结合形成CO2的活化能,造成较多的C2~C4产物[9]。当温度升高时,Fe 氧化物的存在加速了CO 的脱附,CO 与O结合形成CO2的活化能降低,造成CO2的量高于C2~C4产物。因此,适量Fe 的加入能够提高CO 甲烷化反应中CO 的转化率,而不能提高产物CH4的选择性。
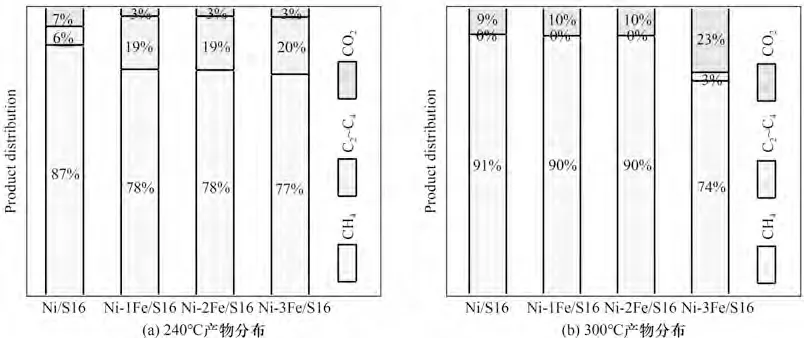
图11 Ni-xFe/S16催化剂在不同温度下CO甲烷化产物分布Fig.11 CO methanation product distribution of Ni-xFe/S16 at different temperatures
2.3.2 催化剂对反应气体吸附解离 为了更好地解释Fe 的加入对甲烷化反应的促进性能,催化剂对反应气体(CO 和H2)的吸附解离性能通过H2-TPD 和CO-TPD 来测定,结果见图12,催化剂对H2和CO 的吸附量列于表4 中。从H2-TPD 图可以看出,所有催化剂均出现两个脱附峰,其中第一个脱附峰出现在300℃之前,第二个脱附峰出现在800℃左右,300℃之前的脱附峰属于吸附在具有较大密度表面缺陷的高分散金属纳米颗粒上的H2,一般作为表面氢扩散的重要途径,可以降低氢解离的活化能[45-46]。而在800°C 左右的脱附峰归于吸附在底层金属原子上的H2或者从金属到金属或从金属到载体的氢溢流[47-49]。从催化剂对氢气的吸附量来看,当没有Fe 存在时,Ni/S16催化剂对氢气的总吸附量仅为0.179 cm3/g,当Fe加入后,Ni-xFe/S16 催化剂的H2-TPD 峰强度剧烈增加,并且总的吸附量是Ni/S16 催化剂的2~3 倍,说明了Fe 的存在能够促进催化剂对H2的吸附解离。Fe 的加入形成了Ni3Fe 合金,因此H2吸附量的增加是由于Ni3Fe 合金的形成。在CO 甲烷化反应中,除了CHx物种的加氢外,CO 的解离也是反应的控速步骤[50-51],因此选择CO-TPD 来表征催化剂对CO 的吸附-解离性能。从CO-TPD 的谱图来看,在Ni/S16 催化剂中,在77、223 和602℃出现了三个CO 脱附峰,其中低温还原峰(77℃)属于具有较低活化能的单层化学吸附的CO[3,52]。较高温度的脱附峰(223 及602℃)代表桥键吸附在双位点上具有较高活化能的CO[52]。当Fe 加入后,低温脱附峰的强度剧烈增加,意味着Fe 的加入增加了具有较低活化能的单层吸附的CO,这点也在计算得到的CO 吸附量结果中得到证实。通过计算得出的H2消耗量及CO 消耗量在300℃之前的面积占比列于表4 中。从表中结果可以看出,在300℃之前H2消耗峰面积占比没有明显区别,但当Fe 含量增加时,CO 消耗量在300℃之前的面积占比增加,当Fe 含量为2%时达最大(70.3%)。然而当Fe 含量过多时(3%),催化剂对CO 的吸附解离能力减弱,说明了适量Fe 的增加能够促进催化剂对反应气体(H2和CO)的吸附解离。结合XPS 结果可知,Ni 与Fe 之间的电子转移增强了Fe 周围的电子云密度,然后电子被反馈给吸附的分子态CO 的反键π*轨道,增强了Fe—C 键,减弱了C—O键,促进了CO 的解离,进而提高了Ni-xFe/S16 催化剂在CO甲烷化中的活性。

图12 催化剂对反应气体的吸附解离Fig.12 Adsorption-dissociation profiles for reactant gas of catalysts

表4 催化剂吸附的H2和CO量Table 4 The absorbed H2 and CO quantity of catalyst
2.4 Ni-Fe/S16双金属催化剂的构-效关系
由以上表征可知,Fe的加入能够与Ni形成Ni3Fe合金,减小了金属颗粒尺寸,使催化剂具有较高的活性;此外Ni3Fe合金的形成增强了金属与载体之间的相互作用力,抑制了金属颗粒在还原过程及反应过程中的团聚,保持较高的活性;最后,Ni3Fe合金的形成促进了反应气体CO和H2的解离,从而提高了催化剂在较低温度下的CO甲烷化反应中CO的转化率。在较低的温度下,由于碳碳偶联的活化能低于CO2形成的活化能导致有较多的C2~C4副产物;而在温度较高时,CO2形成的活化能低于碳碳偶联的活化能,因而副产物几乎全部为CO2。由此得到Ni-Fe/S16双金属催化剂构-效关系,如图13所示。
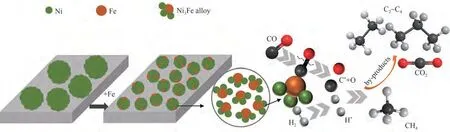
图13 Ni-xFe/S16催化剂的构-效关系示意图Fig.13 Schematic diagram of the structure-performance relationship of Ni-Fe/S16 catalyst
3 结 论
(1)对催化剂的XPS、XRD、HRTEM 和EDSmapping表征说明,Fe的加入与Ni形成了Ni3Fe合金。
(2)N2物理吸附表征说明,金属的负载并没有改变介孔分子筛的有序孔道结构。H2脉冲化学吸附测试、XRD 分析及TEM 观察表明,Fe 的加入减小了金属颗粒,增强了金属与载体之间的相互作用力,因而能够在一定程度上抑制还原过程及反应过程中金属颗粒的团聚现象。
(3)H2-TPD 及CO-TPD 实验证明了Fe 的加入能够促进催化剂对反应气体的吸附解离,从而提高催化剂的活性。当Ni与Fe 的质量比为10∶2 时催化活性达到最佳,在空速为150000 h-1、H2/CO=3∶1 时,CO 最低完全转化温度可以降低到250°C。在较低的温度下(240°C),有较多的C2~C4副产物,而温度较高时(300°C)副产物则几乎全部为CO2。
(4)在设计和制备双金属催化剂时,两种金属的含量要控制在一定的比例范围内才能达到最佳的催化效果。
符 号 说 明
FCn,out——Cn输出的物质的量,mol
FCH4,out——甲烷输出的物质的量,mol
FCO,in——一氧化碳输入的物质的量,mol
FCO,out——一氧化碳输出的物质的量,mol
FCO2,out——二氧化碳输出的物质的量,mol
SC2~C4——C2~C4选择性,%
SCH4——甲烷选择性,%
SCO2——二氧化碳选择性,%
T——温度,°C
XCO——一氧化碳转化率,%
YCH4——甲烷收率,%

