肝癌血清炎症指标及影像特征与病理分级的相关性研究
刘永倩, 赵新湘
肝细胞癌(Hepatocellular carcinoma,HCC)是成年人最常见的原发性肝癌,约占所有肝癌的80%,也是全球第六大最常见肿瘤,估计每年有78.2万新发病例[1],也是导致癌症相关死亡的第三大原因[2-3],HCC患者的生存率普遍较低,总体5年生存率<15%。肝切除仍是HCC治疗的主要手段,术后5年生存率为40%~70%,但HCC即使在根治性肝切除术后,仍有70%的高复发率[4]。组织病理学的分化程度被认为是肿瘤组织学特征的最重要预后因素之一,HCC病理分化程度是影响患者术后复发、治疗方案选择及生存预后的重要因素[5-6]。低分化、高-中分化HCC的治疗及预后不同[5-6],高-中分化者多采用根治性肝切除及肝移植,预后较好;低分化者采用局部治疗、放疗及全身治疗等,预后较差。近年来的研究表明,HCC的进展和预后不仅与肿瘤的特征有关,还与宿主的炎症反应有关[5],特别是肿瘤微环境中的局部炎症,被认为参与了肿瘤的发生和进展,HCC已被证明是一种炎症性癌症[7],其炎症反应可以通过抑制细胞凋亡、促进血管生成和破坏DNA来影响肿瘤的发展[8]。在巨块型HCC中,炎症尤其强烈,可致肿瘤在肝内快速增殖、扩散和转移[7]。国内外目前有少量研究利用血清炎症指标探讨其与HCC术后生存预后的关系[9],并对肝细胞癌微血管侵犯进行预测[10],但将血清炎症指标联合肿瘤影像特征应用于HCC病理分级预测的研究尚未见报道。本研究通过分析血清炎症指标及肿瘤影像特征与HCC病理分级的相关性,旨在探讨其预测HCC病理分级的可行性及诊断效能。
材料与方法
1.病例资料
搜集昆明医科大学第二附属医院肝胆科2017年3月到2019年6月行肝癌切除术的患者150例,其中男135例,女15例,中位年龄为55岁,平均年龄为(54.20±0.89)岁。病例纳入标准:①行肝癌切除术;②术前1周内做血常规、血生化检查,行MRI平扫及增强扫描;③病理证实为HCC并按照Edmondson分级法进行病理分级。病例排除标准:①临床及病理资料不完整;②既往服用消炎药或患有慢性炎症疾病(包括白细胞减少症或白细胞增多症);③接受术前抗肿瘤治疗。
根据肝癌细胞的分化程度、核/质比、肿瘤细胞核的异型性程度,按照Edmondson病理分级标准,Ⅰ-Ⅱ级为中-高分化,Ⅲ-Ⅳ级为低分化。血清炎症因子包括碱性磷酸酶/淋巴细胞计数(alkaline phosphatase-to-lymphocyte ratio,ALR)、中性粒细胞计数/淋巴细胞计数(neutrophil-to-lymphocyte ratio,NLR)、血小板计数/淋巴细胞计数(platelet-to-lymphocyte ratio,PLR)、天冬氨酸转氨酶/血小板计数( aspartate aminotransferase to platelet count ratio index,APRI)。
2.检查方法
MRI检查采用Siemens Sonato 1.5T MRI超导磁共振仪(梯度磁场为40T,切换率为200 mT/ms)。扫描序列包括稳态进动快速成像(Ture FISP)冠状面T2WI、半傅立叶单激发快速自旋回波(HASTE)横轴面T2WI 、快速小倾倒角成像(FLASH) T1WI抑脂横轴面及FLASH同反相位(in-out phase)横轴面;动态增强扫描采用容积内插3D(volumetric interpolated breath-hold examination,3D-VIBE)快速GRE-T1WI序列。T2WI序列扫描参数:TR 900 ms,TE 93 ms,视野340 mm×340 mm,层厚8 mm,翻转角10°;T1WI增强序列扫描参数:TR 4.78 ms,TE 2.24 ms,视野380 mm×380 mm,层厚5 mm ,翻转角10°。
3.分组
记录患者的各项指标(患者一般资料、术前血清炎症指标及影像学特征),按肿瘤Edmondson病理分级分为低分化(Ⅲ-Ⅳ级)、中-高分化(Ⅰ-Ⅱ级)两组。根据病变范围(局限于一叶和超过一叶)、包膜(完整与否)、有无瘤内出血及坏死、有无大血管侵犯和卫星结节、肿瘤数量(1个或≥2个)和生长模式(肝内或外)进行统计分析。
4.统计学分析
采用SPSS 26.0软件进行统计学分析。不满足正态分布的计量资料以M(Q25,Q75)表示,组间比较采用非参数Mann-WhitneyU秩和检验;计数资料以率或构成比表示,组间比较采用Pearson卡方检验或Fisher精确检验。患者血清炎症指标及影像学特征在不同肝癌病理分级之间的差异性比较采用单因素非参数Mann-WhitneyU秩和检验、Pearson卡方检验和Fisher精确检验;采用Spearman秩相关分析患者血清炎症指标及影像学特征与病理分级之间的相关性。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,分别获取单指标鉴别诊断低分化与高-中分化HCC的最佳临界值及其敏感度、特异度,构建联合诊断的logistic回归模型,并计算多指标联合的预测概率,以预测概率描绘ROC曲线,计算曲线下面积(area under curve,AUC),评估其预测肝癌病理分级情况的效能。以P<0.05为差异有统计学意义。
结 果
1.肝癌病理分级的单因素分析
采用非参数Mann-WhitneyU秩和检验、Pearson卡方检验和Fisher精确检验对低分化与中-高分化两组患者的血清炎症指标及影像学特征进行组间比较,结果显示两组患者在ALR、NLR、APRI、肿瘤长径、肝叶受累范围、瘤内坏死、卫星结节、数量、包膜等方面差异有统计学意义(P<0.05,图1、2),在PLR、瘤内出血、大血管侵犯、生长模式上差异无统计学意义(P值均>0.05,表1)。
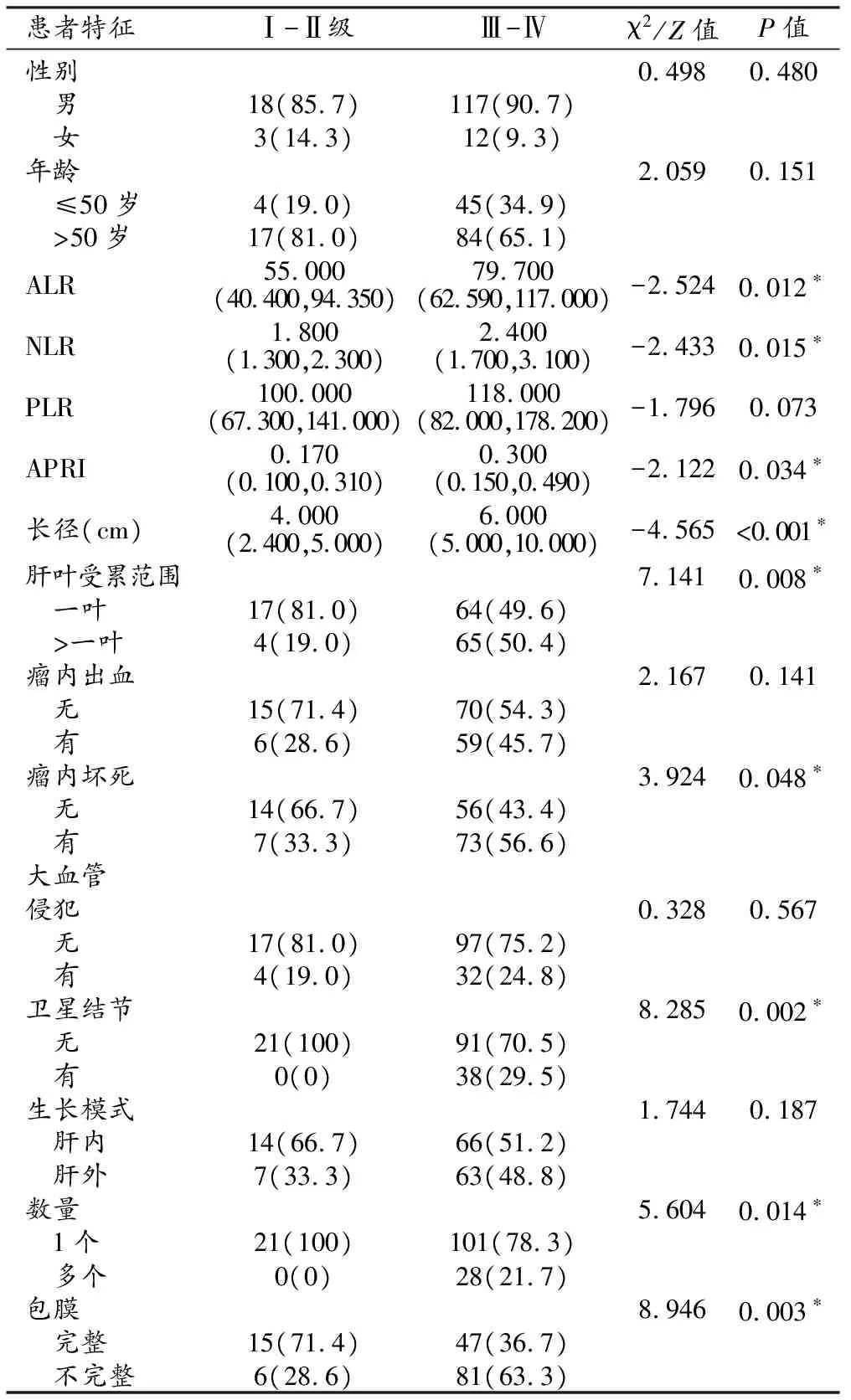
表1 两组患者血清炎症指标及影像学特征比较 (n,%)
2.肝癌病理分级的Spearman秩相关分析
Spearman秩相关分析结果显示,ALR(r=0.207,P=0.011)、NLR(r=0.199,P=0.014)、APRI(r=0.174,P=0.033)、肿瘤长径(r=0.374,P=0.000)、包膜(r=0.245,P=0.003)、卫星结节(r=0.235,P=0.004)、肝叶受累范围(r=0.218,P=0.007)、肿瘤数量(r=0.193,P=0.018)、瘤内坏死(r=0.162,P=0.048)分别与不同病理分级间呈正相关(表2)。
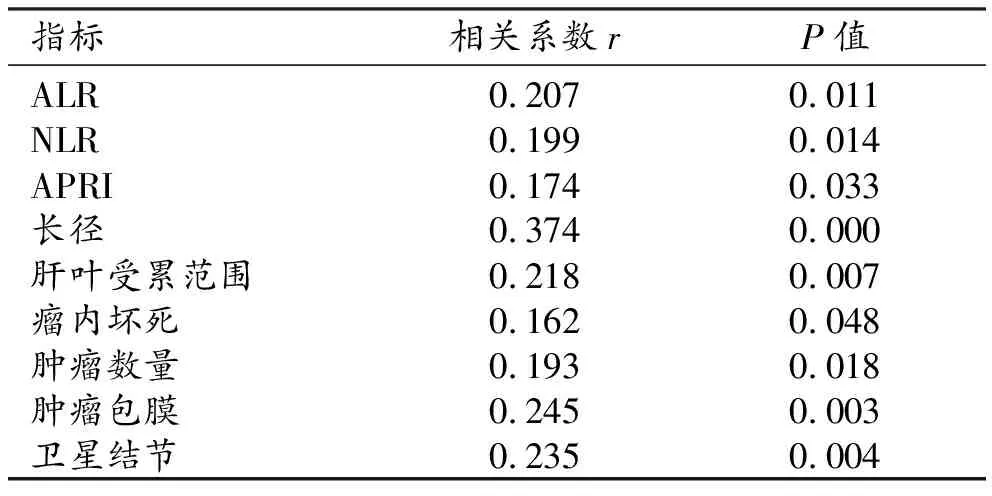
表2 肝癌病理分级的相关性分析
3.ROC曲线分析结果
ROC曲线分析结果显示,肿瘤长径的最佳截断值为5.2 cm,其AUC为0.810,95%置信区间为0.722~0.898 (P=0.000),即最大直径>5.2 cm时可预测肿瘤病理分级为低分化(Ⅲ-Ⅳ级),此时诊断敏感度为62.0%,特异度为85.7%。ALR的最佳截断值为63.6,其AUC为0.672,95%置信区间为0.550~0.794 (P=0.012),即ALR>63.6时可预测肿瘤病理分级为低分化(Ⅲ-Ⅳ级),此时诊断敏感度为74.4%,特异度为66.7%。NLR的最佳截断值为2.22,其AUC为0.666,95%置信区间为0.544~0.788 (P=0.015),即NLR>2.22时可预测肿瘤病理分级为低分化(Ⅲ-Ⅳ级),此时诊断敏感度为59.7%,特异度为76.2%。APRI的最佳截断值为0.19,其AUC为0.644,95%置信区间为0.517~0.771 (P=0.034),即APRI>0.19时可预测肿瘤病理分级为低分化(Ⅲ-Ⅳ级),此时诊断敏感度为70.5%,特异度为66.7%。多指标联合诊断的ROC分析结果显示,其AUC为0.825,95%置信区间为0.742~0.909 (P=0.000),敏感度为76%,特异度为76.2%(图3)。
讨 论
1.血清炎症指标与HCC病理分级的相关性
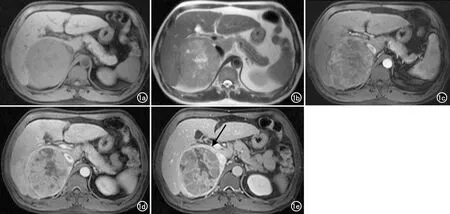
(>0.19)。a)T1WI图像;b)T2WI图像;c)增强扫描动脉期图像;d)增强扫描门脉期图像;e)增强扫描延迟期图像示包膜不完整(箭)。
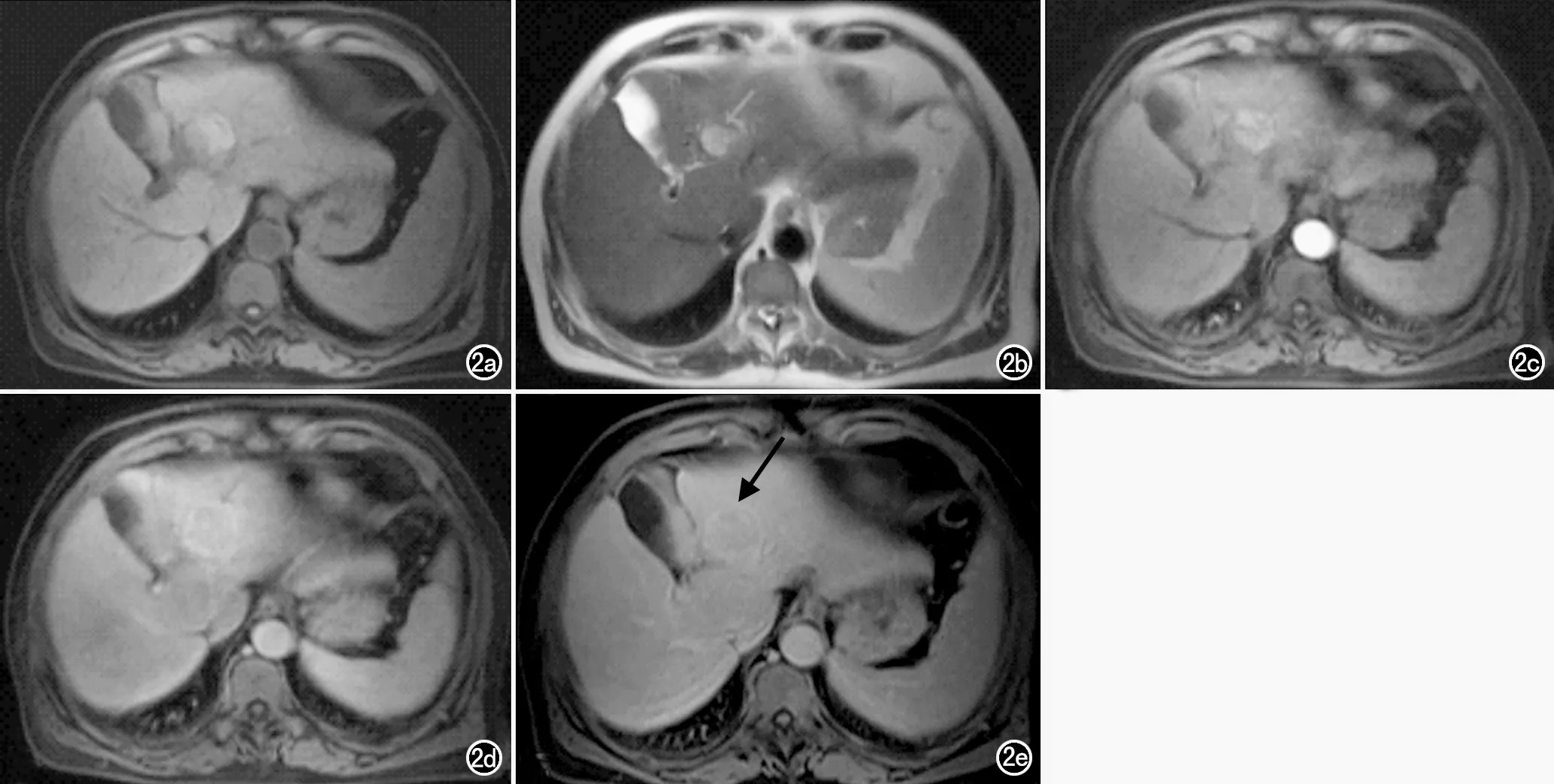
b)T2WI图像;c)增强扫描动脉期图像;d)增强扫描门脉期图像;e)增强扫描延迟期图像示包膜完整(箭)。

图3 各指标鉴别诊断低分化与中-高分化 HCC的ROC曲线。
NLR与HCC病理分级的相关性:在全身炎症反应中,中性粒细胞和淋巴细胞都是白细胞的重要组成部分,很多研究表明它们是肿瘤转移的关键参与者。中性粒细胞维持肿瘤微环境,促进肿瘤细胞侵袭转移、血管生成和细胞外基质重构[9]。淋巴细胞作为免疫系统的重要组成部分,具有强大的抗肿瘤特性。一方面,肝脏富含天然杀伤(natural killer,NK)细胞和NKT细胞,这两种细胞是固有免疫系统的主要群体,具有抗肿瘤功能,故当肝脏发生病变时淋巴细胞含量降低[11-12]。有报道称肿瘤边缘CD4+ T淋巴细胞的浸润增多与术后低复发率和更好的预后相关[13]。故NLR值(中性粒细胞-淋巴细胞比)的升高预示肿瘤的不良预后。本研究结果显示NLR值与HCC病理分级呈正相关,但相关性较弱(相关系数为0.199),且NLR预测病理分级为低分化(Ⅲ-Ⅳ级)的最佳截断值为2.22,这与Ji等[8]的研究结果相似,其得出术前NLR预测术后复发的最佳截断值为2,NLR>2是影响术后无复发生存(recurrence-free survival,RFS)的独立预测因子[8],但本研究中AUC为0.666,诊断效能较低,表明该指标预测肝癌病理分级的价值有限。
PLR与HCC病理分级的相关性:大量研究表明血小板是炎症反应的参与者,可以保护肿瘤细胞免受自然杀伤介导的裂解,从而促进肿瘤转移。此外,血小板源性生长因子、碱性成纤维细胞生长因子和肝细胞生长因子也可增强肿瘤细胞的转移能力[13]。活化的血小板可释放炎症介质,在炎症反应过程中促进白细胞募集和组织浸润,血小板来源的核苷酸可通过P2Y2受体促进肿瘤细胞的跨上皮迁移和转移[7],因此是一个强有力的肿瘤炎症相关生物标志物。故PLR值(血小板-淋巴细胞比)的升高预示肿瘤的不良预后;然而本研究结果显示PLR升高与肿瘤病理分级(Ⅲ-Ⅳ级)无相关性,这与Ma等[13]的研究结果一致。
APRI与HCC病理分级的相关性:肝功能对肝切除术后HCC患者的预后起着重要作用,血清肝酶活性指标如ALT、AST、GGT、ALP等可反映肝功能。血清AST作为反映肝功能损害的常用指标,可反映肝纤维化或肝硬化程度。由于肝纤维化和肝硬化是HCC发展的重要危险因素,故APRI(AST-血小板比)也被认为是HCC切除术后患者生存的独立预后因素[14]。Shen等[14]发现血小板炎症指数升高尤其是APRI升高与HCC的不良预后相关,即APRI大于0.62预示预后不良。另有研究报道APRI为HCC肝切除术后肝衰竭(posthepatectomy liver failure,PHLF)的预测因子,APRI大于0.55为PHLF高风险组,且较Child-Pugh、终末期肝病模型(The model for end-stage liver disease,MELD)或白蛋白-胆红素 (Albumin-Bilirubin,ALBI)评分对PHLF的预测更准确[15]。有学者提出APRI是反映肝功能或免疫状况的血清学指标,其与肝脏组织病理学有很强的相关性[16]。本研究结果显示APRI值与HCC病理分级呈正相关,但相关性较弱(相关系数为0.174);其预测HCC病理分级(Ⅲ-Ⅳ级)的最佳截断值为APRI>0.19,但其AUC为0.644,诊断效能较低,该指标可作为预测肝癌病理分级的参考。
ALR与HCC病理分级的相关性:ALP是一种磷酸单酯水解酶,主要分布在肝脏和骨骼中,相关研究表明HCC癌细胞的核仁具备很高的ALP活性,即ALP可通过调节细胞周期和细胞增殖来促进肿瘤的形成[11]。 Piras-Straub等[12]发现ALP升高可能与HCC患者更严重的炎症反应有关,可作为预测高危HCC患者复发的有力预后指标。Sun等[11]也提出ALP可作为HCC预后的生物标志物。本研究进一步假设ALR值(ALP-淋巴细胞比)的升高预示肿瘤的不良预后即较差的病理分级,研究结果显示ALR的升高与HCC病理分级呈正相关,但相关性较弱(相关系数为0.207);其预测HCC病理分级(Ⅲ-Ⅳ级)的最佳截断值为ALR>63.6,但其AUC为0.672,诊断效能较低,故对肝癌病理分级的预测该指标可作为参考。
2.影像特征与HCC病理分级的相关性
肿瘤的生物学特征之一就是肿瘤大小,它从另一方面反映了肿瘤的负荷和生长速度,生长速度越快,其恶性程度越高,这可能与较大的肿瘤更容易发生肝内转移和血管浸润有关[17]。有研究显示肿瘤大小与病理分级无相关性[18]。本研究结果显示肿瘤长径与HCC病理分级呈显著相关性,且长径>5.2cm可预测肿瘤病理分级为低分化(Ⅲ-Ⅳ级)。
相关文献报道肝脏受累范围越大,肿瘤病理分级越高,因肿瘤越大易向肝外生长,可出现侵袭或转移的倾向[18]。本研究发现肝叶受累范围越大与高病理分级相关,但相关性较弱(相关系数为0.218),故肝叶受累范围对肝癌高病理分级有一定提示作用。
包膜是HCC的重要征象之一,分化程度高的恶性肿瘤多为膨胀性生长,其生长速度较慢,较易对周围正常肝组织产生压迫而形成假包膜;而分化程度低者多为浸润生长,生长速度较快,较难形成假包膜,也有可能是肿瘤早期有完整包膜,但随着恶性程度的增加及肿瘤体积的增大,其本身完整的包膜可能会变得不完整[17]。本研究发现包膜的完整与否与HCC病理分级相关,进一步证实了HCC的包膜征象可反映肿瘤病理分级情况。
关于卫星结节,Wang等[2]发现主肿瘤外生长的单发结节型和由一簇小结节组成相邻多结节型是HCC术后预后的重要独立危险因素;Shen等[19]也发现病灶卫星结节越多,肿瘤分化越差,即主肿瘤周围的卫星结节越多,表示肿瘤已发生微小血管的浸润,代表其高恶性程度,即高病理分级。有研究称卫星结节的存在是HCC高病理分级的重要独立预测因素[20]。本研究也发现肿瘤周围有卫星结节与HCC高病理分级相关。
肿瘤数量越多可反映沉重的肿瘤负担,是多个独立肿瘤(兄弟型)多中心起源的结果[2]。Shen等[19]提出肿瘤数量>3为不良预后的危险因素。本研究发现肿瘤数量多与HCC高病理分级相关,但相关性较弱(相关系数为0.193),故肿瘤数量可作为提示肝癌高病理分级的参考。
瘤内坏死主要是由于肿瘤生长速度快, 导致瘤内血供不足[17]。有瘤内坏死者通常提示肿瘤细胞的低分化程度和高增殖活性,即较高的肿瘤分级。肿瘤坏死同时还可释放大量炎性因子促进肿瘤生长、浸润转移。本研究发现有瘤内坏死者与HCC高病理分级相关,但相关性较弱(相关系数为0.162),故HCC合并坏死可能提示肿瘤有较强的瘤内异质性和侵袭转移潜能,预示较差的预后[18]。
本研究存在以下局限性:首先,本研究为回顾性研究,且研究样本量相对较小;其次,笔者将病理分级Ⅰ-Ⅱ级归入高-中分化组,Ⅲ-Ⅳ级级归入低分化组,这对最终的研究结果可能也会造成部分偏倚;最后,本研究中部分肝癌病理分级的Spearman相关分析的统计量偏低,单指标预测ROC曲线的AUC值偏小,造成这种结果的原因可能与本研究的样本量及研究变量有关,由于血清炎症因子确实与肝癌病理分级相关,故需要未来的大量研究来进一步证实其相关性的强弱。
综上所述,单个临床指标对肝癌病理分级的预测价值有限,多指标联合的诊断效能明显优于单一指标,故联合血清炎症指标NLR、APRI、ALR及影像特征对预测HCC病理分级有一定可行性,所以在临床中需结合多个指标来提高其临床诊断的可靠性。因此,在实际工作中不仅要对影像特征进行分析,还需结合患者的临床实验室检查,这将有助于我们对HCC癌更精准的认知,辅助个性化、更准确的治疗方案的制定。

