犬细小病毒、犬腺病毒Ⅰ型和犬腺病毒Ⅱ型三联PCR诊断方法的建立
于永乐,王吉贵,苏 俊,杨双双,刘 莹,李沛然,李兆达,刘维全*
(1.青岛农业大学 动物医学院,山东 青岛 266109;2.中国农业大学 生物学院 农业生物技术国家重点实验室,北京 100193)
犬细小病毒病是由犬细小病毒(canine parvovirus,CPV)引起的一种急性、高度接触性病毒性的传染病,临床上以出血性肠炎和化脓性心肌炎为特征[1]。CPV最早于1978年从患出血性肠炎的犬中被分离得到,是从临床病犬中分离的第2种细小病毒(canine parvovirus type 2,CPV-2),目前普遍认为CPV-2是猫细小病毒(feline parvovirus,FPV)的遗传变种[2-3]。新型CPV-2变异毒株CPV-2a和CPV-2b毒株已成为优势毒株,在我国广泛流行。近年来,CPV-2c逐渐被分离得到,而且其感染宿主范围不断扩大,急需开展广泛的流行病学调查[4-6]。
犬腺病毒(canine adenovirus,CAV)依据其血凝结果和中和试验等差异,可划分为CAV-Ⅰ和 CAV-Ⅱ 2个常见亚型,其中CAV-Ⅰ感染常导致犬传染性肝炎(ICH)的发生,临床上以神经系统症状、黄疸、坏死性肝炎、弥散性血管内凝血和血管炎为主要表现,还会导致非化脓性脑炎和肾小球肾炎出现[7-9];CAV-Ⅱ可引起传染性喉气管炎和肠炎,感染了CAV-Ⅱ的犬通常表现出持续的高烧、咳嗽,并伴随有其他临床表现,如扁桃体炎、喉气管炎、肺炎、呕吐和腹泻,是引起犬病毒性肠炎的主要病原体之一[10-11]。
目前CPV、CAV-Ⅰ和 CAV-Ⅱ在临床上混合感染严重,单靠常规的临床和实验室诊断技术难以快速、准确的作出鉴别诊断,急需要建立新的快速、简便、特异的诊断技术,以提供临床或实验室使用。对于上述3种病毒的单项PCR检测方法已分别被成功建立且应用,但二联和三联PCR检测方法由于反应组分更加复杂,反应体系优化难度增大,一直难以建立和良好应用。本研究通过特异性引物设计,优化各种PCR扩增条件,建立一种针对犬源DNA病毒(细小病毒、腺病毒Ⅰ型和Ⅱ型)的多联PCR诊断技术,为临床实践或实验室鉴别诊断,提供可靠的检测技术。
1 材料与方法
1.1 标准毒株CPV-BJ、CAV-Ⅰ、CAV-Ⅱ、犬瘟热病毒(CDV)及犬副流感病毒(CPIV)由本室分离保存。
1.2 临床病料送检的病料为来自北京某地养殖场发病犬肛拭子,共计20份。按照1∶9的比例加入灭菌PBS缓冲液充分振荡溶解,5 000 r/min 离心5 min,取上清液置于-20℃冰箱备用。
1.3 试剂DL2000 DNA Marker 购自北京索莱宝生物科技有限公司;2×PrimeStar Max Premix购自宝生物工程(大连)有限公司;GenElute胶回收试剂盒购自Sigma公司;质粒小提中量提取试剂盒购自北京庄盟国际生物基因科技有限公司。
1.4 三联PCR引物设计与合成根据GenBank已发表的CPV(CPV-2、CPV-2a、CPV-2b和CPV-2c)、CAV-Ⅰ和CAV-Ⅱ基因组序列,选择CPV VP2和CAV E3区高同源序列,利用Primer Primier 5.0软件,设计2对三联PCR引物并由北京三博远志生物技术有限责任公司合成,引物序列如下:
CPV为P1:GTAAGCTTCCAGGAGACTTT,P2:GTAAGCTTCGTCGTGTTCTT;
CAV为P3:CGCGCTGAACATTACTACCTTGTC,P4:CTTCGTGTCCGCTTCATG。
上述引物扩增目的片段大小分别为670 bp(CPV)、497 bp(CAV-Ⅰ)和1 019 bp(CAV-Ⅱ)。
1.5 病毒DNA模板制备方法分别将2种病毒的病毒悬液或者临床病料300 μL置于离心管中,沸水浴 10 min 后,迅速冰浴2 min,然后用微量离心机于室温以 8 500 r/min 离心6 min,吸取上清液用于后续PCR反应。
1.6 PCR扩增方法的建立及优化利用1.5的方法分别提取CPV、CAV-Ⅰ和CAV-Ⅱ病毒培养物的病毒总DNA,置于-20℃冰箱备用。所有PCR反应总体积为25 μL,其中2×primeStar Max Premix(TaKaRa)12.5 μL,不同引物终浓度(0.12,0.16,0.20,0.24 μmol/L),病毒基因组模板1 μL,ddH2O 10.5 μL。PCR条件为98℃预变性1 min;98℃变性10 s,不同退火温度(52,54,56,58,60℃)退火10 s,72℃延伸10 s,30个循环;72℃延伸1 min。取6 μL PCR扩增产物在2.0%的琼脂糖凝胶上进行电泳,观察照相。
1.7 CPV、CAV-Ⅰ和CAV-Ⅱ各单项PCR方法的建立按照1.6的方法分别建立CPV、CAV-Ⅰ和CAV-Ⅱ的单项PCR扩增方法,确定其最适引物浓度和退火温度,在此基础上,对各单项PCR的特异性和敏感性进行检测,并对所有扩增产物进行胶回收,目的片段送公司测序验证。
1.8 CPV、CAV-Ⅰ和CPV、CAV-Ⅱ二联PCR方法的建立按照1.7的方法分别建立上述对于CPV和CAV-Ⅰ二联PCR与CPV和CAV- Ⅱ二联PCR方法,并对二联PCR方法的重复性和特异性进行检测,并对所有扩增产物进行胶回收,目的片段送公司测序验证。
1.9 三联PCR扩增试验在三联PCR反应体系中,各病毒引物终浓度分别为CPV 0.20 μmol/L,CAV-Ⅰ 和CAV- Ⅱ 各0.20 μmol/L。三联PCR反应条件与二联PCR保持一致,分别对上述病毒的DNA模板进行检测。
1.10 三联PCR重复性试验按照1.8的方法,进行三联PCR重复性检测。
1.11 三联PCR特异性试验将3种不同的三联PCR产物分别回收后,送公司测序并分析;对CDV北京株、CPIV北京株及MDCK细胞等进行PCR扩增。
1.12 三联PCR敏感性试验将CPV、CAV-Ⅰ与CAV- Ⅱ的原倍10-1,10-2,10-3,10-4,10-5倍稀释度的DNA模板组合,进行三联PCR灵敏度检测。
1.13 三联PCR对送检病料的检测利用已建立的三联PCR对送检的20份病料进行检测,并与单项PCR检测结果进行比较分析。
2 结果
2.1 CPV、CAV-Ⅰ和CAV- Ⅱ单项PCR的建立结果由图1可见,以1.6的方法分别以CPV、CAV-Ⅰ和CAV- Ⅱ进行单项PCR扩增试验,结果扩增片段与目的片段的大小完全一致。经测序证实,所有扩增的片段与CPV、CAV-Ⅰ和CAV- Ⅱ相应基因序列高度一致,同源性高达99%。
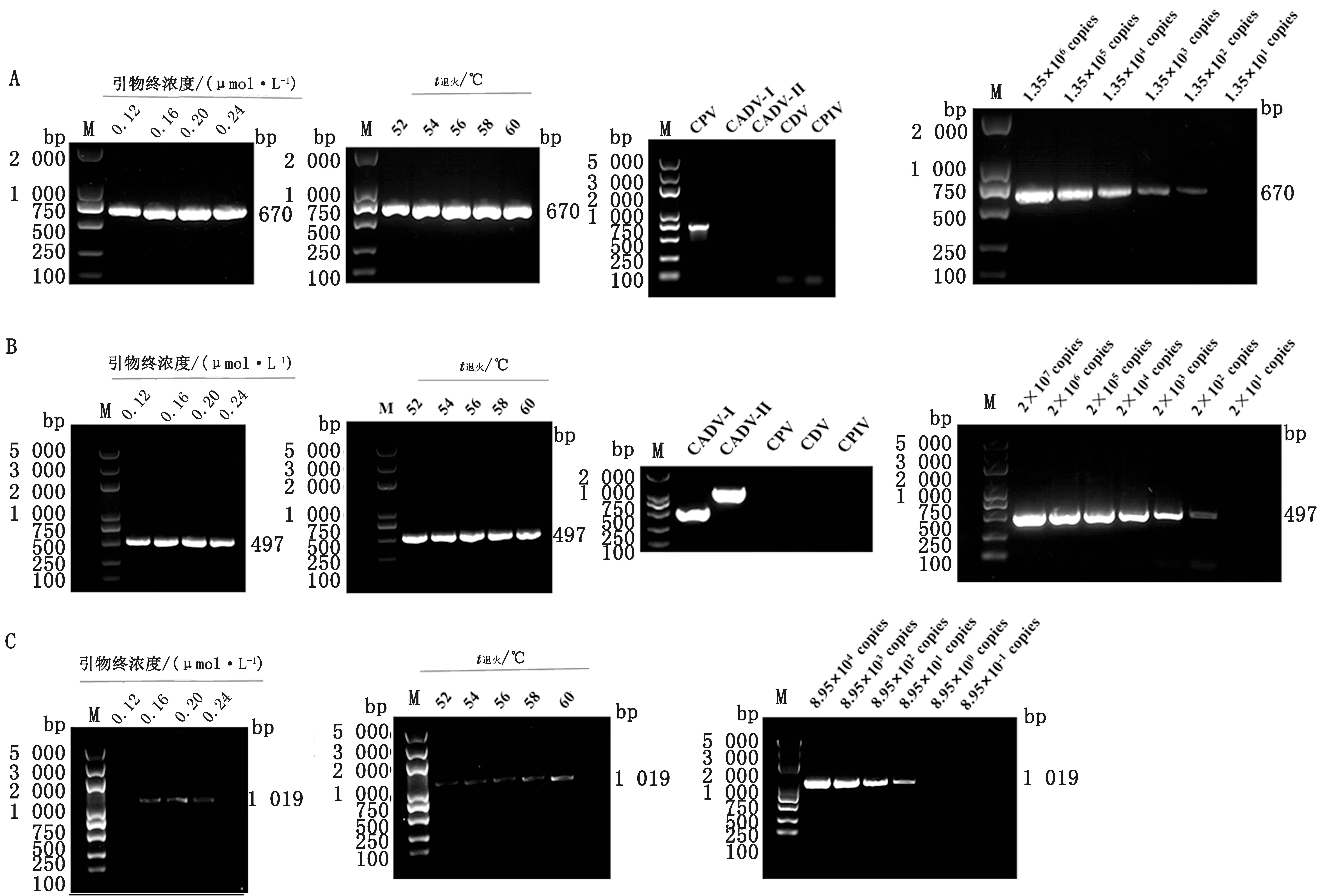
A.CPV(M.DL2000 DNA Marker);B.CAV-Ⅰ(M.DL5000 DNA Marker);C.CAV- Ⅱ(M.DL5000 DNA Marker)
2.2 CPV、CAV-Ⅰ和CPV、CAV-Ⅱ二联PCR建立结果所建立的二联PCR分别对CPV和CAV-Ⅰ、CPV和CAV-Ⅱ以及CAV-Ⅰ和CAV-Ⅱ进行扩增,重复性3次均能够取得良好的扩增结果,而且CDV、CPIV结果为阴性,证明特异性良好(图2)。
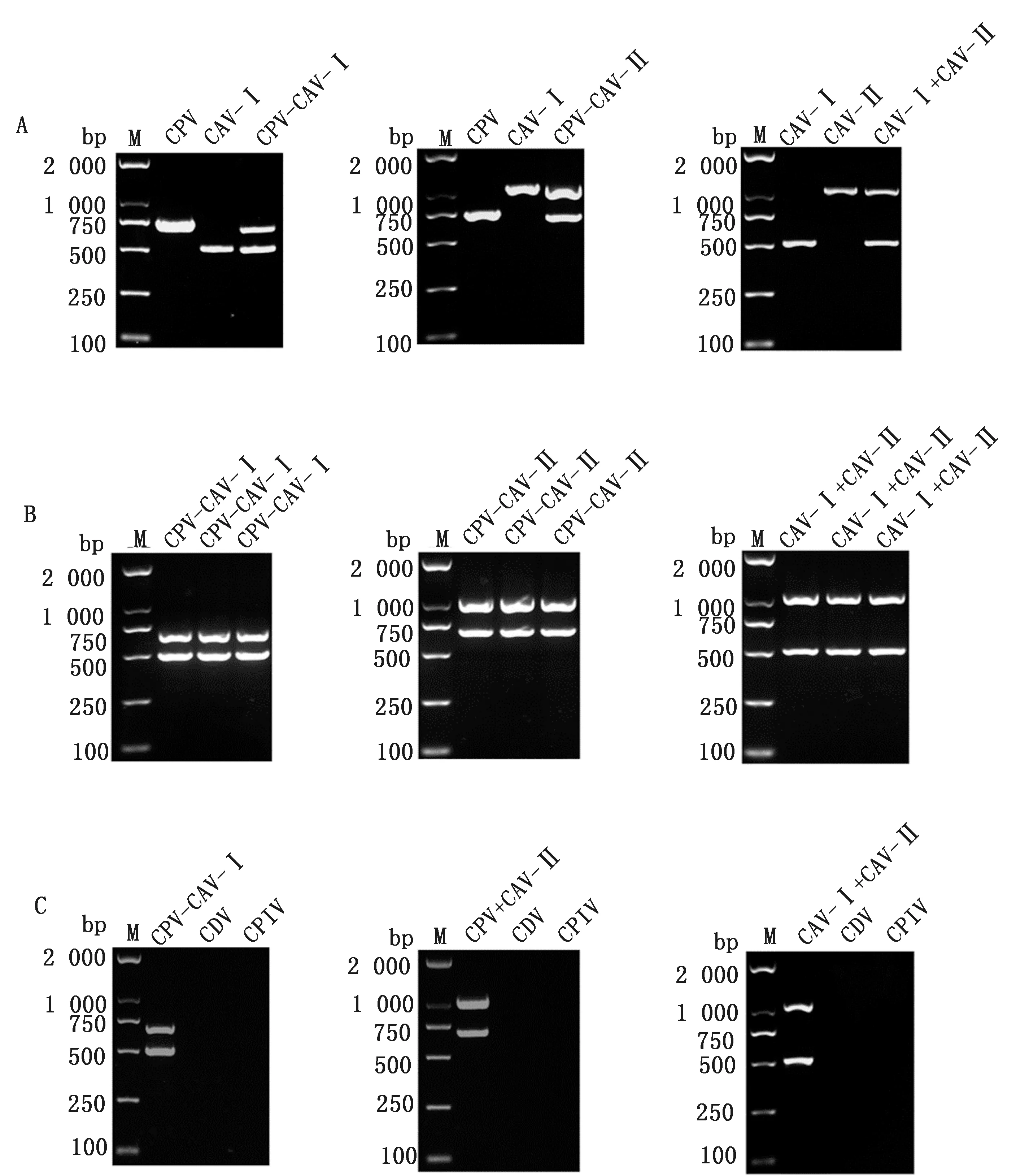
A.CPV和CAV-Ⅰ、CPV和CAV-Ⅱ以及CAV-Ⅰ和CAV-Ⅱ二模板PCR;B.二联PCR重复性试验结果;C.二联PCR特异性试验结果。M.DL2000 DNA Marker
2.3 三联PCR扩增试验结果由图3可知,应用之前建立的最佳反应条件,三联PCR一次性成功扩增出670 bp(CPV)、497 bp(CAV-Ⅰ) 和1 019 bp(CAV-Ⅱ)的3条目的片带(图3),经测序证实,所有扩增的片段与CPV、CAV-Ⅰ和CAV- Ⅱ相应基因序列高度一致。
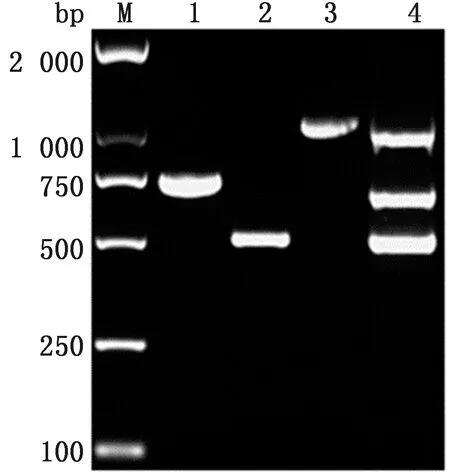
1.CPV;2.CAV-Ⅰ;3.CAV-Ⅱ;4.CPV+CAV-Ⅰ+CAV-Ⅱ。M.DL2000 DNA Marker
2.4 三联PCR重复性、特异性和灵敏度检测结果由图4可知,三联PCR重复3次均可以获得一致的扩增结果,而且与犬相关的2种病毒:CDV和CPIV检测结果均为阴性,证明该方法具有很高的特异性;灵敏度试验结果显示,三联PCR至少可检出约0.16 pg DNA。
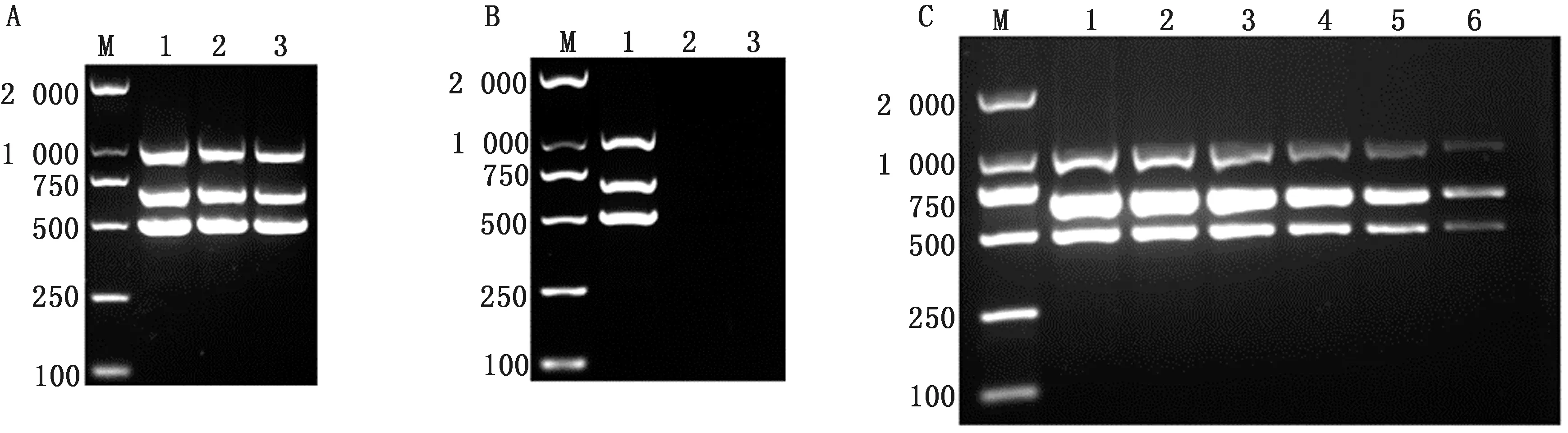
A.重复性试验结果(1~3.CPV+CAV-Ⅰ+CAV-Ⅱ);B.特异性试验结果(1~3.CPV+CAV-Ⅰ+CAV-Ⅱ、CDV、CPIV);C.灵敏度试验结果(1~6.100,10-1,10-2,10-3,10-4 ,10-5)。M.DL2000 DNA Marker
2.5 CPV-CAV-Ⅰ -CAV-Ⅱ三联PCR对病料的检测结果在20份送检样品中,应用三联PCR方法进行检测,部分结果如图5所示,其中CPV阳性者15份,CAV-Ⅰ阳性者5份,CAV-Ⅱ阳性者1份,其中CPV与CAV-Ⅰ混合感染4份,CAV-Ⅰ与CAV-Ⅱ混合感染1份。与单项PCR检测结果完全一致(图5)。
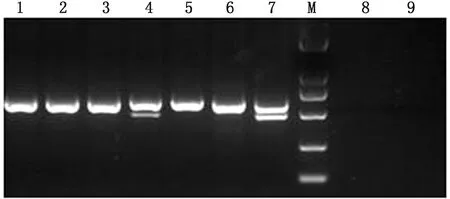
M.DL2000 DNA Marker;1~9.分别为临床病料
3 讨论
本试验在进行 CPV、CAV-Ⅰ和CAV-Ⅱ单项 PCR 的基础上,通过对病毒引物用量及反应温度的筛选,建立了CPV、CAV-Ⅰ和CAV-Ⅱ二联和三联PCR的快速、特异的鉴别诊断方法。
该研究采用刘维全等[12]报道的CPV通用引物、王雷等[13]报道的CAV-Ⅰ和CAV-Ⅱ鉴别引物进行了单项PCR试验的优化,并对病料 DNA 模板的制备及PCR反应条件进行了改进,利用煮沸法提取病毒核酸,大大缩短了核酸提取时间;利用2×PrimeStar Max Premix进行扩增只需40 min即可完成PCR过程。刘大飞等[7]同样建立了用于同时检测犬瘟热病毒、CPV、Ⅰ型和Ⅱ型CAV的多重PCR方法,与之相比,本研究所设计的CPV通用引物可以同时检测CPV-2、CPV-2a、CPV-2b和CPV-2c 4种亚型,而且最低检测限度为0.16 pg,灵敏度更高,反应速度更快。
近年来,随着宠物养殖业的蓬勃发展,犬细小病毒性肠炎和CAV感染对宠物业的危害日益加重。本研究建立的CPV、CAV-Ⅰ 和CAV-Ⅱ三联PCR诊断方法,能够快速准确地对CPV、CAV-Ⅰ 和CAV-Ⅱ的临床感染样品进行检测,为病原体的快速诊断建立了一种简单、经济、灵敏的方法。

