达格列净干预对急性心肌梗死合并2型糖尿病患者经皮冠状动脉介入术后心室重构、心肌微灌注的影响
赵 莉,李 智
(延安大学附属医院心脑血管病医院,陕西 延安716000)
急性心肌梗死(Acute myocardial infarction,AMI)为2型糖尿病(Type 2 diabetes,T2DM)患者的常见心血管并发症,可明显增加T2DM患者的病残率和死亡风险[1]。临床中对于AMI合并T2DM患者常采用经皮冠状动脉介入(Percutaneous coronary intervention,PCI)术联合胰岛素(Insulin,INS)等药物进行治疗,但是常规的降糖药物往往仅能够有效降低血糖水平,在改善患者心功能等的应用中效果有限[2]。达格列净属于钠-葡萄糖协同转运蛋白2(Sodium-glucose cotransporter 2,SGLT2)抑制剂,其主要通过抑制血糖重吸收,改善胰岛素抵抗(IR),促进胰高血糖素水平的提高等作用机制达到降糖的作用,研究发现,达格列净还可通过抑制心肌细胞Ca2+超载,促进患者心功能的改善[3]。目前关于达格列净干预对AMI合并T2DM患者PCI术后心室重构、心肌微灌注影响的研究较少。因此,本研究以延安大学附属医院心血管内科收治的150例AMI合并T2DM患者为研究对象,对此进行了分析。
1 资料与方法
1.1 一般资料 纳入2018年1月至2020年10月延安大学附属医院收治的AMI合并T2DM患者98例,随机分为INS组和达格列净组,各49例。其中INS组男31例,女18例,年龄44~74岁,平均(59.38±8.05)岁,吸烟史22例,T2DM病程3~12年,平均(7.79±2.56)年,体重指数(BMI)(27.49±2.42)kg/m2。达格列净组男33例,女16例,年龄43~72岁,平均(59.67±8.64)岁,吸烟史24例,T2DM病程4~13年,平均(7.87±2.31)年,BMI(27.55±2.24)kg/m2。两组T2DM病程等一般资料比较无统计学差异(均P>0.05),具有可比性。本研究在医学伦理委员会审核批准后开展。病例纳入标准:首次诊断为AMI[4],发病至就诊时间≤12 h;确诊为T2DM[5];接受PCI术治疗;知情同意。排除标准:近期抗血小板药物、激素等服用史;药物过敏;肝肾功能障碍;血液系统疾病;伴先天性心脏病等其他心脏疾病;严重感染;恶性肿瘤;PCI术后TIMI血流0-Ⅱ级;血流动力学不稳;甲状腺疾病;合并酮症酸中毒等T2DM并发症;自身免疫性疾病;认知功能异常;接受随访。
1.2 治疗方法 两组均在PCI术之前,口服负荷剂量的阿司匹林(国药准字:J20171021,100 mg)和氯吡格雷(国药准字:H20123116,75 mg),剂量分别为300 mg和600 mg。PCI术后,常规口服阿司匹林和氯吡格雷,剂量分别为100 mg/d和75 mg/d。其中INS组入院后在常规治疗基础上进行INS(国药准字:S20153001,300 U)的持续静脉泵入,初始剂量设置为每小时0.1 U/kg,待血糖水平稳定后,改为皮下注射。根据患者血糖水平控制INS剂量,使空腹血糖(Fasting blood glucose,FBG)为4.4~6.1 mmol/L,餐后2 h血糖为4.4~7.8 mmol/L。达格列净组在INS组基础上使用达格列净(国药准字:J20170040,10 mg),5~10 mg/次,1次/d。两组均持续治疗6个月。
1.3 观察指标
1.3.1 临床相关指标: 比较两组治疗前后的体重,分别于治疗前后,抽取INS组和达格列净组患者空腹静脉血,使用德国西门子ADVIA 2400全自动生化分析仪测定患者空腹血糖(Fasting blood glucose,FBG)和超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)水平,糖化血红蛋白(Glycated hemoglobin,HbA1c)使用日本希森美康HbA1c分析仪测定,白介素-6(Interleukin,IL-6)水平使用ELISA法进行测定,试剂盒购买自上海研启生物科技有限公司。
1.3.2 心室重构指标: 分别于治疗前后,使用美国GE LOGIQ9彩色超声诊断仪测定患者左室舒张末期内径(Left ventricular end diastolic diameter,LVEDD)、左室重量指数(Left ventricular mass index,LVMI)以及收缩末期容积指数(End-systolic volume index,ESVI)。
1.3.3 心肌微灌注指标: 分别于治疗前后,测定患者的TIMI 血流帧数(CTFC)和心肌灌注分级(TMPG)等指标,分析心肌微灌注情况。
1.3.4 不良心血管事件(Major adverse cardiovascular events,MACE): 对患者出院后进行6个月的随访,随访方式为门诊或电话,比较两组再发AMI、死亡、心绞痛、心力衰竭等的发生率。
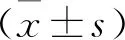
2 结 果
2.1 两组治疗前后临床相关指标比较 治疗前,两组的BMI、hs-CRP、FBG、HbA1c、IL-6比较,差异无统计学意义(均P>0.05)。治疗后,INS组BMI明显增加,达格列净组BMI明显下降,达格列净组BMI明显低于INS组(P<0.05)。治疗后,两组hs-CRP、FBG、HbA1c、IL-6水平均明显下降,其中达格列净组下降更明显(均P<0.05)。见表1。
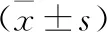
表1 两组治疗前后临床相关指标比较
2.2 两组治疗前后心室重构指标比较 治疗前,两组的LVEDD、LVMI以及ESVI比较,差异无统计学意义(均P>0.05)。治疗后,INS组和达格列净组的LVEDD、ESVI明显下降,LVMI明显上升,其中,达格列净组的LVEDD、LVMI以及ESVI变化均明显优于INS组(均P<0.05)。见表2。
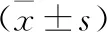
表2 两组治疗前后心室重构指标比较
2.3 两组治疗前后心肌微灌注指标比较 治疗前,两组的CTFC和TMPG水平比较,差异无统计学意义(均P>0.05)。治疗后,两组的CTFC和TMPG水平明显下降,其中达格列净组下降更明显(均P<0.05)。见表3。

表3 两组治疗前后心肌微灌注指标比较(帧)
2.4 两组MACE发生情况比较 达格列净组的MACE发生情况明显低于INS组(P<0.05)。见表4。

表4 两组不良心血管事件发生情况比较[例(%)]
3 讨 论
T2DM为我国居民的高发疾病,发生率约为11.6%,目前认为,T2DM患者长期高血糖状态,可增强血管内皮损伤,促使血小板活化,使发生AMI的风险高于非T2DM患者[6]。AMI合并T2DM患者PCI治疗后常采用INS进行降糖治疗,但是极易引发低血糖,并可促使患者BMI的增加,效果有限[7]。目前认为,SGLT2为葡萄糖重吸收的主要运载体,在机体血糖调节中发挥重要作用,达格列净属于SGLT2抑制剂,可明显降低血糖水平,提高肝脏等对INS的敏感性,同时并不增加低血糖的发生风险,安全性好[8]。通过明确达格列净干预对患者PCI术后心室重构、心肌微灌注的影响,可为AMI合并T2DM患者的治疗提供相关依据。
INS的使用可减少尿糖排泄,有助于脂质合成,促使患者体重的增加[9]。研究发现,胰岛素抵抗与肥胖相关,对于T2DM患者,单独使用INS可增加减重难度,降低INS的治疗效果[10]。本研究发现,治疗后达格列净组的体重明显低于INS组,FBG、HbA1c水平明显低于INS组,这可能由于达格列净可加强尿糖排泄、促进体脂消耗,进而有助于减轻患者体重和INS抵抗,增强机体对INS的敏感性,使FBG、HbA1c得以进一步改善[11]。研究发现达格列净联合INS治疗T2DM,可有效降低INS用量,减轻INS抵抗指数,促进患者体重的下降,且安全性好[12]。研究发现,T2DM患者处于长期慢性炎症状态,其中以hs-CRP、IL-6等炎症因子水平偏高为主要特征,可促使T2DM患者动脉粥样硬化斑块的形成以及破裂,增加AMI的发生风险[13]。本研究发现治疗后达格列净组的hs-CRP、IL-6的水平明显低于INS组,提示达格列净对AMI合并T2DM的治疗可能通过抑制hs-CRP、IL-6等炎症因子水平进行,但是具体机制仍需深入研究。
本研究发现,达格列净组的心室重构指标和心肌微灌注指标均明显优于INS组,这可能是由于达格列净能够明显减缓心肌缺血过程中的Na+内流,以及Ca2+超载,促进患者心功能的改善[14]。此外,达格列净还可通过Nfr2/ARE等通路,减轻机体氧化应激反应,达到阻碍心肌纤维化和心室肥大,提高心肌舒张功能,促进心肌重构和心肌微灌注改善的效果[15]。血脂水平的增高可促使机体糖脂代谢异常,加强血管内皮损伤,促使血管内微血栓的形成,进而使MACE的发生风险提高[16]。尿酸可通过增强机体氧化应激反应,促进炎症因子表达,降低INS敏感性,而与MACE的发生明显相关[17]。本研究发现,达格列净组的MACE发生情况明显低于INS组,这可能是由于达格列净能够通过促进尿糖排泄,增强机体对脂肪的分解,降低血尿酸水平,进而使炎症和氧化应激反应减轻,达到抑制微血管病变,增强斑块稳定性的效果,使MACE的发生风险明显下降[18]。目前认为,达格列净可明显改善机体中三酰甘油和血尿酸水平,促使高密度脂蛋白水平的提高,进而达到改善机体糖脂代谢的效果[19]。研究发现,达格列净可明显改善心绞痛合并T2DM患者的心血管结局,且并未增加生殖系统感染等并发症的发生风险[20]。也有研究发现,达格列净可明显改善巨噬细胞浸润,抑制炎症相关基因的表达,减轻1型糖尿病小鼠的动脉硬化程度。
综上所述,达格列净干预可明显抑制AMI合并T2DM患者PCI术后的炎症指标,促进血糖指标、心室重构、心肌微灌注的改善,以及MACE发生风险的下降。

