Hepcidin/SF比值在维持性腹膜透析患者中的临床价值分析
鲍美霜,王洁2,肖宇2,马瑞莺2,黄芳,黄石凤,马超丽
(1. 右江民族医学院,广西 百色 533000;2. 右江民族医学院附属医院,广西 百色 533000)
近年来,慢性肾脏病(chronic kidney disease,CKD)的患病率在全球范围内呈上升趋势,在美国、澳大利亚等发达国家中,CKD患病率为11%[1],中国预计超过10.8%[2]。肾性贫血是CKD最常见的并发症之一,贫血可加速慢性肾脏病的进展、损害全身各个器官功能。CKD患者肾皮质产生促红细胞生成素(EPO)不足及铁的缺乏是导致肾性贫血的主要原因,而铁的缺乏进一步影响重组人促红细胞生成素(recombinant human erythropoietin,rHuEPO)的治疗效果。多项研究表明,CKD患者铁缺乏与死亡率和心力衰竭风险显著增加有关[3-4],而过量的铁而可通过破坏DNA、蛋白质和脂质膜等导致氧化应激,即器官组织铁中毒,如肝脏铁沉积而至肝功能损害。故了解铁的储存状况和循环铁对诊断和治疗肾性贫血具有重要意义。目前较好地评价铁贮存的方法是测定骨髓铁,但该方法麻烦、耗时且具有创伤性。传统的评价机体铁状态的指标有很多,但在CKD中,这些指标很多受肾衰竭和伴随的炎症影响,不能很好地反映铁的真实状态,铁状态的精准评估仍是挑战。铁调素(Hepcidin)是由肝脏合成并分泌的一种抗菌多肽,抑制铁的吸收及利用,在CKD患者铁代谢中起到关键调控作用,血清铁蛋白(SF)是目前唯一有效的铁储存标志,但在炎症感染、合并肝脏疾病、恶性肿瘤等中其往往会升高,故单用来评价铁状态其灵敏度极差。Hepcidin/SF比值是衡量Hepcidin表达是否适宜铁超载的指标,以往用于肝脏疾病(如病毒性和自身免疫性肝炎)和血液系统疾病(如遗传性血色素沉着病和遗传性溶血性贫血)的研究,在CKD患者中鲜有研究。本文中笔者通过探讨Hepcidin/SF比值在维持性腹膜透析(MPD)患者中的潜在价值,试图为临床精准评价CKD患者铁状态提供参考作用。
1 资料与方法
1.1一般资料 选取2020年10月—2021年9月在我院规律返院复诊的MPD患者90例为研究对象,均每日规律更换腹膜透析液,4~5次/天,同时选取同期健康体检者30例为对照组,收集的一般资料包括性别、年龄、透析龄、BMI、原发病、EPO治疗时间等。本实验已取得医院伦理委员会同意。MPD患者入选标准: ①入选对象均为CKD 5期维持性腹膜透析患者,透析龄≥3个月,年龄≥18岁,≤75岁;②接受rHuEPO治疗≥3个月;③所有入选患者或家属签署知情同意书。排除标准: ①年龄<18岁或>75岁;②维持性腹膜透析不足3个月;③已诊断有血液系统疾病:溶血性疾病、多发性骨髓瘤等;④存在急性或慢性感染或近6个月发生腹膜炎的患者;⑤近3个月有手术、外伤、输血、出血患者;⑥患有严重肝病、严重心力衰竭、恶性肿瘤等。
1.2研究方法
1.2.1标本采集 抽取静脉血统一在我院检验科检测白细胞(WBC)、血红蛋白(Hb)、红细胞计数(RBC)、红细胞分布宽度CV值(RDW-CV)、红细胞分布宽度SD值(RDW-SD)、血肌酐(Scr)、尿素氮(BUN)、β-2微球蛋白(β2-MG)、胱抑素C(Cys-C)、白蛋白(Alb)、铁蛋白(SF)、血清铁(SI)、C反应蛋白(CRP)、甲状旁腺激素(iPTH)、血清降钙素(CT)、血钙(Ca)、血磷(P)、锌(Zn)、维生素D3(VitD3)。收集所有入选对象静脉血3 ml,采用由泉州市睿信生物科技有限公司提供的酶联免疫吸附测定(ELISA)试剂盒检测血清可溶性转铁蛋白受体(sTfR)、总铁结合力(TIBC)、铁调素(Hepcidin),计算Hepcidin/SF比值及转铁蛋白饱和度(TSAT),TSAT=SI/TIBC×100%。
1.2.2根据实验结果进行分组分析 根据实验检测结果对MPD患者进行分组:①TSAT≥20%为铁充足组(A组,32例);②TSAT<20%且SF≥100 μg/L为功能性缺铁组(B组,42例);③TSAT<20%且SF<100 μg/L绝对性缺铁组(C组,16例)。健康体检者为对照组(D组,30例)。

2 结果
2.1一般资料 90例MPD患者中,男50例(55.56%),女40例(44.44%),年龄19~74岁,平均(45.60±13.37)岁,透析龄3~110个月,平均(35.3±2.62)个月。病因分类:原因不明确61例(67.78%),高血压7例(7.78%),IgA 7例(7.78%),肾病综合征4例(4.44%),ANCA 4例(4.44%),糖尿病肾病5例(5.56%),其他2例(2.22%)。4组在年龄、性别比、BMI差异无统计学意义(P>0.05),A组、B组、C组MPD患者在透析月龄差异无统计学意义(P>0.05)。见表1。

表1 不同组别一般人口学资料差异分析
2.2不同组别各项实验室结果比较 4组Ca水平差异无统计学意义(P>0.05);A、B、C三组MPD患者间Cys-C、iPTH、CT、Zn、VitD3差异无统计学意义(P>0.05);MPD患者中A组、B组、C组与D组相比,CRP、WBC、RDW-CV、RDW-SD、P、Scr、BUN、Hepcidin、Hepcidin/SF均高于D组(P<0.05),Hb、RBC、Alb、TIBC、sTfR、TSAT均低于D组(P<0.05)。B组β2-MG、Hepcidin、Hepcidin/SF均比A组高,SI比A组低(P<0.05);B组Hepcidin、Hepcidin/SF比C组高,TIBC比C组低(P<0.05);C组Hepcidin/SF、TIBC比A组高,SI、Hepcidin比A组低(P<0.05),见表2。

表2 4组各项实验室指标差异分析

表2(续) 4组各项实验室指标差异分析
2.3不同实验室指标与Hepcidin/SF的相关性 Spearman相关性分析显示,Hepcidin/SF与CRP、Hepcidin呈强正相关(r=0.449,0.610,P<0.001),与SF、SI、Hb呈强负相关(r=-0.578,-0.615,-0.353,P<0.001),见表3。
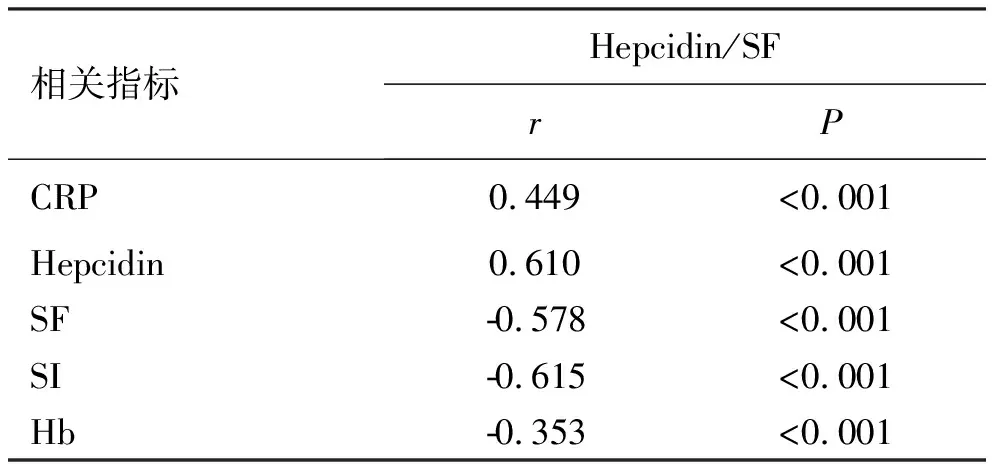
表3 Spearman相关性分析
3 讨论
铁是人体必不可少的微量元素,广泛参与人体的生理生化反应。CKD患者普遍存在不同状态的铁缺乏,铁代谢紊乱是肾性贫血难以纠正的重要原因,且缺铁可能与CKD患者发生认知功能障碍有直接或间接关系[5]。但铁过多也会对人体有害,铁超载除了对各个脏器功能有损害,还可能会增加ESRD患者动脉粥样硬化的风险。评估铁代谢的指标有很多,但很多因受多种因素影响而准确性不高,TSAT是衡量铁状态的重要指标,反应铁的可用性,其联合SF是目前最常用的评估铁状态的指标,但运用起来仍需结合多个铁代谢指标,较繁琐且易受影响。目前没有单一指标可准确预示CKD患者的铁状态,特别是提示功能性缺铁,积极探索更准确的铁代谢指标有助于更准确地判断CKD患者的铁状态,对指导铁剂治疗及及时进行干预具有重要意义。本研究中,MPD患者WBC、RDW-CV、RDW-SD、P、Scr、BUN明显升高,Hb、RBC、Alb水平下降,表明随着肾小球滤过率下降,尿毒症毒素清除能力降低,体内代谢紊乱,CKD患者普遍存在贫血及营养状况较差。本研究纳入的研究对象已排除存在感染的患者,结果中MPD患者CRP、WBC等炎症指标较高,即微炎症状态,其发生是一种免疫性炎症而并非病原微生物感染引起[6]。以往大量研究表明CKD患者血磷偏高血钙降低,但本次研究MPD患者血钙水平与健康对照组相比无明显差异,这可能与病例数较少及入选存在偏倚有关。RDW是评估红细胞变异程度的重要指标,升高表明红细胞大小不均等,多见于缺铁性贫血、巨幼细胞性贫血[7],此研究表明CKD患者红细胞生成过程因缺铁等原因存在病态造血。CKD患者锌水平较低,其原因主要为摄入不足及丢失过多,缺锌可加重CKD进展[8],人体红细胞中每摩尔碳酸酐酶含有1 g原子锌,缺锌可影响红细胞的运氧功能,本研究中尚未发现不同铁状态下的MPD患者锌水平有差异。
TIBC即血清中转铁蛋白所能结合的最大铁量,反应转铁蛋白水平,当体内铁缺乏、铁需要量增加时,机体为满足铁的需求而分泌更多的转铁蛋白。本研究中绝对性缺铁组患者TIBC明显高于铁储量充足的患者,表明CKD患者铁缺乏受铁的转运能力下降影响较小。β2-MG是由淋巴细胞、血小板等产生的一种小分子球蛋白,存在于成熟红细胞和胎盘滋养层细胞外的各种细胞表面,在肾小管上皮细胞中分解破坏。功能性缺铁组患者β2-MG表达较铁代谢正常组高,考虑可能的机制为前者Hepcidin等炎症指标较高,红细胞生成不良及寿命缩短,β2-MG释放增多。血清铁是血液中与运铁蛋白结合的铁量,细胞内释放的铁以及从小肠吸收入血的二价铁被氧化成三价铁后与运铁蛋白结合运输到骨髓或其他组织被利用。本实验中功能性缺铁患者铁蛋白水平与铁状态正常患者无明显差异,但血清铁较低,也验证了功能性缺铁的CKD患者自身铁储量充足但利用障碍。
细胞内铁释放的唯一通路是膜铁转运蛋白-1(ferroportin-1,FPN-1),是一种跨膜的铁输出蛋白,Hepcidin通过诱导FPN-1内化和降解来调节铁的储存与释放,在铁代谢异常,尤其是功能性缺铁中发挥了重要作用。本研究中,铁状态正常和功能性缺铁的MPD患者Hepcidin升高,且后者升高更明显,而在绝对性缺铁患者中Hepcidin下调,与Goyal H等[9]的研究结果一致,表明Hepcidin的表达受铁状态的调控,肝细胞感知铁储存后分泌更多的Hepcidin,抑制铁的吸收及储存铁的释放而下调铁水平。动物实验表明,EPO可抑制大鼠体内Hepcidin的生成,刺激铁的吸收和储存,但导致肝脏铁沉积,从而引发的铁过载刺激Hepcidin合成的强度高于EPO的抑制作用,并可能导致贫血和恶化[10]。综上,Hepcidin预示CKD患者发生功能性缺铁需结合患者铁储量状况。铁蛋白是由24个亚基高度对称性方式组成的含铁蛋白,每个铁蛋白组成的空壳可容纳4500个铁原子[11]。铁蛋白作为一种急性期反应物,在CKD患者中往往会升高,从而刺激铁调素的生成,加重铁利用障碍,形成恶性循环。本研究中功能性缺铁患者Hepcidin/SF升高最明显,且Hepcidin/SF与炎症反应呈正相关,与血清铁、血红蛋白呈负相关,表明Hepcidin/SF升高时铁水平降低,即铁吸收和细胞内铁释放减少的结果,铁利用障碍,加重贫血。既往研究表明,Hepcidin的表达与铁蛋白呈正相关[12-14],Hepcidin升高越明显,Hepcidin/SF比值越大,Hepcidin/SF中和了铁状态对Hepcidin分泌的影响,在我们的猜想中比Hepcidin预示功能性缺铁更准确。而绝对性缺铁患者Hepcidin/SF比值较铁状态正常患者高,表明Hepcidin并不因铁蛋白水平明显降低而明显下调,虽然铁状态是调节Hepcidin的关键因子,但影响Hepcidin水平的因素多种多样。
综上所述,Hepcidin/SF升高提示铁储量充足的CKD患者发生功能性缺铁,且比Hepcidin更为准确。当CKD患者发生功能性缺铁时,应谨慎补铁并积极降低Hepcidin水平。国内外治疗指南强调SF≥500 μg/L为铁剂补充的上限。适当的补充EPO可抑制铁调素的分泌。有学者发现[15],口服维生素C可降低功能性缺铁患者的Hepcidin、hs-CRP水平,值得反复验证后推广应用。低氧诱导因子(HIF)的发现将肾性贫血的治疗带入了新的时代。荟萃分析[16]显示,罗沙司他可显著降低CKD患者的Hepcidin水平、提高TSAT及维持较稳定的血红蛋白水平,功能性缺铁患者改善肾性贫血可优先考虑选择HIF抑制剂罗沙司他。

