NOD2促进二乙基亚硝胺诱导小鼠肝组织炎症的机制研究
许智玲,张斌*,张顺财
(1.复旦大学附属中山医院青浦分院感染科,上海 201700;2.复旦大学附属中山医院消化科,上海 200032)
肝做为人体最大的消化器官,受各种有害因素的影响可造成肝损伤。肝损伤早期多表现为肝组织的炎症,若早期肝细胞炎症得不到及时诊治,会逐步发展为肝纤维化,严重会进展为肝硬化,甚至肝癌[1-2]。因而在肝病防治方面,积极探索肝早期炎症反应的机制具有非常重要的临床意义。有研究发现,机体天然免疫系统主要通过各种模式识别受体(pattern recognition receptors,PRRs)识别病原成分,进一步启动宿主应答免疫防御反应。其中,NOD2是PRRs家族的重要成员,它主要识别细胞内细菌肽聚糖的降解产物胞壁酰二肽(muramyl dipeptide,MDP),是一种存在于所有革兰阳性菌和阴性菌细胞壁的成分,可以介导宿主抵抗入侵细菌的免疫和炎症反应[3],因此,NOD2与炎症反应关系密切。既往有学者发现,NOD2表达除了与克罗恩病的炎症发生密切相关外,肠源性MDP的刺激可激活肝细胞NOD2受体并增加其表达,与肝病发生自发性细菌性腹膜炎密切有关[4-6],但NOD2在肝炎症性疾病中的具体作用及机制仍不明确。为进一步探索其机制,本研究应用NOD2肝特异性敲除小鼠,使用DEN构建急性肝损伤模型[7],以探讨肝细胞NOD2受体在肝炎症反应中的作用及可能机制,为肝炎症的诊治提供重要的作用靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物
20只6周 龄 的SPF级 雄 性B6/JNju-Nod2em1Cflox/Gpt(Nod2f/f)小鼠,体重19~21 g,由南京大学模式动物公司提供【SCXK(苏)2018-0008】,随机选择其中10只与Albumin-Cre小鼠杂交,获得NOD2肝特异性敲除小鼠(Nod2△hep):基因敲除的过程按照文献的方法操作[8],由南京大学模式动物公司执行)。饲养于复旦大学实验动物部【SYXK(沪)2020-0032】,饲养及实验过程遵守动物的3R原则,小鼠均分笼饲养,每笼5只,采用标准饲料喂养,自由饮水,光照与黑暗各12 h交替处理,湿度为50%~60%,温度为20~22℃,适应性喂养1周。
1.1.2 主要试剂与仪器
DEN和三辛酸甘油酯由美国Sigma公司提供。总RNA提取试剂盒购自北京天根生化科技有限公司。PCR试剂购自上海生工,ALT、AST测定试剂盒及病理染色试剂购自南京建成公司。P38/p-P38、ERK/p-ERK、JNK/p-JNK、p65/p-p65、JAK2/p-JAK2、STAT3/p-STAT3等抗体购自美国Abcam公司。
超低温冰箱(Thermo公司,美国);荧光显微镜(Nikon公司,日本);高速低温离心机(Sigma公司,美国);实时荧光PCR仪(Eppendorf公司,德国);凝胶扫描成像系统(Bio-Bod公司,美国)。
1.2 方法
1.2.1 动物分组
使用DEN构建急性肝损伤模型,以DEN注射的NOD2基因敲除小鼠为Nod2△hep模型组,DEN注射的B6/JNju-Nod2em1Cflox/Gpt(Nod2f/f)小 鼠 为Nod2f/f模型组,未注射DEN的NOD2基因敲除小鼠为Nod2△hep组,未注射DEN的Nod2f/f小鼠为Nod2f/f组,每组5只。DEN具体使用方法如下:75%乙醇消毒小鼠腹部后,单次腹腔注射DEN(100 mg/kg,三辛酸甘油酯溶解)后1周处死小鼠,取材进行后续实验。全部实验过程未出现小鼠死亡。
1.2.2 组织病理学观察
新鲜肝组织用4%多聚甲醛固定后石蜡包埋。石蜡切片厚5 μm,苏木精-伊红(HE)以及TUNEL染色。为进行免疫组织化学染色,石蜡切片在进行脱腊、抗原修复及封闭后,分别孵育Ki67(1∶500,Abcam,英国)、F4/80(1∶100,CST,美国)抗体,显微镜下拍照并应用ImageJ软件(NIH,美国)统计分析。
1.2.3 血清ALT和AST水平检测
小鼠麻醉后取静脉血至1.5 mL离心管中,室温静置离心收集血清,根据ALT和AST试剂盒说明书检测血清中ALT和AST水平变化。
1.2.4 实时荧光定量聚合酶链式反应(qPCR)
NCBI网站搜索GenBank中已有的大鼠IL-6、TNF-α、IL-1β、IFN-γ及NOD2基因序列设计相应引物,以GAPDH为内参基因,由上海捷瑞生物设计合成,序列见表1。应用TRIzol试剂盒裂解提取小鼠肝组织中的总RNA,应用PrimeScriptTMRT reagent Kit试剂盒(日本TaKaRa)进行逆转录反应合成cDNA。根据SYBR Green实时荧光定量PCR试剂盒说明书(日本TaKaRa),冰上配制20 μL反应体系,随后使用ABI7500仪器进行扩增反应。
1.2.5 免疫蛋白印迹实验(Western Blot)
肝组织使用含有蛋白酶抑制剂PMSF(碧云天,上海)和磷酸酶抑制剂(Roche公司)的RIPA裂解液进行裂解提取总蛋白。配置SDS-PAGE凝胶进行电泳分离蛋白、转膜、封闭随后一抗孵育过夜:P38/p-P38(1∶1000,CST)、ERK/p-ERK(1∶1000,CST)、JNK/p-JNK(1∶1000,CST)、p65/p-p65(1∶1000,CST)、JAK2/p-JAK2(1∶1000,CST)、STAT3/p-STAT3(1∶1000,CST)和GAPDH(1∶1000,碧云天),对应二抗室温孵育1 h后ECL发光检测结果。
1.3 统计学分析
应用SPSS 20.0进行统计学分析,计量资料以平均值±标准差表示,采用单因素方差分析,两组间均数比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 NOD2肝特异性敲除小鼠模型的鉴定
通过对Nod2f/f组和Nod2△hep组NOD2的mRNA及蛋白质的表达水平比较,发现Nod2△hep组NOD2的mRNA及蛋白质的表达水平均显著下调(n=5,P<0.05,图1)。表明NOD2肝特异性敲除小鼠的模型建立成功。
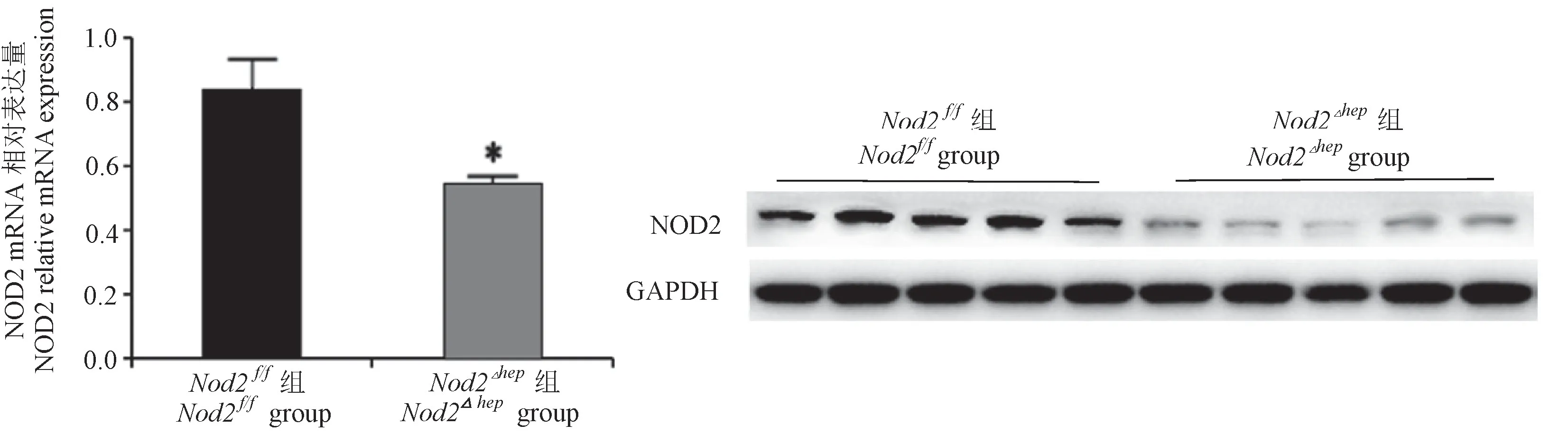
图1 NOD2基因敲除小鼠的基因表达及NOD2蛋白表达Figure 1 Gene expression and NOD2 protein expression in NOD2 knockout mice
2.2 肝特异性敲除NOD2对DEN诱导的小鼠急性肝损伤的影响
HE染色结果显示,作为对照的Nod2f/f组和Nod2△hep组均无明显肝炎症坏死等表现,而经过DEN处理的Nod2f/f模型组和Nod2△hep模型组均有显著的肝炎症、坏死表现,进一步对两个模型组比较,发现Nod2△hep模型组小鼠肝组织损伤情况显著减轻,表现为细胞坏死及空泡形成显著减少(图2A)。对小鼠血清中ALT和AST的水平检测结果显示,Nod2f/f组和Nod2△hep组无显著性异常,而Nod2f/f模型组和Nod2△hep模型组均高于Nod2f/f组和Nod2△hep组(P<0.01),同时,通过对模型组的比较发现,Nod2△hep模型组血清ALT及AST均低于Nod2f/f模型组(P<0.01)(图2B)。

基因名称Gene name Forward 5’-3’ Reverse 5’-3’GAPDH TGTGTCCGTCGTGGATCTGA TTCGTGTTGAAGTCGCAGGAG IL-6 TCCATCCAGTTGCCTTCTTG TTCCACGATTTCCCAGAGAAC TNF-α TGCCTATGTCTCAGCCTCTTC GGTCTGGGCCATAGAACTGA IL-1β TCGCTCAGGGTCACAAGAAA CATCAGAGGCAAGGAGGAAAAC IFN-γ ATGAACGCTACACACTGCATC CCATCCTTTTGCCAGTTCCTC NOD2 TGGTTCAGCCTCTCACGATGA AGGACACTCTCGAAGCCTT
2.3 肝特异性敲除NOD2对DEN诱导的小鼠肝炎症的影响
对小鼠肝组织炎症因子表达水平比较,发现Nod2△hep模型组肝组织中TNF-α、IL-6、IFN-γ和IL-1β的mRNA相对表达量均低于Nod2f/f模型组(P<0.01)(图3A)。进一步对小鼠肝组织进行F4/80免疫组化染色进行研究,发现Nod2△hep模型组F4/80染色阳性细胞数也显著低于Nod2f/f模型组(P<0.01)(图3B)。而作为对照的Nod2f/f组和Nod2△hep组肝组织均无显著性异常。
2.4 肝特异性敲除NOD2对DEN诱导的小鼠肝细胞增殖和凋亡的影响
研究发现,与Nod2f/f组和Nod2△hep组比较,Nod2△hep模型组及Nod2f/f模型组肝组织中Ki67染色阳性细胞数及肝细胞凋亡细胞数显著增多(P<0.01),同时对两个模型组比较发现,Nod2△hep模型组肝组织Ki67染色阳性细胞数及肝细胞凋亡细胞数明显少于Nod2f/f模型组(P<0.01)(图4,5)。
2.5 肝特异性敲除NOD2对DEN诱导后炎症相关信号通路的影响
通过对肝组织中P38、ERK、JNK、p65以及JAK2/STAT3蛋白磷酸化水平的比较,发现Nod2f/f模型组和Nod2△hep模型组均显著高于Nod2f/f组和Nod2△hep组,进一步对两个模型组进行比较,发现Nod2△hep模型组肝组织中P38、ERK、JNK、p65以及JAK2/STAT3蛋白磷酸化水平显著低于Nod2f/f模型组(P<0.05)。表明肝NOD2缺失可下调NF-κB、MAPK和STAT3信号通路相关蛋白的表达(见图6)。

图6 肝NOD2缺失对DEN诱导后小鼠肝NF-κ B、MAPK和STAT3信号通路的影响(n=5)Figure 6 Effects of NOD2 deficiency on NF-κ B,MAPK and STAT3 signaling pathways in the liver of DEN induced mic(n=5)
3 讨论
肝病是常见的疾病,许多肝病因为得不到及时诊治,会从早期的肝炎,逐步进展到肝硬化,甚至肝癌,是造成患者死亡的主要原因。肝作为最大的消化腺,容易受到代谢物、毒性物质及微生物等多种因素的损伤,造成肝细胞的炎症,严重的可以发生肝细胞坏死。同时肝具有强大的再生修复能力,研究发现肝切除手术或毒物造成肝损伤后,残肝细胞能迅速由静止状态进入细胞周期,通过DNA合成和有丝分裂补偿丢失的肝组织,恢复肝功能。在肝细胞的坏死-再生循环中,炎症是诱发肝疾病的常见原因,是机体快速响应感染或损伤的一种固有免疫,适度的炎症反应能够保护机体免受进一步的损伤。但是,慢性炎症和过度的炎症反应通常是有害的,不仅对机体形成二次打击,也会损伤机体的正常功能[9],如得不到及时诊治,会进一步形成肝硬化,甚至肝癌。正常情况下,肝可通过各种免疫细胞清除由肠道经门静脉系统到达感知各种细菌成分,但是肝出现损伤后,可以引起肠道菌群失调和肠道通透性增加,肠源性细菌成分通过门静脉系统到达肝增多而清除减少,逐渐累积的细菌成分可持续激活肝免疫反应,加重肝炎症反应和DNA损伤,促进肝疾病发展[10]。肝通过调控促炎和抗炎细胞因子间的平衡,发挥炎症调节作用,在肝再生和肝坏死中也发挥重要的调节作用。因而积极探索肝炎症的免疫机制,有重要的理论意义和临床应用价值。
许多研究证实,有20%~75%的慢性肝病患者发生肠道菌群失调[11],特别是小肠细菌过度生长,使得门脉中内毒素(LPS)水平明显升高的情况下更易发生;另有学者发现,肝硬化患者肠道上皮紧密连接蛋白ZO-1表达水平下降,黏膜屏障功能受损,渗透性增加,移位到肝的细菌或其代谢成分增多,容易发现肝炎症,进一步可以加重肝损伤,他们应用抗生素利福昔明抑制肠道细菌过度生长可一定程度缓解肝性脑病和肝硬化失代偿期患者的病情[12]。学者研究发现,在不同肝炎症模型中,肠源性细菌产物可以诱导肝NOD2表达增加,促进机体TNF-α和IFN-γ的表达,有促进肝炎症反应的作用[13-14]。NOD2作为PRRs家族的重要成员,可以通过识别肠源性细菌产物MDP而被激活,从而启动宿主免疫和炎症反应。学者研究发现,在不同肝炎症模型中,肠源性细菌产物可以诱导肝NOD2表达增加,促进机体TNF-α和IFN-γ的表达,有促进肝炎症反应的作用[15-16]。NOD2作为PRRs家族的重要成员,可以通过识别肠源性细菌产物MDP而被激活,从而启动宿主免疫和炎症反应,但是对NOD2在肝炎症中的机制还不完全清楚。因而积极探索NOD2与肝炎症发生中的作用及机制具有非常重要的意义。为探索NOD2在肝炎症发病中的作用,我们借助动物研究所的平台,构建了NOD2肝特异性敲除小鼠(Nod2△hep),并采用PCR和Western Blot技术对NOD2基因敲除小鼠进行鉴定,通过对Nod2f/f组和Nod2△hep组肝组织NOD2 mRNA及蛋白质相对表达量的比较,发现Nod2△hep组NOD2的mRNA及蛋白质的表达水平均显著下调,表明NOD2肝特异性敲除小鼠的模型建立成功。为了使小鼠形成肝炎,选择DEN对其干预,当一次性注射DEN后可以造成小鼠急性肝损伤,能较好满足小鼠肝炎研究的需要。进一步对其机制进行了探索,发现与Nod2f/f模型组比较,Nod2△hep模型组小鼠肝组织细胞坏死及空泡形成明显减少,Nod2△hep模型组小鼠血清ALT和AST水平明显下降(P<0.01),而Nod2△hep组小鼠与Nod2f/f组小鼠肝组织病理及肝功能均无明显异常。另外通过对各组肝组织炎症因子表达情况进行比较,发现与Nod2f/f模型组相比,Nod2△hep模型组中炎症因子TNF-α、IL-6、IFN-γ和IL-1β的基因表达水平及肝组织F4/80染色阳性细胞数明显减少(P<0.01),而Nod2△hep组小鼠与Nod2f/f组小鼠炎症因子表达水平无明显改变;进一步对各组肝细胞增殖凋亡情况进行了比较,发现与Nod2f/f模型组相比,Nod2△hep模型组中肝细胞的增殖及凋亡水平下降,而Nod2△hep组小鼠与Nod2f/f组小鼠增殖及凋亡水平无明显改变;Western Blot表达结果表明,Nod2△hep模型组小鼠肝组织中的P38、ERK、JNK、p65以及JAK2/STAT3蛋白磷酸化水平较Nod2f/f模型组明显下降,而Nod2△hep组小鼠与Nod2f/f组小鼠肝组织中相关蛋白磷酸化水平均低于模型组。表明肝NOD2缺失可显著抑制DEN诱导的小鼠肝炎症因子生成和巨噬细胞聚集,减少了肝细胞死亡,有助于减轻肝损伤程度,其机制可能与其下调肝组织NF-κB、MAPK和STAT3信号通路相关因子的表达有关,值得进一步深入研究。

