伊尼妥单抗联合吡咯替尼治疗HER2阳性晚期乳腺癌1例
桂秀娟,赵健丽,汪颖,柴洁,丁林潇潇,姚和瑞
2020年全球乳腺癌新发病例高达226万例,已超过肺癌,成为全球头号癌症[1]。不同类型乳腺癌的生存预后差异较大,HER2(human epidermal growth factor receptor-2,HER2)阳性乳腺癌在所有女性乳腺癌约占四分之一,具有侵袭性强且预后差的特点,成为该领域关注的热点[2]。曲妥珠单抗是第一个HER2靶向药物,显著改善了HER2阳性乳腺癌患者的预后,但是相当一部分患者会出现曲妥珠单抗耐药[3],因此曲妥珠单抗治疗失败后的后线治疗方案成为新的困难与挑战。我们使用ADCC(Antibody-dependent Cellular Cytotoxicity,抗体依赖的细胞介导的细胞毒效应)优化单抗药物“伊尼妥单抗”联合TKI(Tyrosine Kinase Inhibitor,酪氨酸激酶抑制剂)靶向药物“吡咯替尼”及化疗成功治疗一例曲妥珠单抗原发耐药的HER2阳性晚期乳腺癌病例,现报告如下。
1 病例资料及诊治过程
患者女,53岁,因“右乳癌术后2年余,发现肝、肺、骨转移1月余”于2020年3月就诊我院。查体:右乳呈游离皮瓣Ⅰ期重建术后改变,可见约10 cm放射状切口,未触及明显肿物;左乳未见异常;双侧腋窝、双侧锁骨上下未触及肿大淋巴结。既往史和家族史无特殊。
1.1 早期病史
患者2018年1月因“发现右乳肿物”行乳腺彩超示:右乳外下肿物(约3.3 cm×1.5 cm),考虑乳腺癌可能(BI-RADS5类)。2018年1月17日行右乳肿物穿刺活检,病理:右侧乳腺浸润性癌,ER(-)、PR(-)、HER2(3+)、ki67(25%+)。2018年1月21日行“右乳腺癌改良根治术+腋窝淋巴结清扫术+双侧腹直肌游离皮瓣移植+Ⅰ期乳房重建术”,术后病理:右乳浸润性导管癌(Ⅲ级),肿块大小约3.5 cm×1.7 cm,右腋窝淋巴结(1/16)见癌转移,可见脉管癌栓;免疫组化:ER(-)、PR(-)、HER2(3+)、ki67(60%+);术后诊断为右乳浸润性导管癌,pT2N1M0 IIB期,HER2阳性型。予AC*4(脂质体阿霉素30 mg/m2+CTX 600 mg/m2,q3w)序贯TH*4(多西他赛100 mg/m2+曲妥珠单抗首次8 mg/kg,后续6 mg/kg,q3w)方案辅助化疗,后续曲妥珠单抗辅助治疗满1年(末次靶向治疗时间为2019年4月),并予右胸壁及右锁骨区放疗,剂量:50 Gy/25F。后患者定期复查。
1.2 复发转移病史
2020年2 月患者因咳嗽伴胸背部疼痛于当地医院行CT检查示:双肺多发病变,转移瘤待排;肝脏转移瘤待排;胸椎多发骨质破坏。2020年3月我院CT示(图1):双肺多发转移瘤并癌性淋巴管炎可能,纵隔及双肺门多发淋巴结转移瘤;肝内多发转移瘤;胸椎多发骨质破坏。乳腺肿瘤指标:CEA,5.3 μg/L;CA-153,653.4 U/mL;CA-125,42.8 U/mL。肝肾功能正常。

图1 胸腹部CT A:双肺多发转移瘤并癌性淋巴管炎可能;B:肝内多发转移瘤,最大径约7.2 cm×4.7 cm
2020年3 月在B超引导下行肝脏肿物穿刺活检,病理(图2):小块肝组织中见一些肿瘤细胞呈巢状或条索状浸润,细胞核大、深染,异型性明显,核分裂像易见。免疫组化:ER(-)、PR(-)、Her-2(3+)、Ki67热点区域约45%(+)、GATA-3(+)、
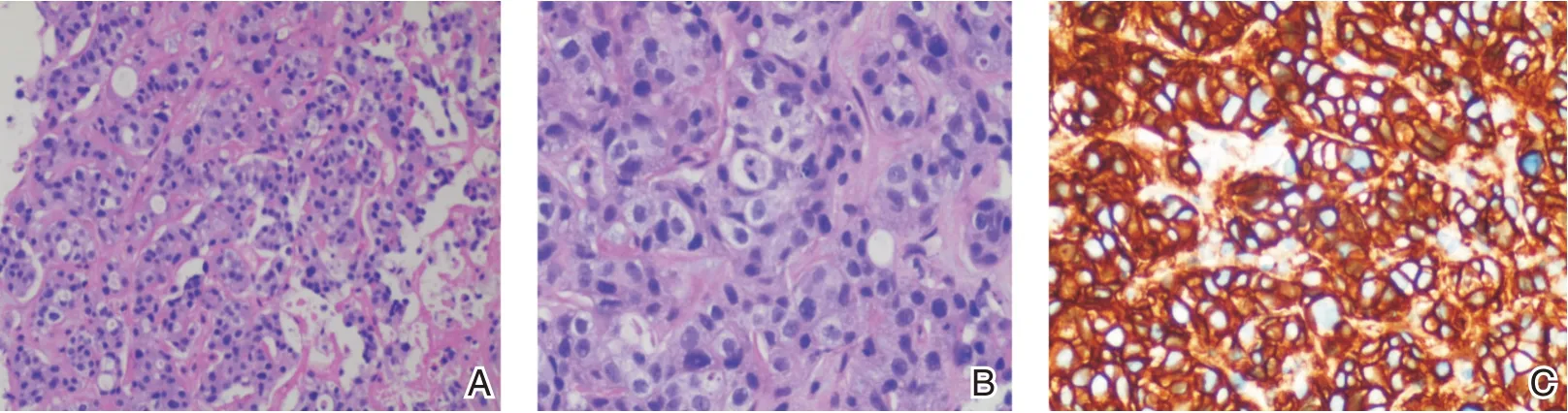
图2 肝组织中见肿瘤细胞呈巢状或条索状浸润,细胞核大、深染,异型性明显(A、B);Her-2免疫组化片显示癌细胞强而完整的膜染色(C)
CA153(+)、Mammaglobin(-)、TTF-1(-)、Hepatocyte(-)、GPC3(-)。结合临床病史,符合乳腺浸润性导管癌转移。综合以上检查,患者诊断为右乳癌术后多发肺、淋巴结、肝、骨转移,IV期,HER2阳性型。患者DFS为25个月。考虑患者既往辅助曲妥珠单抗为原发耐药,遵循各大指南推荐,我们制定了一线治疗方案:吡咯替尼联合卡培他滨。2020年3月患者开始口服吡咯替尼(400 mg/d)联合卡培他滨(1.5g bid d1~d14)方案治疗,同期行唑来膦酸护骨治疗。上述方案治疗2程后,肝脏转移病灶明显减少、缩小(图3),其余病灶同前相仿,整体疗效部分缓解(partail response,PR);5程及8程后评估,肝脏转移病灶持续PR,余病灶仍稳定(图3)。期间瘤标明显下降:CA153,653.4 U/mL→254 U/mL;CA125,42.8 U/mL→20 U/mL。
吡咯替尼联合卡培他滨方案的不良反应:患者第1疗程治疗中出现2级腹泻,吡咯替尼减量至240 mg/d,予止泻、调节肠道菌群等对症处理后好转;第2疗程后吡咯替尼恢复至400 mg/d,后无明显腹泻等不适;患者8个疗程后出现2级手足综合征,整体耐受性可。疗效显著,继续上述方案治疗。
12疗程后(2020年11月)复查CT示肺、肝出现新发转移病灶(图4),肿瘤指标CA153较前升高:254 U/mL→343 U/mL;疗效评估PD。一线PFS为8个月。患者病灶主要在肺部及肝脏,ECOG评分为1分,为吡咯替尼联合卡培他滨治疗后进展。我们制定二线治疗方案:伊尼妥单抗+吡咯替尼+艾立布林。
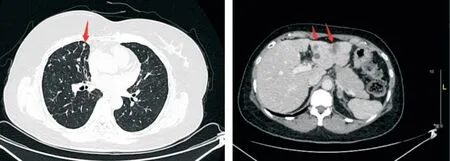
图4 2020年11约胸腹部CT A:双肺转移瘤数量较前增多;B:肝脏多发转移瘤较前增多、增大
患者2020年12月开始予伊尼妥单抗(首次8 mg/kg,后续6 mg/kg)+吡咯替尼(400 mg,qd)+艾立布林(1.4 mg/m2,D1,D8,q3w)方案治疗,同期予唑来膦酸护骨治疗。3程后复查CT(图5)示肺部转移灶数目较前减少,最大病灶较前缩小(1.2 cm→0.5 cm);肝脏转移灶数目较前减少,最大病灶较前明显缩小(4.0 cm×2.6 cm→2.2 cm×1.6 cm),其余病灶同前相仿,疗效PR。6程后评估(图5),肺部转移病灶未见显示;肝脏转移病灶进一步减少、缩小,余病灶仍同前相仿,疗效持续PR。期间肿瘤指标CA153明显下降(图6)。在不良反应方面:主要为Ⅱ度骨髓抑制,1级肝功能异常(ALT:54 U/L,AST:50 U/L),整体耐受性较好。现患者仍在随访中。
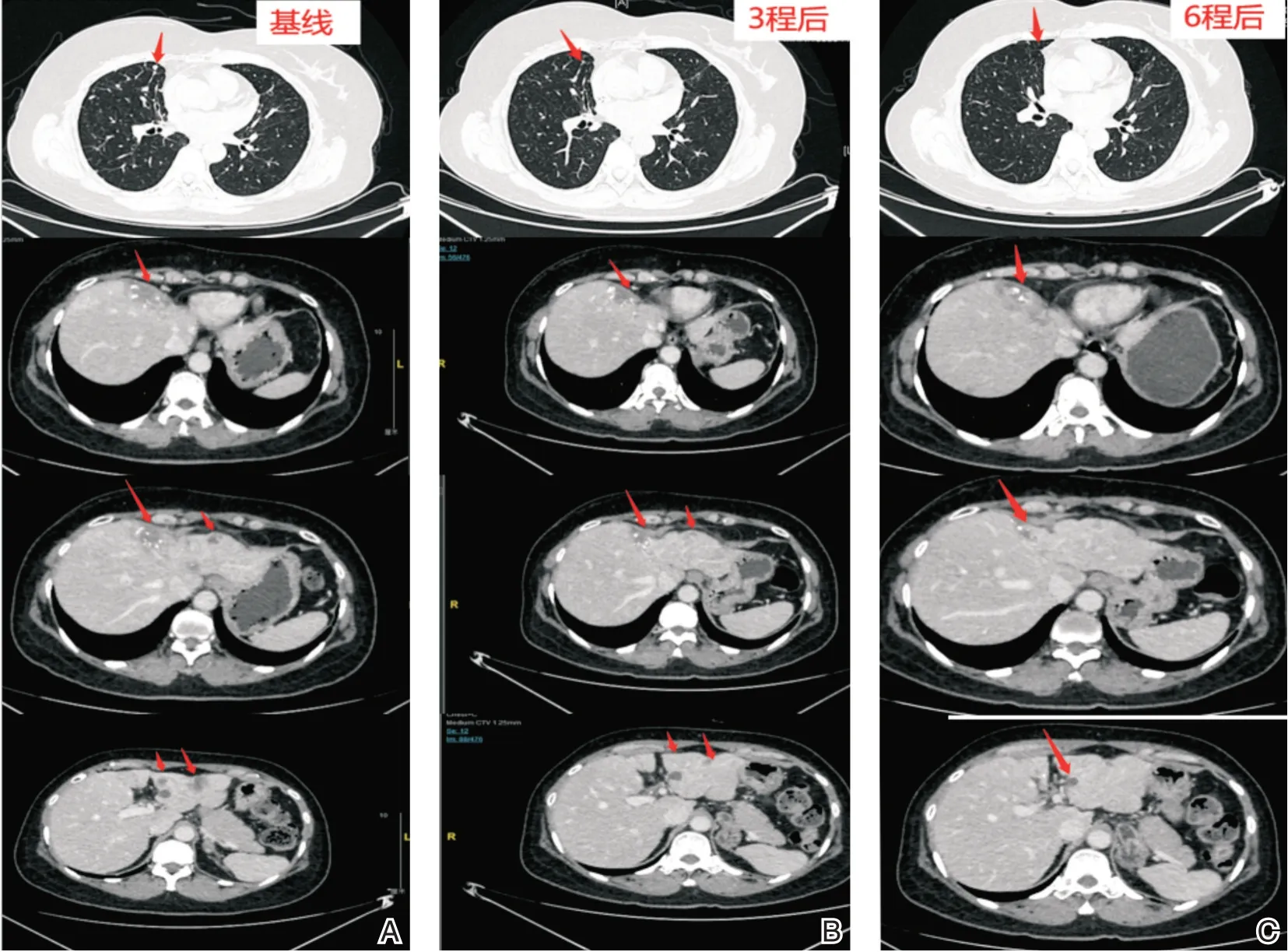
图5 伊尼妥单抗+吡咯替尼+艾立布林治疗期间疗效评估(肺、肝脏多发转移瘤)A:治疗前;B:3程后;C:6程后
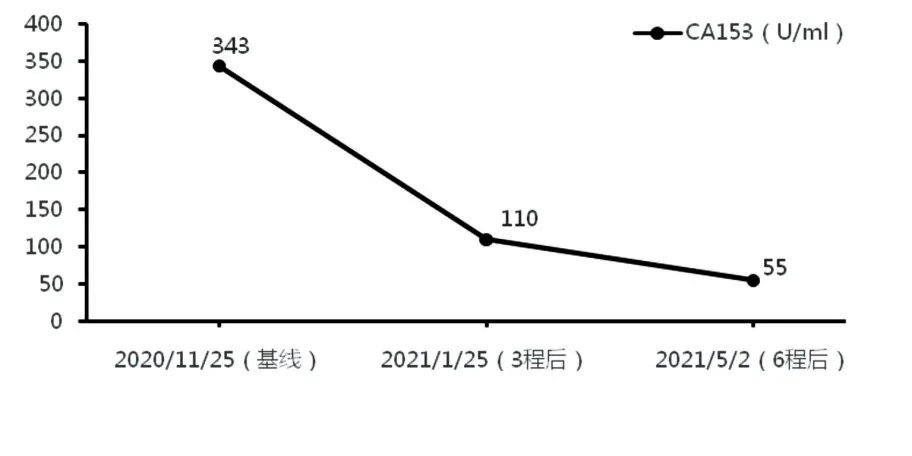
图6 CA153变化趋势图
2 讨论
曲妥珠单抗辅助靶向治疗后1年内出现复发转移为曲妥珠单抗原发耐药[4]。对于曲妥珠单抗原发耐药的患者,CSCO指南建议临床医师遵循晚期二线抗HER2治疗。EMILIA研究[5]证实,相对于卡培他滨+拉帕替尼,单药T-DM1延长了PFS和OS,因此TDM-1是国际上标准的抗HER2二线治疗方案,但由于价格昂贵限制了其国内的应用。中国学者开展的PHENIX研究和PHOEBE研究奠定了吡咯替尼+卡培他滨在HER2阳性晚期乳腺癌的中国标准二线地位,且在PHOEBE研究[6]中入组了部分曲妥珠单抗原发耐药患者(27.6%),亚组分析显示曲妥珠单抗原发耐药患者接受吡咯替尼治疗可延长PFS(HR:0.60)。故我们一线制定了吡咯替尼联合卡培他滨方案,患者接受该方案治疗后最佳疗效达PR,PFS达8个月,毒副反应表现为2级腹泻及手足综合征,整体耐受性可。
患者在吡咯替尼联合卡培他滨治疗基础上再次进展,体力评分良好,抗HER2治疗与化疗联合仍为常用的治疗策略。在2019年美国肿瘤年会ASCO公布了全球第一个ADCC优化药物Margetuximab,其Fab段与曲妥珠单抗完全相同,但Fc段5个位点氨基酸进行了优化修饰,具有比曲妥珠单抗更强的ADCC效应[7]。Sophia研究[8]显示,曲妥珠单抗治疗失败的HER2阳性转移性乳腺癌患者中,更换为Margetuximab比继续曲妥珠单抗可以显著降低24%的疾病进展风险。中国自主研发的第一个优化ADCC单抗药物“伊尼妥单抗”,通过改造抗体的Fc段(FC段重链恒定区第359和361位氨基酸修饰),也显示出优于曲妥珠单抗的疾病控制时间(9.2月vs7.4月),且3级非血液学毒性发生率无明显增高,表现出良好安全性[9]。因此,2020年6月伊尼妥单抗被中国CFDA(NMPA)批准上市,2021年CSCO BC指南也将伊尼妥单抗作为HER2阳性晚期解救方案中的可选药物之一。基础研究显示,TKI靶向药物可以显著提高单抗的ADCC效应[10-12]。艾立布林是一种具有独特作用机制的新型非紫杉类微管蛋白抑制剂,其联合抗HER2靶向治疗研究中取得显著的ORR获益,并且周围神经毒性、骨髓抑制等不良反应发生率低。综上所述,故在二线为患者选择了创新型的治疗模式:伊尼妥单抗+吡咯替尼+艾立布林。治疗6个疗程后,患者肺部转移病灶已未见显示,肝脏转移病灶达到PR,整体疗效为PR,且患者未出现Ⅲ级及以上不良反应,生活质量得到保障。
“ADCC优化单抗伊尼妥单抗+TKI吡咯替尼+化疗”的治疗模式可望是未来HER2阳性乳腺癌治疗的又一个强大方案,其疗效可期。当然,临床实践的优越疗效需要基础数据作为支撑,伊尼妥单抗与吡咯替尼之间存在何种协同效应,何种化疗药是该双靶方案的最佳组合,仍需进行机制上的探索。

