超声引导下经皮微波消融与手术切除治疗原发性肝癌的疗效比较
乔谦,蒋晨杉,吴鸣宇,周锋盛,蒋骁,蔡兵(南京医科大学附属无锡人民医院,江苏 无锡 214200)
目前肝癌仍然是严重影响我国居民身心健康的常见恶性肿瘤[1]。肝癌的治疗方式主要包括:消融术、肝动脉化疗栓塞术、外科手术切除及肝移植等[2]。外科手术切除(surgical resection,SR)仍是治疗肝癌的首选方式。然而,由于患者严重的伴随疾病及肿瘤解剖因素等原因,有部分患者无法接受手术切除[3]。微波消融术(Microwave ablation,MWA)具有创伤小、无需气管插管全身麻醉、术后恢复快等优点,现已在临床开展用于治疗肝癌[4]。本研究观察MWA和SR治疗原发性肝癌的疗效及预后分析,以期为MWA的临床应用提供指导,现报道如下。
1 资料与方法
1.1 一般资料 选择2017年1月-2020年12月在无锡市人民医院接受治疗的原发性肝癌患者。入选标准:①根据临床症状,实验室检查及影像学检查,诊断为原发性肝癌;②选择超声引导下MWA或外科手术切除;③中国的肝癌分期方案(China livercancer staging,CNLC)Ⅰa期及部分Ⅰb期;④Child-Pugh分级A或B;⑤具有完整的临床资料及随访信息。排除标准:①肿瘤侵犯大血管、胆管和邻近器官;②肿瘤远处转移;③具有严重基础疾病,不能耐受治疗;④临床资料不完整或失访。共有107例患者纳入研究,分为MWA组(n=56)和SR组(n=51)。
1.2 方法 所有患者经由肝胆外科、影像科、超声医学科、肿瘤科组成的多学科讨论后,制定方案。MWA组:术前完善相关检查,治疗由同一组医生完成。患者取合适体位,常规术区消毒、铺巾,在局部浸润麻醉或联合静脉麻醉后,在超声实时引导下将MWA针穿刺进入肿瘤,根据肿瘤大小选择输出功率(60-100W),消融至肿瘤边缘5mm癌旁组织,消融完毕后注意碳化针道。根据患者肿瘤位置,必要时建立人工腹水。SR组:所有患者均由同一组外科医生手术,麻醉成功后,常规消毒铺巾,均行开腹手术,进腹后分离肝周韧带,视病情决定是否行第一肝门阻断,遇血管及胆管时予以结扎,完整切除肿瘤,并保证切缘距肿瘤边缘大于2cm。
1.3 信息采集 由两名研究者收集两组患者性别,年龄,肿瘤部位、大小及数目,术前肝功能指标,AFP水平,乙肝病毒指标,影像学资料,Child-pugh分级,CNLC分期,术后并发症(包括疼痛、腹腔出血、发热、胆漏),术后肝功能等指标。
1.4 随访 采用电话随访及复诊等方式,对两组患者进行随访。了解患者的生存情况、生存时间、是否复发转移。
1.5 统计学方法 采用SPSS22.0软件进行统计分析。服从正态分布的计量资料用中位数表示,组间比较采用mann-whitney检验。计数资料用率[n(%)]表示,采用卡方检验。采用Kaplan-Meier和Cox回归分析影响原发性肝癌患者总生存时间的相关因素。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者基本情况比较 两组患者在年龄、性别、乙肝病毒感染、Child-Pugh分级、CNLC分期、术前肝功能、AFP水平方面比较,差异无统计学意义(P>0.05)。两组患者肿瘤位置比较显示,MWA组肿瘤位于左叶13例,右叶者33例,两叶均有10例;SR组肿瘤位于左叶10例,右叶者34例,两叶均有7例,两组比较,差异无统计学意义(P>0.05)。MWA组患者有40例为单发肿瘤,16例为多发肿瘤;SR组患者有46例为单发肿瘤,5例为多发肿瘤,两组比较,差异有统计学意义(P<0.05)。MWA组肿瘤直径9-120mm,SR组患者肿瘤直径9-112mm,两组比较,差异有统计学意义(P<0.05)。见表1。
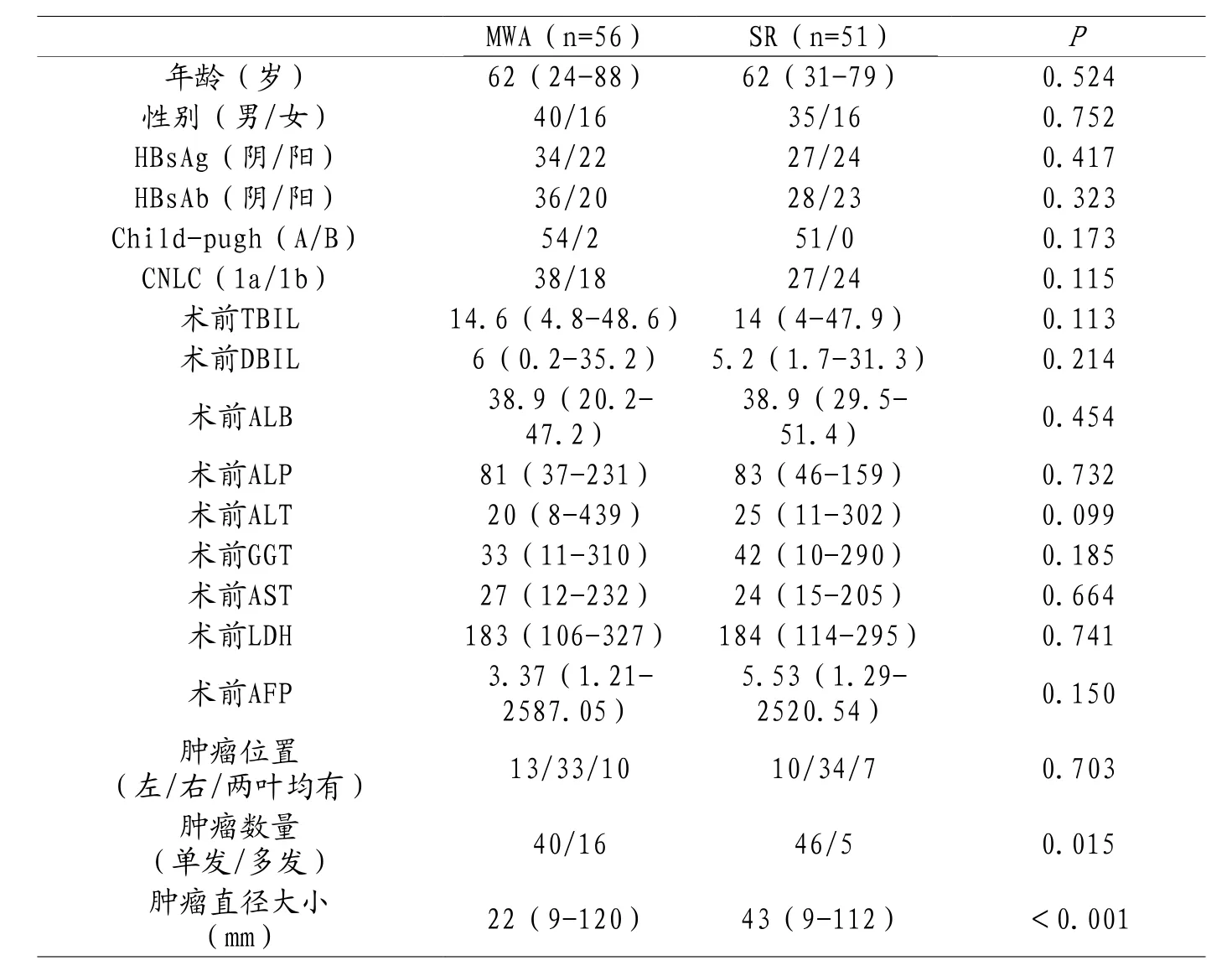
表1 两组患者术前基本情况比较
2.2 两组患者术后肝功能、AFP水平比较 比较两组患者术后TBIL、DBIL、ALB、ALP、ALT、GGT、AST、LDH、AFP。结果显示,两组患者均有不同程度的肝功能损伤,其中SR组患者术后LDH高于MWA组,差异有统计学意义(P<0.05)。见表2。
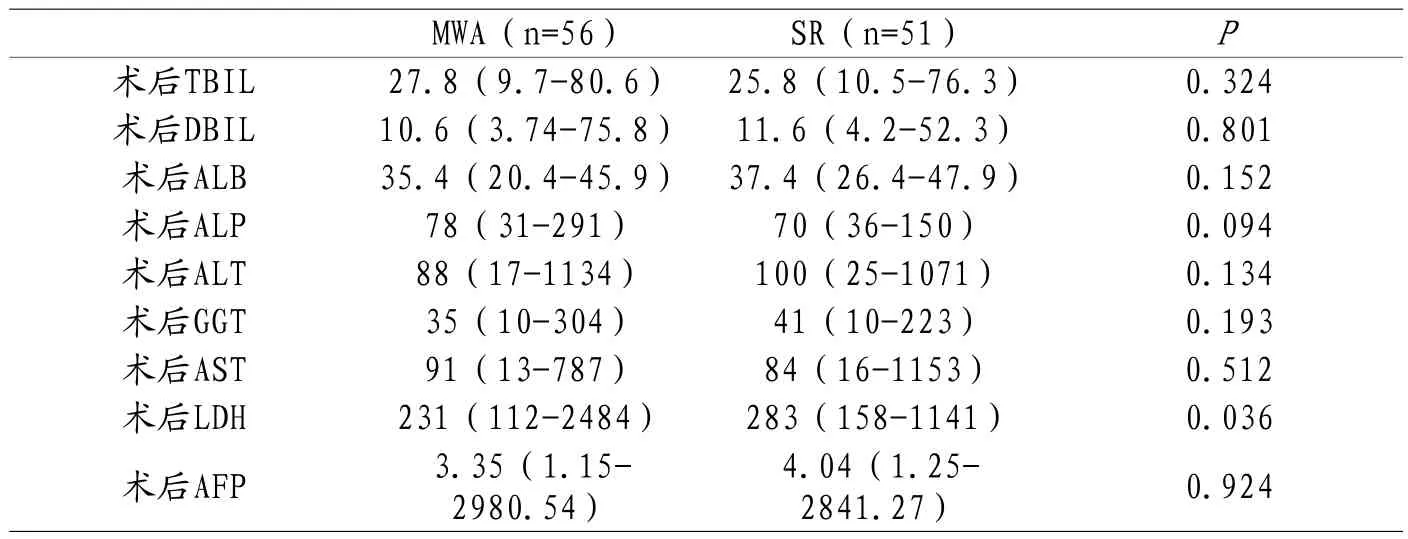
表2 两组患者术后肝功能及AFP水平比较
2.3 两组患者术后凝血功能比较 SR组患者术后PT为13.1s,较MWA组显著延长;SR组患者术后INR大于MWA组术后INR,差异有统计学意义(P<0.05)。见表3。
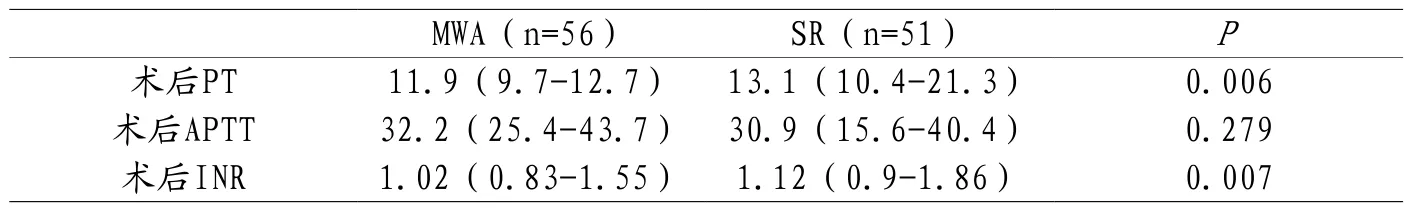
表3 两组患者术后凝血功能比较
2.4 两组患者手术相关并发症比较 SR组患者术后疼痛发生率显著高于MWA组(P<0.05),且疼痛程度重。SR组患者术后有2例腹腔出血,MWA组有1例;两组患者术后均有患者出现发热,两组患者均未出现术后胆漏;两组患者术后腹腔出血、发热、胆漏的比较,差异无统计学意义(P>0.05)。见表4。
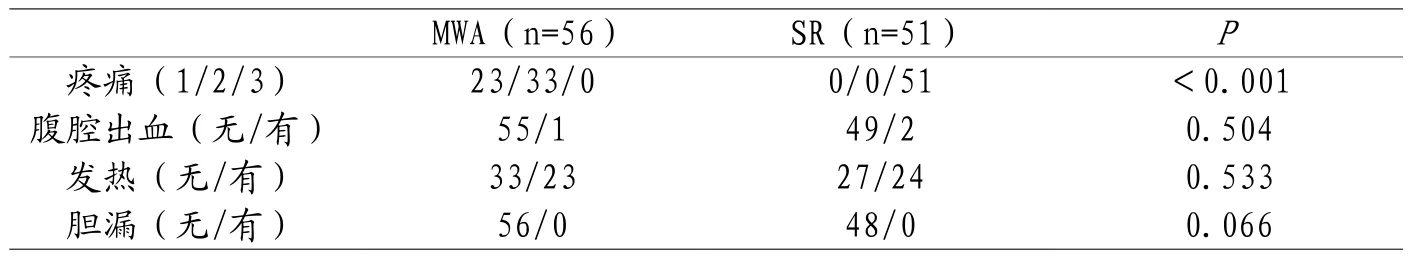
表4 两组患者术后并发症比较
2.5 两组患者术后生存率比较 MWA组患者半年、1年、2年的生存率分别为98.2%、89.3%、53.6%;SR组患者半年、1年、2年的生存率分别为100%、92.2%、58.8%,两组患者生存率比较,差异无统计学意义(P=0.681)。见图1。
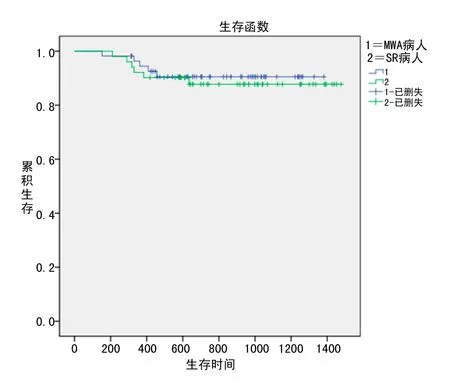
图1 两组患者术后生存率分析
2.6 两组患者术前及术后预后影响的因素分析 分别分析两组患者基本情况、术前及术后肝功能指标,肿瘤情况等对预后的影响,结果显示,MWA组患者术前肿瘤多发为预后差的影响因素。见表5。SR组患者肿瘤直径及术前LDH为危险因素,肿瘤越大,预后越差,术前LDH越高,预后越差。见表6。
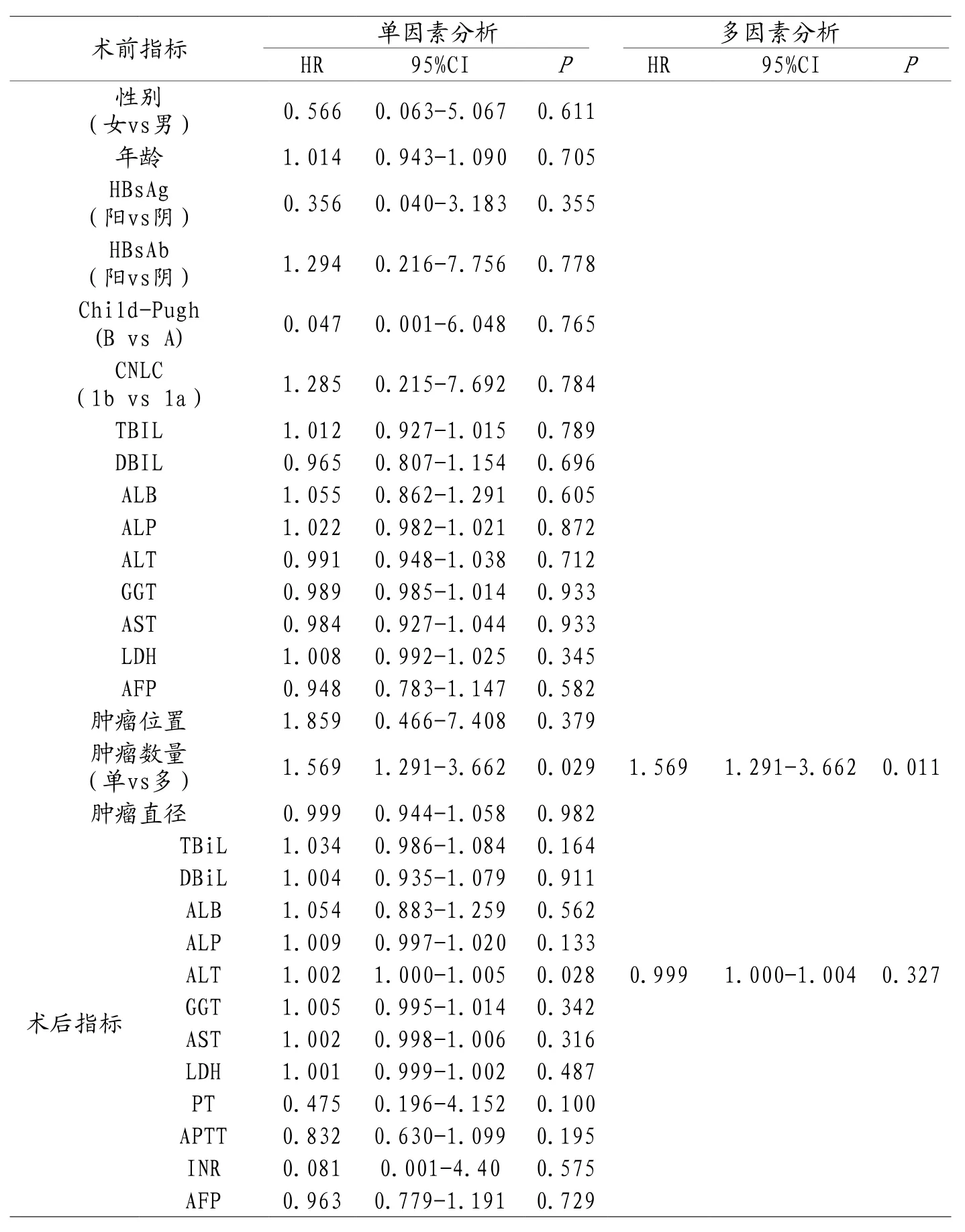
表5 MWA组患者单因素及多因素生存模型
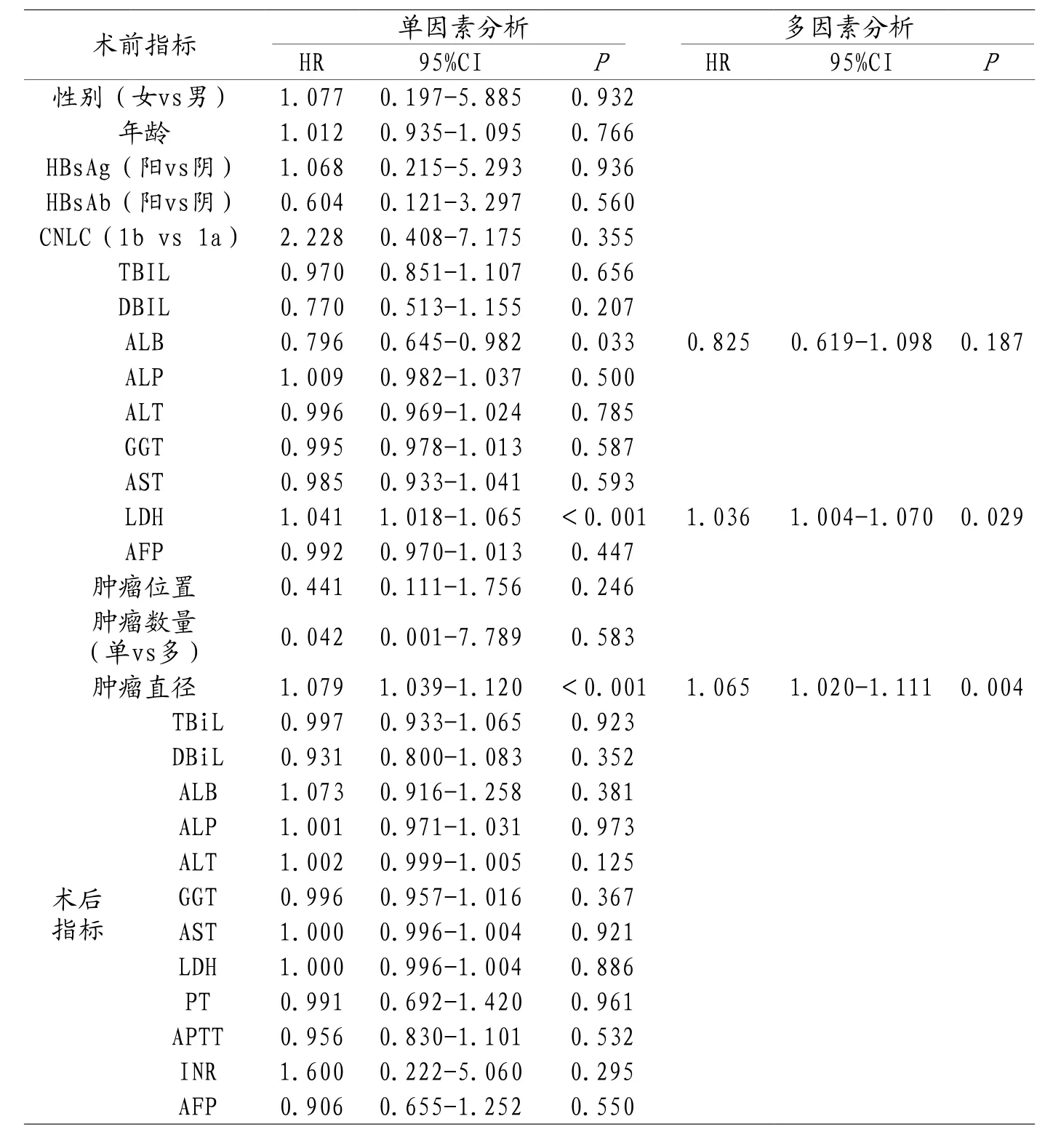
表6 SR组患者单因素及多因素生存模型
3 讨论
肝细胞癌是一种病因复杂,发病率高和死亡率高的恶性肿瘤。随着医学技术的发展,肝癌的治疗模式已发展为包括:肝切除术、肝移植术、局部消融治疗、TACE、放射治疗、全身治疗等多种治疗手段的多学科治疗,治疗技术也日趋微创化。有研究已经证实微波消融术(MWA)是治疗不能切除的肝脏恶性肿瘤的有效方法,包括原发性和转移性肿瘤[5-6]。中国原发性肝癌诊断和治疗指南(2019年版)指出,对于单发性肝癌患者肿瘤大小≤5cm或肿瘤数≤3个且每个≤3cm,外科手术(SR)和MWA均适用。因MWA具有创伤小、恢复快及疗效显著等优点[7],越来越多的原发性肝癌患者更倾向于选择MWA进行治疗。
本研究回顾性比较SR和MWA治疗CNLC Ia/Ib期原发性肝癌的疗效。经统计学分析,两组患者术前生物学指标无显著性差异。在肝功能方面,SR患者术后LDH(P=0.036)水平升高,表明在SR治疗过程中,切除肿瘤肿块时对癌旁正常肝组织会造成不可避免的损害[8]。MWA治疗时,微波将热能转移到靶区,仅对周围肝组织造成轻微的热损伤。相对而言,MWA手术更能保护患者正常肝组织。
本研究比较了两组患者术后并发症情况,MWA组中23例患者术后疼痛等级为1级,其他33例患者术后疼痛等级为2级,而所有SR患者术后疼痛等级均为3级(P<0.001)。SR组患者术后均应用镇痛泵。MWA组患者术后有23例(41.1%)出现发热,低于SR组的24例(47.1%)。发热是MWA组患者术后常见并发症之一,尤其是多点消融的患者,微波对肿瘤及肿瘤周围组织的破坏,导致大量坏死物质吸收,炎症因子释放,引起发热,部分患者还可能出现肝脓肿,必要时需结合影像学检查,如考虑细菌感染引起发热,需应用抗生素治疗[9]。
肝癌的治疗效果一直是具有争议的话题。Leung[10]等人报道,MWA治疗后恶性肝肿瘤的复发率为8%。根据《中国原发性肝癌诊治指南》,对于bclc Ia/Ib原发性肝癌,MWA和SR均适用。特别是对于早期肝癌可手术切除的患者,MWA可达到根治性治疗,应作为一线治疗。然而,MWA和SR在治疗效果上是否存在差异仍存在激烈的争论。本研究旨在评价MWA和SR治疗CNLC Ia/Ib期原发性肝癌的疗效。结果显示,MWA组患者半年、1年、2年的生存率分别为98.2%、89.3%、53.6%;SR组患者半年、1年、2年的生存率分别为100%、92.2%、58.8%。Kaplan-Meier生存曲线显示对于CNLC Ia/Ib期的HCC患者,SR与MWA的治疗选择对患者的生存无显著影响(P=0.681)。本研究还进一步探讨了与生存率相关的影响因素。由于两组术后参数有显著性差异,分别对MWA队列和SR队列参数进行分析,建立了单变量和多变量Cox回归模型。MWA组单变量Cox模型显示肿瘤数量(P=0.029)、术后ALT水平(P=0.028)与术后生存率相关。为验证混杂效应,拟合了多变量混合效应模型。在MWA多变量模型中,只有肿瘤数目(P=0.011)和生存率下降相关,提示多发性肿瘤病变是生存率下降的预后因素。有研究也证实,多发性肿瘤的存在是生存率下降的危险因素[11]。SR组患者单因素分析显示术前ALB(P=0.033)、术前LDH(P<0.001)、肿瘤直径(P<0.001)为影响预后的因素,多因素分析提示术前LDH(P=0.029)、肿瘤直径(P=0.004)为预测参数。本研究显示,高LDH水平是患者生存期短的危险因素。LDH常在急性肝炎、慢性活动性肝炎中升高,在肝癌尤其是转移性肝癌中可显著升高,相关研究证实高LDH水平的肝癌患者生存期明显缩短[12]。对于SR患者,首先确定的预后因素是肿瘤直径。众所周知,肝癌的主要转移方式是肝内转移,因此肿瘤直径较大的患者通常处于肝癌晚期。有研究指出,肿瘤直径≥10cm是一个行根治性切除术后肿瘤远处复发转移的独立危险因素[13]。
本研究的不足之处为回顾性分析、随访时间较短、样本量小以及缺乏关于失访患者的信息。笔者认为需要进行匹配良好的多中心研究,以进一步探讨MWA在肝癌治疗中的作用。
作者贡献声明:乔谦、蔡兵对研究的思路或设计有关键贡献,蒋晨杉、周锋盛、蒋骁参与了研究数据的获取分析解释过程,乔谦、蒋晨杉、蔡兵参与起草或修改文章关键内容。

