锰胁迫对红锥幼苗生长和生理指标的影响
梁艳红,滕维超
(广西大学 林学院,广西南宁 530004)
锰(Mn)矿是一种重要的战略资源。我国锰矿已有100多年的开采历史,分布分散,露天储存的锰渣体量巨大,长期开采锰矿残余的重金属严重污染土地,影响植物的正常生长[1]。红锥(Castanopsis hystrix)为壳斗科(Fagaceae)栲属常绿乔木,广泛分布在我国南方[2]。其材质优良、易加工且耐腐蚀能力强,具有较高的生态和经济价值。Mn对植物的光合放氧及维持细胞器结构和酶活性具有不可替代的作用,但过量的Mn会抑制植物体内FeD2+和MgD2+等元素的吸收及活性,导致叶绿素含量下降及光合速率降低[3]。我国土壤全Mn 含量为42 ~ 5 000 ppm,平均含量为710 ppm。研究表明0.25 mmol∕L Mn 会导致柑橘(Citrus reticulata)、降香黄檀(Dalber⁃gia odorifera)等树种出现Mn 中毒症状,叶片细胞膜受损,相对电导率和丙二醛(MDA)含量上升[4-5]。关于Mn 胁迫对红锥的影响尚未有报道。本研究通过分析不同Mn 添加量对红锥幼苗生长和生理活动的影响,研究红锥对Mn 胁迫的响应,为高Mn 环境下红锥的栽培及推广提供科学指导。
1 材料与方法
1.1 试验地概况
试验地位于广西壮族自治区广西大学林学院苗圃教学实习基地(108°17'E,22°50'N),属亚热带气候;年均气温21.6 ℃,冬季最低温度12.8 ℃,年均降水量1 304.2 mm,年均相对湿度79%。
1.2 试验材料
材料为生长条件良好、生长状态基本一致的0.5年生红锥幼苗,平均株高35.5 cm,平均地径4.6 mm。2020年7月1日,将幼苗移至半径为12.5 cm 带孔营养钵中,每钵土重5 kg。移栽后,幼苗在温度24 ℃、相对湿度81%条件下统一管理。土壤来源于广西大学东校园苗圃内,土壤基本理化性质为pH 5.2,有机质 含 量27.13 g∕kg,全氮含量0.67 g∕kg,全磷含量0.16 g∕kg,全钾含量14.99 g∕kg,全Mn含量156.08 mg∕kg,铵态氮含量5.62 mg∕kg,硝态氮含量4.71 mg∕kg,速效磷含量4.90 mg∕kg和速效钾含量27.14 mg∕kg。
1.3 试验设计
设置5 个不同Mn 添加量(每千克土壤中所含Mn 元素质量),分别为0(CK)、200 mg∕kg(T1)、600 mg∕kg(T2)、1 500 mg∕kg(T3)和3 000 mg∕kg(T4)。2020年8月5日、8月15日、8月25日、9月5日、9月15日和9月25日,对5 个处理的植物分别施加清水及5.12、15.36、38.41 和76.82 g∕L 的MnSO4·H2O 溶液,共100 mL,共6次,使土壤中Mn添加量达到各处理要求。钵底放置容器,收集流出的液体并重新淋入土中。每浓度设置3 个重复,每重复设置5 钵(1株∕钵)。胁迫前(8月5日)和胁迫结束120 天(12月29日),测量并记录幼苗的株高和地径;采集植株叶片,测定各项生理指标。
1.4 指标测定
采用卷尺测量株高(精确至0.01 cm);采用游标卡尺测量地径(精确至0.01 mm)。超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、抗坏血酸过氧化物酶(APX)活性和MDA 含量测定参照文献[6];可溶性糖和可溶性蛋白含量测定参照文献[7]。
1.5 数据处理
采用Excel 软件进行数据整理、统计和制作图表;采用SPSS 19.0软件进行方差分析、多重比较;对各生理指标进行皮尔逊相关系数双变量分析。
2 结果与分析
2.1 不同处理对幼苗株高和地径的影响
T1、T2 和T3 处理的株高均显著大于CK(P<0.05),分别比CK 高出42.11%、20.27%和32.78%,T1处理的株高最大(19.98 cm);T4处理的株高与CK差异不显著(图1)。T1、T3 和T4 处理的地径均显著大于CK(P<0.05),分别比CK 高出18.81%、24.72%和8.96%,T3 处理的地径最大(2.26 mm);T2 处理的地径与CK差异不显著。

图1 不同处理对幼苗株高和地径的影响Fig.1 Effects of different treatments on seedling height and ground diameters of young seedling
2.2 不同处理对幼苗可溶性蛋白和可溶性糖含量的影响
随土壤中Mn 添加量升高,可溶性糖和可溶性蛋白含量呈先上升后下降的趋势(图2)。T1 和T2处理的可溶性糖含量均与CK 均差异不显著;T3 和T4 处理的可溶性糖含量均显著低于CK(P<0.05),分别比CK 低26.63%和26.28% 。T3 处理的可溶性蛋白含量显著高于CK(P<0.05),比CK 高 出117.15%;其他处理与CK均差异不显著。
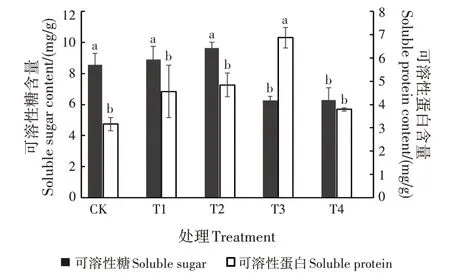
图2 不同处理对幼苗可溶性糖和可溶性蛋白含量的影响Fig.2 Effects of different treatments on contents of soluble sugar and soluble protein of young seedling
2.3 不同处理对幼苗抗氧化生理指标的影响
随土壤中Mn添加量升高,SOD活性呈先下降后上升的趋势,APX 活性逐渐降低,POD 和CAT 活性呈先上升后下降的趋势(图3 ~ 4)。T1、T2 和T3 处理的SOD 活性均显著低于CK(P<0.05),分别比CK低18.54%、14.15%和10.02%,T1处理的SOD活性最低(552.11 U∕g);T4 处理的SOD 活性与CK 差异不显著。各处理的APX 活性均显著低于CK(P<0.05),分别比CK 低46.73%、64.76%、74.16%和77.62%;T4处理的APX 活性最低(65.35 U·g-1·min-1)。 T1 和T2 处理的POD 活性较高,与CK 均差异不显著;T3和T4处理的POD 活性均显著低于CK(P<0.05),分别比CK 低69.07%和54.28%。T2、T3 和T4 处理的CAT活性均显著高于CK(P<0.05),分别比CK 高出531.27%、328.86%和385.40%,T2 处理的CAT 活性最大(129.08 U·g-1·min-1);T1 处理的CAT 活性最低,与CK差异不显著。

图3 不同处理对幼苗SOD和APX活性的影响Fig.3 Effects of different treatments on SOD activity and APX activitiy of young seedling
2.4 不同处理对幼苗MDA含量的影响
随土壤中Mn添加量升高,MDA含量逐渐增加(图5)。各处理的MDA含量均显著高于CK(P<0.05),分别比CK 高出47.19%、49.15%、88.55%和109.30%,T4处理的MDA含量最大(0.11 μmol∕L)(图5)。
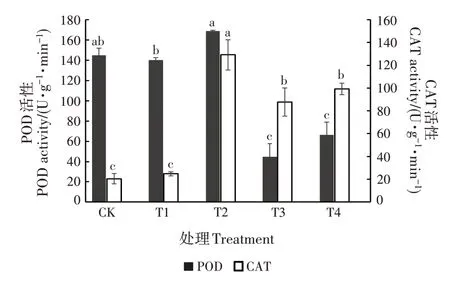
图4 不同处理对幼苗POD和CAT活性的影响Fig.4 Effects of different treatments on POD activity and CAT activitiy of young seedling

图5 不同处理对幼苗MDA含量的影响Fig.5 Effects of different treatments on MDA content of young seedling
2.5 相关性分析
POD 活性与可溶性糖含量呈极显著正相关(P<0.01),与APX 活性呈显著正相关(P<0.05),与MDA 含量呈极显著负相关(P<0.01)(表1)。MDA 含量与CAT 活性呈显著正相关(P<0.05),与APX 活性呈极显著负相关(P<0.01)。APX 活性与CAT活性呈极显著负相关(P<0.01)。
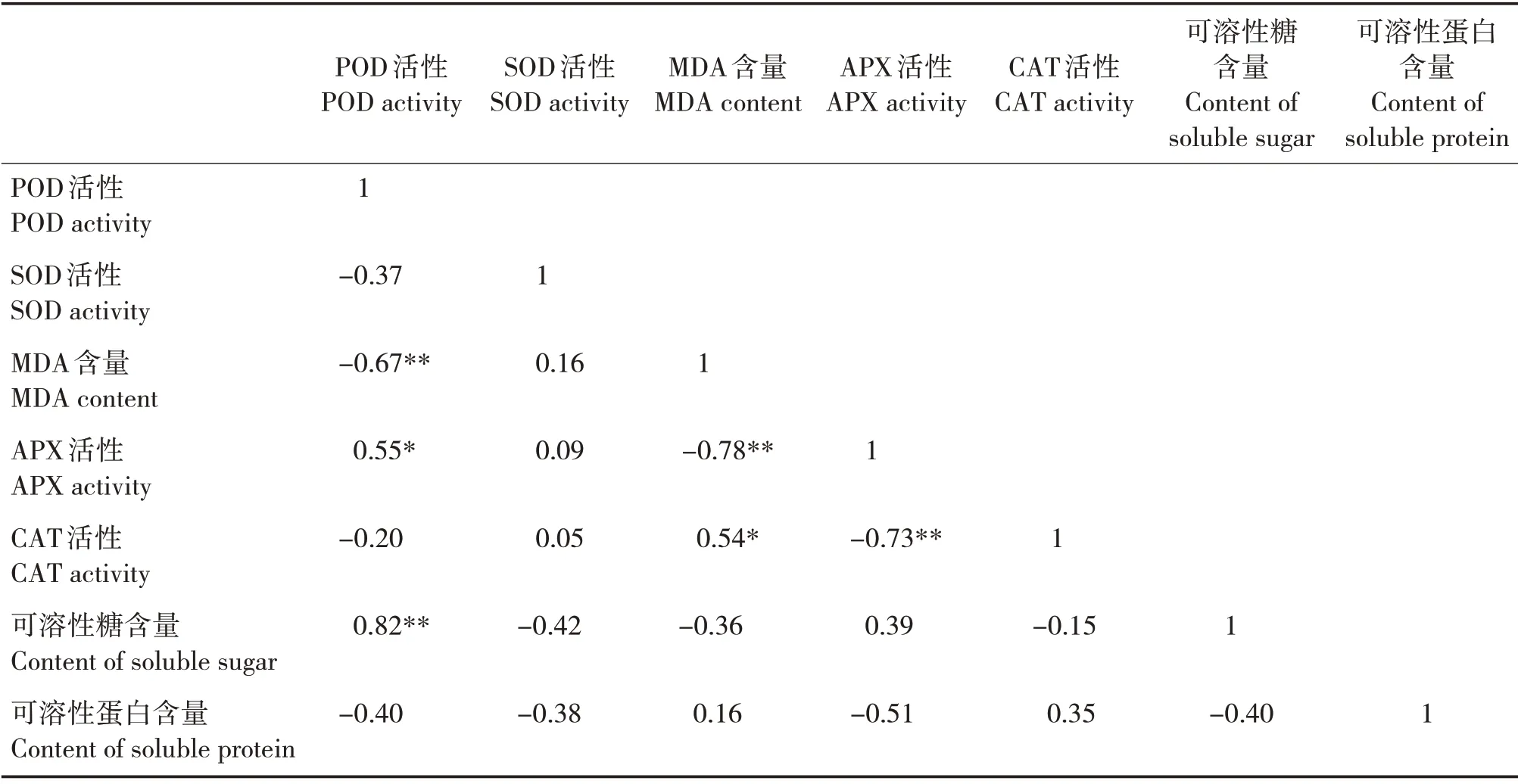
表1 相关分析Tab.1 Correlation analysis
3 结论与讨论
Mn 是植物生长所必需的微量元素,适量的Mn维护植株正常生长[8];过量的Mn 会对植物生长产生胁迫[9]。本试验中,Mn 添加量为200 ~ 1 500 mg∕kg时,株高和地径大于CK;Mn 添加量为3 000 mg∕kg时,株高和地径略高于CK,可能是因为3 000 mg∕kg Mn 在120 天内对幼苗生长指标的影响尚未完全表现出来,可能日后将导致株高和地径小于CK。
可溶性糖含量反映植物体内碳水化合物的合成、转化和代谢的变化情况,提高可溶性糖含量能提升植物细胞膜的渗透调节响应,增强植物对不良环境的承受能力[10-11]。本研究中,Mn 添加量为200 ~600 mg∕kg时,可溶性糖含量比CK 略大,表明作为植物生长所需的微量元素,低含量Mn 可加快淀粉和其他碳水化合物的分解和利用,使光合作用形成的产物直接变为低分子量物质,使可溶性糖含量有所提高[3]。Mn 添加量高于1 500 mg∕kg 时,可溶性糖含量显著降低,可能是高含量Mn 对植物生长产生胁迫,导致碳水化合物合成受阻,使可溶性糖含量显著降低。重金属胁迫导致植物细胞内外渗透液平衡遭受破坏,可溶性蛋白在植物体内迅速积累,在一定程度内维持细胞内外渗透液水平[12-13]。本研究中,随土壤中Mn 添加量升高,可溶性蛋白含量先上升后下降。Mn 添加量为1 500 mg∕kg 时,可溶性蛋白含量最大,说明红锥幼苗在受到高含量Mn 处理时,会迅速产生和积累可溶性蛋白;Mn 添加量为3 000 mg∕kg 时,可溶性蛋白含量下降,此时细胞内外渗透液平衡遭到破坏。当Mn 添加量为1 500 mg∕kg时,可溶性糖含量减少而可溶性蛋白增加,说明可溶性糖和可溶性蛋白可能在一定程度上协同维持红锥叶片细胞内外渗透液水平。
高Mn 含量造成植物体内大量累积活性氧,使细胞被破坏,植物为抵抗伤害形成了一套严密的氧化保护机制系统[14]。植物遭受逆境胁迫时,活性氧簇(O2-、-OH 或H2O2)迅速形成和积累,激发植物体内信号提示的应答反应[15]。SOD 能清除植物机体内的O2-[16],其在催化、歧化O2-的反应中所形成的H2O2具有强氧化性,过量的H2O2可由CAT、POD 和APX清除[17]。本研究中,随Mn 添加量升高,SOD 活性先降低后上升,在Mn添加量为200 mg∕kg时,SOD活性最低,可能是因为在低Mn 含量下,SOD 保护体系并未激活[18],随Mn添加量增加,SOD 活性逐渐升高,缓解细胞遭受的氧化作用,这与前人研究所得到的结论相似[19]。本研究中,Mn添加量为600~3 000 mg∕kg时,CAT 活性显著高于CK,大量的CAT 可将H2O2分解成H2O 和O2,进一步缓解幼苗所遭受的氧化作用[20]。POD 活性的变化趋势与CAT活性相反,在Mn添加量高于600 mg∕kg 时,POD 活性显著低于CK。相关分析也表明,CAT 活性与POD 活性呈负相关。说明Mn 添加量低于600 mg∕kg 时,主要由POD 分解过多的H2O2;Mn 添加量高于600 mg∕kg 时,主要由CAT 分解H2O2,两者在红锥体内协同配合。APX 具有各种同功酶,APX 清除H2O2的过程需以还原型抗坏血酸(AsA)为底物[21]。本研究中,随Mn 添加量升高,APX 活性不断下降,说明APX 可能不是清除H2O2的主要途径,植物体还可通过AsA 直接与H2O2发生反应并将其清除[22]。MDA 是细胞膜脂质过氧化作用和氧化变质的最重要的产物之一[23]。随Mn添加量升高,叶片细胞膜质过氧化程度逐渐升高,幼苗叶片MDA含量逐渐上升。
本研究仅分析不同Mn 添加量下红锥部分生理及生长指标的变化情况。在今后的研究中,可对红锥在更高Mn 添加量土壤中的生长和生理指标进行研究,补充其他生理指标并分析各指标间的相关性,完善重金属胁迫下红锥内部抗氧化系统调节机制。

