受体相互作用蛋白激酶1基因表达下调抑制骨肉瘤细胞增殖活性及其机制研究
李彦华,马红帅,田 青,韩奇财
(郑州大学第一附属医院骨科,河南 郑州 450052)
骨肉瘤是一种高度侵袭性的原发性骨恶性肿瘤,高发于儿童和青少年。主要治疗手段是新辅助化疗+手术+术后化疗,但患者往往对化疗不敏感,容易发生肺部转移,预后差。因此,针对骨肉瘤寻找有效的治疗靶点以及药物十分重要[1-2]。受体相互作用蛋白激酶1(receptor-interacting protein kinase 1, RIPK1)在细胞命运的抉择中发挥重要的调控作用,已逐渐成为多种疾病治疗的有效靶点之一[3]。但RIPK1对骨肉瘤细胞增殖、侵袭及死亡等生物活性是否具有调整作用,尚不清楚。本研究拟通过小干扰核糖核酸(small interference ribonucleic acid,siRNA)干扰骨肉瘤细胞中RIPK1的表达,检测RIPK1对骨肉瘤细胞增殖、侵袭及死亡等生物功能的影响,明确RIPK1对骨肉瘤细胞生物活性的调控作用及机制。
1 资料与方法
1.1 材料骨肉瘤MG63细胞株购自上海中科院细胞库。DMEM培养基、胎牛血清购自美国Gibco公司;CCK-8细胞增殖/毒性检测试剂盒购自日本同仁化学研究所;细胞凋亡试剂盒购自江苏凯基生物技术股份有限公司;增强型化学发光试剂盒购自美国Thermo Fisher Scientific公司;RIPK1、Cleaved caspase-3、p-RIPK3、RIPK3、磷酸化混合系列蛋白激酶样结构域(phosphorylated-mixed lineage kinase domain-like,p-MLKL)、β-actin单克隆抗体购自美国Abcam公司;酶标仪购自美国BioTeck公司;倒置相差显微镜购自德国Leica公司;流式细胞仪购自美国Becton Dickinson公司;Lipofectamine 3000购自美国Invitrogen公司。
1.2 细胞培养将骨肉瘤MG63细胞株,以1×106个细胞接种于DMEM/F12完全培养基中,37 ℃、体积分数5% CO2进行培养。每3 d换液1次。细胞融合率达到80%,用含质量分数0.1%乙二胺四乙酸的胰酶消化细胞,传代,进行后续实验。
1.3 应用siRNA转染抑制RIPK1的表达设计3对针对骨肉瘤MG63细胞株的siRIPK1引物5’-GGAATATGAGTGATATGATdTdT-3’,5’-AUUGAUUCGGAGACUAUACdTdT-3’;5’-GAACCUGAUTAAAGCAGGAdTdT-3’,5’-CUACGAACUUAGGGCAGUCdTdT-3’; 5’-GAGCACGAAGCAGTAGCTGAdTdT-3’,5’-GGCUGUCAAGCUGCdTdT-3’。以上引物均由广州锐博科技有限工作合成。使用Lipofectamine 3000瞬时转染骨肉瘤细胞。转染72 h后检测RIPK1的表达。
1.4 细胞形态学观察siRNA干预骨肉瘤细胞3 d后,倒置相差显微镜观察细胞生长、形态变化,判断细胞活性和增殖变化。
1.5 CCK-8细胞增殖定量分析细胞干预完毕后,向每孔加入20 μL CCK8溶液,将培养板在培养箱内孵育2 h;用酶标仪测定在450 nm处的吸光度。
1.6 流式细胞仪检测细胞凋亡将细胞以1×106个/L的细胞浓度接种于6孔板,细胞贴壁,干预;收集细胞,磷酸缓冲盐溶液洗涤2次,分别加入195 μL Annexin V-FITC结合液、5 μL Annexin V-FITC和5 μL碘化丙锭染色液,轻轻混匀;室温,避光孵育20 min;随后置于冰浴中;然后流式细胞仪上机检测。
1.7 Western blot检测蛋白表达收集完细胞后,裂解液裂解细胞,提取细胞总蛋白。RIPK1、Cleaved caspase-3、p-RIPK3、RIPK3、p-MLKL检测参照课题组既往操作流程进行,将电泳产物转聚偏二氟乙烯膜,体积分数5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,洗膜10 min×4次,二抗常温孵育2 h,洗膜10 min×4次,增强型化学发光试剂发光、压片,上机检测蛋白条带[4]。
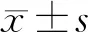
2 结果
2.1 干扰骨肉瘤细胞siRIPK1筛选结果Western blot分析结果显示,不同siRIPK1干扰后,空白对照组、siRIPK1-1组、siRIPK1-2组、siRIPK1-3组骨肉瘤细胞RIPK1相对表达水平分别为1.000±00.000、0.436±0.106、0.705±0.167、0.625±0.086,总体比较差异有统计学意义(F=14.190,P=0.001), siRIPK1-1组、siRIPK1-2组、siRIPK1-3组骨肉瘤细胞RIPK1表达水平均高于空白对照组(P均<0.05),其中siRIPK1-1组最高,干扰效率最高。因此,后续实验我们将采用siRIPK1-1组序列对骨肉瘤细胞进行干扰。见图1。

图1 不同siRIPK1干扰后骨肉瘤细胞RIPK1表达变化
2.2 不同siRIPK1干扰后骨肉瘤细胞增殖抑制情况采用CCK-8法检测siRIPK1干扰对骨肉瘤细胞增殖的影响。实验结果显示:干扰24 h后,空白对照组吸光度值为0.464±0.004,siRIPK1-1组为0.452±0.0051,差异无统计学意义(t=1.476,P=0.190);干扰48 h后,2组吸光度值分别为0.925±0.038、0.629±0.027;差异有统计学意义(t=10.910,P<0.001);干扰72 h后,2组吸光度值分别为1.517±0.011、0.518±0.034,差异有统计学意义(t=48.960,P<0.001)。这提示siRIPK1-1组能够显著抑制骨肉瘤细胞的增殖,且具有时间依赖性。见图2。

图2 不同siRIPK1干扰后骨肉瘤细胞增殖活性变化
2.3 不同siRIPK1干扰诱导骨肉瘤细胞出现凋亡以及坏死性凋亡情况siRIPK1干扰骨肉瘤细胞后,倒置相差显微镜光镜结果显示,与空白对照组比较,siRIPK1-1组骨肉瘤细胞明显皱缩变形,死亡后漂浮细胞数量明显增加;流式细胞仪分析结果显示,空白对照组细胞凋亡率为(1.44±0.13)%,细胞坏死率为(4.96±0.96)%;siRIPK1-1组细胞凋亡率为(17.52±7.68)%,细胞坏死率为(15.42±3.56)%;差异均有统计学意义(t=3.629,P=0.022;t=4.914,P=0.008)。采用Western blot分析进一步检测发现:空白对照组凋亡标志性分子Cleaved caspase-3相对表达水平为1.000±0.000,siRIPK1-1组为1.633±0.286,差异有统计学意义(t=3.834,P=0.019),提示siRIPK1干扰后骨肉瘤细胞凋亡明显增加,凋亡参与了骨肉瘤细胞死亡;空白对照组坏死性凋亡标志性分子p-RIPK3、RIPK3、p-MLKL相对表达水平均为1.000±0.000,而siRIPK1-1组分别为1.764±0.372、1.382±0.146、2.091±0.452,提示siRIPK1干扰后坏死性凋亡也参与了骨肉瘤细胞死亡。见图3~5。

图3 光镜观察不同siRIPK1干扰后骨肉瘤细胞形态变化

图4 流式细胞仪器检测不同siRIPK1干扰后骨肉瘤细胞凋亡及坏死情况
3 讨论
RIPK1是RIPK家族的一员,对多种决定细胞命运的信号通路发挥重要的调节作用,在细胞死亡和存活中都扮演着重要角色[4-5]。RIPK1一方面通过自身的分子支架功能促进腺苷酸活化蛋白激酶通路的激活,发挥抑制细胞死亡的功能,另一方面其还可以通过激酶作用诱导细胞死亡。研究[6]发现,在结肠癌患者中RIPK1蛋白水平明显上调,并且和肿瘤的恶性程度具有非常好的相关性,RIPK1可能通过促进线粒体的能量代谢促进结肠癌细胞增殖。
骨肉瘤多发于儿童以及青少年,主要恶性成骨细胞组成。自从新辅助化疗方案引入骨肉瘤的治疗方案以来,骨肉瘤的治疗效果有了显著的提高,骨肉瘤患者的5 a生存率可达到70%。然而目前仍有相当一部分患者在接受标准治疗后,最终肿瘤还是出现进展及恶化,导致骨肉瘤治疗遭遇了一直无法突破的瓶颈[7-8]。究其根本原因,关键在于我们对骨肉瘤的生物学特征缺乏足够的认识。因此,探索对骨肉瘤生物活性具有重要调控作用的新靶点迫在眉睫。
本研究结果显示:我们应用siRIPK1干扰降低RIPK1在骨肉瘤细胞内的表达水平后,细胞增殖活性受到明显抑制;进一步检测发现,骨肉瘤细胞内凋亡以及坏死性凋亡标志性分子Cleaved caspase-3、p-RIPK3、RIPK3、p-MLKL等表达水平明显升高。这提示RIPK1对于骨肉瘤细胞增殖的维持发挥至关重要的作用。
总之,RIPK1对骨肉瘤细胞增殖等生物活性具有重要的调控作用,是骨肉瘤细胞维持自身生物活性的必要基因,其具体机制有待于进一步研究。此外,RIPK1在肝癌、肾癌、肺癌的细胞系和(或)肿瘤组织中也存在,并促进肿瘤骨转移,这为我们后续研究提供了一定的借鉴意义[9-10]。

