PD-1/PD-L1免疫检查点抑制剂与多西他赛治疗非小细胞肺癌有效性的系统评价与荟萃分析
金刚 姚可盈 神兴伟 马龙 朱自江
在中国,肺癌是最常见的恶性肿瘤之一,原发于气管、支气管和肺,其发病率和病死率在所有肿瘤中均居首位[1-2]。肺癌主要分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占85%。NSCLC可进一步分为鳞状细胞癌、腺癌和大细胞癌3种类型[3]。肺癌的病因复杂,目前认为主要与吸烟、空气污染、职业因素以及分子遗传学的改变有关。肺癌早期症状不明显,以后常有咳嗽、痰中带血、胸痛等症状[4-5]。由于现在所使用的诊断工具不够敏感,75%的患者在晚期被诊断。大多数患者预后不良,基于疾病在诊断时所处的阶段,患者5年生存率为4%~17%[6]。目前,多西他赛化疗是治疗晚期NSCLC最常用的二线治疗方案之一,其作用机制是促进微管蛋白聚合抑制微管解聚,从而抑制肿瘤细胞的分裂和生长[7]。但多西他赛疗效较差,毒性较大,因此,有必要探索新的治疗方法,以延长患者的生存时间,提高患者的生活质量。
近年来,随着免疫学的快速发展,免疫疗法已经成为继外科手术、化学药物治疗、放射治疗后另一种新的肿瘤治疗方法。关于程序细胞死亡蛋白-1(programmed cell death protein 1,PD-1)及其配体(programmed cell death ligand 1,PDL1)通路的免疫检查点抑制剂的研究取得了重大突破,其抑制性抗体在恶性肿瘤临床治疗试验中的作用也得到了认同。PD-1是一种细胞表面受体,在活化的T细胞上高表达,被认为是T细胞衰竭的标志。它可以调节T细胞的活性,激活肿瘤特异性T细胞的凋亡,抑制调节性T细胞的凋亡,从而抑制免疫反应并促进自我耐受[8]。PD-L1在某些类型的肿瘤细胞和抗原提呈细胞(antigen presenting cell,APC)上表达,被认为是免疫反应的共抑制因子。它可以与PD-1结合,激活PD-1/PD-L1通路,抑制下游信号转导和T细胞生物学功能,导致肿瘤特异性T细胞衰竭和凋亡,使肿瘤细胞逃避免疫监视。PD-1/PD-L1通路在肿瘤微环境内诱导和维持免疫耐受,促进肿瘤的发展[9-10]。本研究对PD-1/PD-L1免疫检查点抑制剂与多西他赛治疗NSCLC的随机对照试验(randomized controlled trials,RCTs)进行荟萃分析,以期为临床实践作出参考。
资料与方法
一、检索策略
计算机检索CNKI、万方、维普、CBM、PubMed、EMBASE、Corchrane library、Web of Science数据库。中文检索词:PD-1抑制剂、PD-L1抑制剂、多西他赛、非小细胞肺癌、NSCLC、随机对照试验、RCTs;英文检索词:anti-programmed cell death protein 1、anti-PD-1、anti-programmed cell death ligand 1、anti-PD-L1、docetaxel、non-small cell lung cancer、NSCLC、Randomized controlled trials、RCTs。检索时间截止至2021年5月。
纳入标准:①研究类型为RCT;②研究对象为经临床病理检查确诊为NSCLC的患者;③干预措施为实验组使用任何PD-1/PD-L1抑制剂单药治疗的患者,对照组采用多西他赛单药或联合化疗方案治疗的患者;④结局指标为总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)。
排除标准:①重复发表的文献;②无法获得原始数据或不能与作者联系获得原文的文献;③摘要、综述、荟萃分析、病例报告及动物实验等;④非中、英文文献。
二、文献筛选及数据提取
通过EndNote软件去重后,由2位研究员根据纳入排除标准独立阅读初始得到的文献题目和摘要,对可能符合纳入标准的文献通过阅读全文进行筛选,按照预先设计的表格提取数据,内容包括:第一作者、发表年份、患者例数、用药剂量、OS、PFS、研究类型。如遇分歧则通过讨论解决。
三、偏倚风险评估
由2名评审员独立使用Cochrane协作网偏倚风险评价工具进行评估。
四、统计学分析
采用RevMan5.3软件对纳入的研究进行数据分析。计数资料采用相对危险度(risk ratios,RR)和95% 置信区间(confidence interval,95%CI)为效应指标,P<0.05差异有统计学意义。用I2评估异质性大小,若异质性检验结果I2<50%,则表示各研究结果间无统计学异质性;若异质性检验结果I2>50%,分析异质性来源,若异质性仍存在,选用随机效应模型估计合并效应量。
结 果
一、文献检索及筛选
计算机检索文献3 289篇,剔重并根据标题和摘要筛选出243篇,经全文分析评估,剔除数据异常、信息不全或非比较研究而无法利用的文献231篇,最终纳入12篇文献进行系统评价和荟萃分析。文献筛选过程如图1。其中使用PD-1/PD-L1抑制剂单药治疗的患者有4 684例,使用多西他赛单药或联合化疗方案治疗的患者有4 610例。表1总结了纳入研究的基本特征和主要评价指标。

图1 文献检索流程图
二、质量评价结果
质量评估的结果如图2。大多数研究的偏倚风险较低。有3项研究未发现随机序列[13,14,19],部分研究未明确报道隐蔽分组[12,13,17-19,21],3项研究明确报道了对参与者使用的盲法[12,14,18],还有部分研究未明确报道选择性偏倚[13-15,19,21-22]或其他偏倚[13,14,17,21]。

图2 偏倚风险汇总
三、PD-1/PD-L1抑制剂与多西他赛的有效性
1.OS比较:有11个RCT报道了患者的OS,各研究间无统计学异质性。荟萃分析结果表明,PD-1/PD-L1抑制剂治疗组的OS长于多西他赛化疗组,差异有统计学意义(HR=0.73,95%CI:0.69~0.77,P<0.00001),表明PD-1/PD-L1抑制剂在晚期NSCLC治疗中的疗效优于多西他赛化疗(图3)。

图3 OS比较
2.PFS比较:有8个RCT报道了PFS,各研究间没有统计学异质性。荟萃分析结果表明,PD-1/PD-L1抑制剂治疗组的PFS长于多西他赛化疗组,差异具有统计学意义(HR=0.88,95%CI:0.80~0.96,P=0.004),表明PD-1/PD-L1抑制剂治疗晚期NSCLC的疗效优于多西他赛化疗(图4)。
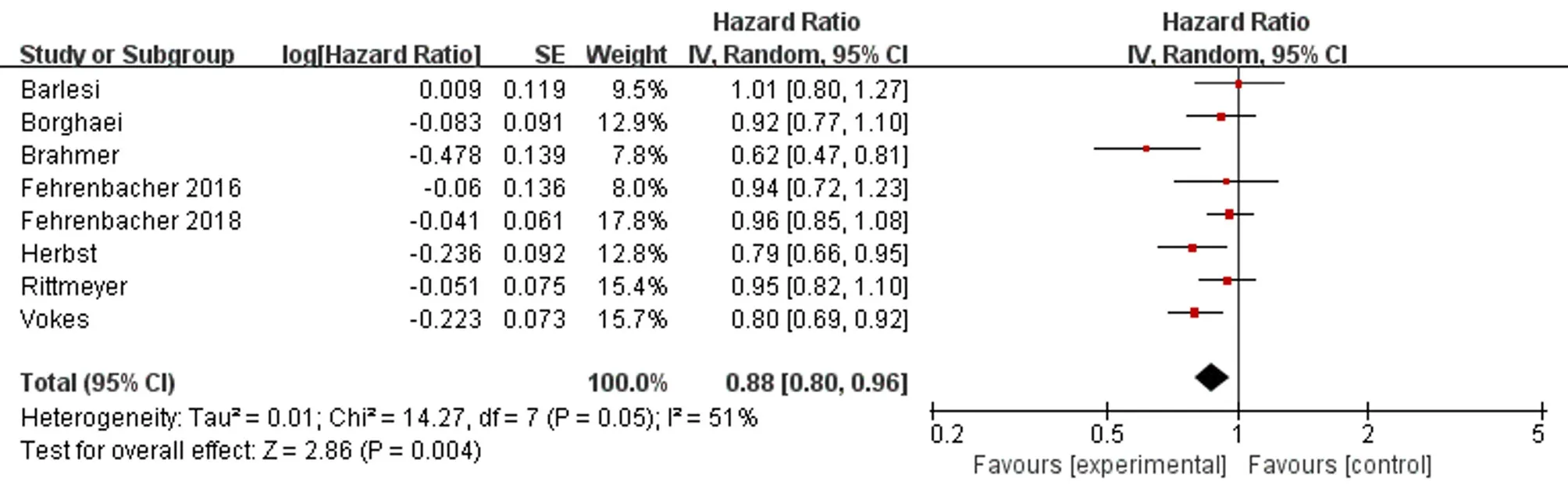
图4 PFS比较
四、发表偏倚评估和敏感性分析
发表偏倚评估仅在OS中进行,因为纳入的包含PFS分析的研究少于10项。漏斗图对称,表明没有明显的发表性偏倚(图5)。对结果进行敏感性分析,依次忽略每项研究进行荟萃分析,结果未发现显著变化,表明本研究的结果稳定。

图5 OS漏斗图
讨 论
正常情况下,PD-1/PD-L1通路在自身免疫性疾病、病毒感染、移植免疫和肿瘤免疫中都发挥重要作用。然而,随着肿瘤的发展,PD-1与PD-L1结合可以抑制T细胞的活化,从而抑制宿主的抗肿瘤免疫,导致肿瘤免疫逃逸。目前,NSCLC的主要治疗方法仍然是手术、放射治疗以及化学药物治疗,但这些治疗方法无法区分正常细胞和肿瘤细胞,常常引起严重的不良反应[8]。近年来,随着免疫学的进一步发展,PD-1/PD-L1免疫检查点抑制剂被认为在恶性肿瘤的临床治疗中具有良好的应用前景。自2006年5月以来,美国食品药品监督管理局(Food and Drug Administration,FDA)已经批准了6种PD-1/PD-L1通路的免疫检查点抑制剂,其中3种作用于PD-1(pembrolizumab、nivolumab及cemiplimab),3种是PD-L1抗体(atezolizumab、avelumab及durvalumab),用于黑色素瘤、肺癌、尿路上皮癌、宫颈癌、胃癌或胃食道癌、实体瘤等的治疗[8,23-24]。不过,PD-1/PD-L1免疫检查点抑制剂在临床应用过程中可能会引起免疫相关不良反应和输液相关反应,仍需进一步的研究[25]。
在PD-1/PD-L1免疫检查点抑制剂治疗肿瘤的过程中,一些PD-L1表达率较低的患者可能疗效较差。因此,选择能够有效预测PD-1/PD-L1抑制剂疗效的生物标志物至关重要,这也是现阶段免疫治疗亟待解决的问题[26]。目前,PD-L1是首个也是研究最多的生物标志物,PD-L1表达既可以是免疫源性的(由免疫系统驱动的肿瘤外源性),也可以是癌源性的(肿瘤细胞固有的,由癌细胞内部机制驱动)。诱导肿瘤PD-L1表达能够直接并充分地抑制抗肿瘤免疫[27]。由错配修复基因缺陷引起的微卫星不稳定性是第二个由FDA批准的预测生物标志物。一些T细胞衍生的生物标志物也被发现可以预测某些肿瘤患者对PD-1抗体的反应,如肿瘤浸润淋巴细胞密度(tumor infiltrating lymphocyte density,TIL)、PD-1细胞与PD-L1细胞的邻近性以及克隆性T细胞受体(T cell receptor,TCR)等。还有一些非T宿主因素,包括绝对淋巴细胞计数、相对嗜酸性粒细胞计数、血清乳酸脱氢酶升高≤2.5倍也与延长OS相关。此外,肠道微生物群也被认为是有价值的预测指标[28-29]。本研究总结了已发表的使用PD-1/PD-L1免疫检查点抑制药物与多西他赛化疗治疗NSCLC的RCTs中患者的OS、PFS,发现接受PD-1/PD-L1免疫检查点抑制药物治疗的患者比接受多西他赛化疗的患者生存期更长久并且效果更好。而且,与多西他赛相比,PD-1/PD-L1抑制剂相关不良事件发生率较低,特别是骨髓抑制、胃肠道反应和其他不良反应的风险较低。
本研究也具有一定的局限性:①在进行系统的检索及筛选后,最终只纳入12篇文献进行系统评价和荟萃分析,样本量偏小;②部分统计结果异质性较大,可能会影响研究结果的可信度;③不同研究的NSCLC类型不相同,可能增加了异质性,影响结果的可靠性。但在研究中为了更好地降低如上偏倚,在实施检索以及数据合并时,本研究尽可能按照Cochrane系统评价指导手册科学客观地进行,并根据PRISMA条目详实报告。
综上所述,与多西他赛相比,PD-1/PD-L1免疫检查点抑制剂在治疗NSCLC中可延长患者的OS和PFS,临床疗效较好,这种疗法可能是一种有前景的治疗方法。但仍需多中心、大样本、高质量的研究进一步证实。

