NPY-Y1受体调控Wnt/β-catenin通路对OP成骨细胞作用及影响
才忠民,赵晓勇
(南方医科大学附属花都医院骨科,广东 广州 510800)
骨质疏松症(OP)是一种骨代谢性疾病,常见于中、老年人,也是促进其他骨科疾病恶化的诱因[1].Wnt/β-catenin信号转导通路在人体普遍存在,Wnt与存在于细胞膜上的相关蛋白受体结合,诱导细胞内β-catenin蛋白进入细胞核,转录共活化因子β-catenin是该信号通路的核心部分和最终目标.NPY是氨基酸组成的一种特异性神经递质,分布于多处的神经系统中,在调节各种基本生理功能中起着至关重要的作用.Y1R是第一个被发现为孤儿受体,位于人类染色体4q31.3-q32上[2].本研究中应用低氧处理成骨细胞株,构建骨质疏松症体外细胞模型,然后采用Wnt/β-catenin信号转导通路抑制剂DKK1处理,进一步深入分析DKK1对体外骨质疏松症模型的C518、MC3T3-E1成骨细胞株的作用机制和影响结果,为阐明骨质疏松症的发病机制和靶向治疗策略的研究提供了新的方向.
1 材料与方法
1.1 材料
选择C518、MC3T3-E1成骨细胞株,C518细胞株购自上海生命科学院细胞资源中心.MC3T3-E1细胞株购自ATCC.C518细胞的培养液是RPMI 1640,MC3T3-E1细胞的培养液是DMEM/F12.
1.2 研究方法
1.2.1 NPY-Y1基因过表达和沉默
取一半各细胞株,分为:空载体组、空白对照组、NPY-Y1过表达组、NPY-Y1基因沉默组,分别加入特异慢病毒(NPY-Y1-cDNA)和空载慢病毒各20 μL,进行孵育过夜处理.
1.2.2 细胞分组
未予任何处理的C518、MC3T3-E1细胞株为空白对照组(Con组)、NPY-Y1基因沉默组及过表达处理的C518、MC3T3-E1细胞株分为NPY-Y1基因沉默组(sh NPY-Y1组)、NPY-Y1过表达组(NPY-Y1OE组).
1.2.3 Wnt/β-catenin信号通路抑制剂 DKK1处理细胞和Western blot验证
接种4×105各组细胞于六孔板中,加入含5 μM DKK1(Stem RD,USA)的新鲜培养基,72小时后收获细胞.取提取蛋白的细胞,弃上清,PBS洗2次.孵育后电泳分析结果.
1.2.4 Real time PCR检测细胞中的NPY-Y1、Runx-2和Osterix的mRNA
细胞置入1.5 mL EP管内,加入1.0 mL的Trizol溶液,4℃,12 000 rmp离心15 min.RNA的再溶解,弃去上层悬液,适度干燥RNA沉淀,再在管中加20 μL的DEPC水溶解.引物见表1.

表1 Real time-PCR检测NPY-Y1、Runx-2和Osterix的引物结果Tab.1 Primers of NPY-Y1,Runx-2 and Osterix used in Real time-PCR and detection results
1.2.5 Western blot检测细胞中的NPY-Y1、Runx-2和 Osterix蛋白差异
蛋白样本进行电泳,NPY-Y1、Runx-2中加入山羊抗兔二抗处理.然后依次进行电泳、转膜、封闭、孵育一抗、孵育二抗.实验重复3次,取均值进行专业软件分析结果.
1.2.6 双荧光素酶报告基因实验
细胞用Lipofectamine 2 000转染质粒,每组3个复孔数据取平均值,而后计算各组的Luciferase荧光值/Renilla荧光值,得到校正后的Luciferase表达强度值.
1.2.7 Rescue实验
细胞接种于24孔板,分组设置:pcDNA3+pcDNA3(0.6 μg+0.4 μg);pcDNA3+pNPY-Y1(0.6 μg+0.4 μg);p NPY-Y1+p sh Runx-2(0.6 μg+0.4 μg).沉淀孵育,采用溶液置换后进行蛋白半定量验证.
1.2.8 RNA-seq测序及分析
取1 μL RNA溶液进行浓度及纯度测定.构建标准文库,严格设定入库条件,质检后进行用RNA-seq测序,然后运用SOAPaligner/SOAP2将其与参考序列进行比对分析.
1.3 统计学分析
应用Prism 9软件分析,多组间的比较采用单因素方差分析,两组间的比较采用t检验,P<0.05为差异有统计学意义.
2 结果
2.1 Wnt/β-catenin信号通路抑制剂DKK1处理细胞和Western blot验证
在C518、MC3T3-E1细胞中,利用Wnt/β-catenin 抑制剂 DKK1(30 μmol/L)孵育细胞24 h.Western blot检测,结果显示DKK1对NPY-Y1、Runx-2和 Osterix显著下调,差异明显,具有统计学意义(P<0.05),见表2和图1-图4.
表2 Wnt/β-catenin抑制剂DKK1处理细胞后蛋白变化(±s)Tab.2 Protein changes in cells after being treated with Wnt/β-catenin inhibitor DKK1(± s)

表2 Wnt/β-catenin抑制剂DKK1处理细胞后蛋白变化(±s)Tab.2 Protein changes in cells after being treated with Wnt/β-catenin inhibitor DKK1(± s)
项目NPY-Y1 Runx-2 Osterix t值P值C518MC3T3-E1 DKK1(-)12.20±1.57 10.55±1.47 11.24±1.39 2.779 0.027 DKK1(+)10.14±1.61 6.25±1.02 6.33±1.05 2.971 0.022 DKK1(-)11.96±1.81 10.43±1.35 11.24±1.33 2.995 0.020 DKK1(+)9.13±1.94 6.58±1.59 6.19±1.28 2.977 0.021

图1 Wnt信号通路抑制剂DKK1作用C518细胞株后蛋白表达结果Fig.1 Protein expression of C518 cell line after being treated with Wnt signaling pathway inhibitor DKK1

图2 Western blot验证信号通路抑制剂DKK1作用C518细胞株后蛋白表达结果Fig.2 Verification of protein expression of C518 cell line treated with signaling pathway inhibitor DKK1 by Western blot

图3 Western blot检测信号通路抑制剂DKK1作用MC3T3-E1细胞株后蛋白表达结果Fig.3 Detection of protein expression of MC3T3-E1 cell line treated with signaling pathway inhibitor DKK1 by Western blot

图4 Western blot验证信号通路抑制剂DKK1作用MC3T3-E1细胞株后蛋白表达结果Fig.4 Verification of protein expression of MC3T3-E1 cell line treated with signaling pathway inhibitor DKK1 by Western blot
2.2 Real time PCR 检测细胞中的Wnt、NPY-Y1、Runx-2 和 Osterix的mRNA
DKK1未处理时sh NPY-Y1组和NPY-Y1OE组Wnt的mRNA明显高于Con组,DKK1处理后sh NPYY1组和NPY-Y1OE组Wnt的mRNA显著下调.shNPY-Y1组和NPY-Y1OE组的NPY-Y1 mRNA差异显著.Runx-2和 Osterix mRNA较DKK1未处理时显著下调,P<0.05,见表3和图5.
表3 Real time PCR 检测C518细胞Wnt、NPY-Y1、Runx-2 和 Osterix mRNA(±s,ng·mL-1)Tab.3 Detection of Wnt,NPY-Y1,Runx-2 and Osterix mRNA in C518 cells by Real time PCR(± s,ng·mL-1)
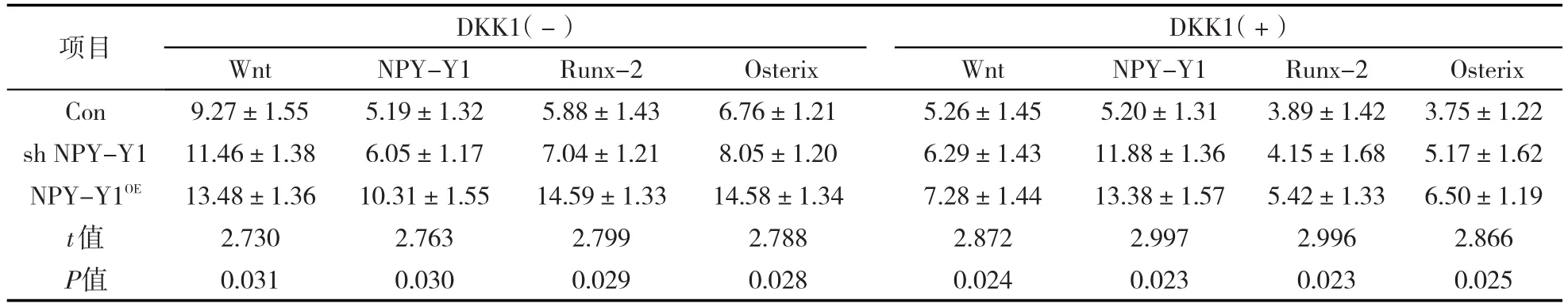
表3 Real time PCR 检测C518细胞Wnt、NPY-Y1、Runx-2 和 Osterix mRNA(±s,ng·mL-1)Tab.3 Detection of Wnt,NPY-Y1,Runx-2 and Osterix mRNA in C518 cells by Real time PCR(± s,ng·mL-1)
Wnt 9.27±1.55 11.46±1.38 13.48±1.36 2.730 0.031项目Con sh NPY-Y1 NPY-Y1OE t值P值DKK1(-)DKK1(+)NPY-Y1 5.19±1.32 6.05±1.17 10.31±1.55 2.763 0.030 Runx-2 5.88±1.43 7.04±1.21 14.59±1.33 2.799 0.029 Osterix 6.76±1.21 8.05±1.20 14.58±1.34 2.788 0.028 Wnt 5.26±1.45 6.29±1.43 7.28±1.44 2.872 0.024 NPY-Y1 5.20±1.31 11.88±1.36 13.38±1.57 2.997 0.023 Runx-2 3.89±1.42 4.15±1.68 5.42±1.33 2.996 0.023 Osterix 3.75±1.22 5.17±1.62 6.50±1.19 2.866 0.025

图5 Real time PCR 检测C518细胞Wnt、NPY-Y1、Runx-2和 Osterix mRNA差异Fig.5 Differences detection of Wnt,NPY-Y1,Runx-2 and Osterix mRNA in C518 cells by Real time PCR
2.3 Western blot检测细胞中的Wnt、NPY-Y1、Runx-2 和 Osterix蛋白差异
DKK1未处理时sh NPY-Y1组和NPY-Y1OE组Wnt的蛋白明显高于Con组,DKK1处理后sh NPY-Y1组和NPY-Y1OE组Wnt的蛋白显著下调.NPY-Y1组和NPY-Y1OE组的NPY-Y1蛋白与DKK1处理前差异显著.Runx-2和Osterix mRNA较DKK1未处理时显著下调,差异显著,有统计学意义(P<0.05),见表4和图6.
表4 Western blot检测C518细胞Wnt、NPY-Y1、Runx-2 和 Osterix 蛋白(±s,μg·mL-1)Tab.4 Detection of Wnt,NPY-Y1,Runx-2 and Osterix proteins in C518 cells by Western blot(± s,μg·mL-1)

表4 Western blot检测C518细胞Wnt、NPY-Y1、Runx-2 和 Osterix 蛋白(±s,μg·mL-1)Tab.4 Detection of Wnt,NPY-Y1,Runx-2 and Osterix proteins in C518 cells by Western blot(± s,μg·mL-1)
Con sh NPY-Y1 NPY-Y1OE t值P值DKK1(-)DKK1(+)项目Wnt 9.18±1.32 14.79±2.52 15.83±2.48 2.885 0.023 NPY-Y1 8.33±1.47 12.21±1.33 16.78±1.69 2.897 0.022 Runx-2 7.69±1.52 13.74±1.68 15.87±1.05 2.871 0.024 Osterix 8.57±1.30 14.25±1.69 16.97±1.32 2.875 0.024 Wnt 6.17±1.34 10.23±1.65 12.27±1.63 2.963 0.022 NPY-Y1 8.34±1.48 12.30±1.28 16.93±1.97 2.715 0.028 Runx-2 7.71±1.50 8.02±1.46 9.63±1.25 2.693 0.030 Osterix 8.58±1.29 10.17±1.62 12.39±1.20 2.557 0.032

图6 Western blot检测C518细胞Wnt、NPY-Y1、Runx-2和 Osterix蛋白差异Fig.6 Differences detection of Wnt,NPY-Y1,Runx-2 and Osterix protein in C518 cells by Western blot注:组间比较,*P<0.05
2.4 双荧光素酶报告基因
验证NPY-Y1直接结合靶基因Runx-2,根据载体构建的基本步骤得到启动子报告载体.严格按照标准试剂盒操作,组间比较,差异显著,有统计学意义(P<0.05),见表5和图7、图8.
表5 细胞中双荧光素酶报告系统对质粒luciferase荧光强度表达结果(±s)Tab.5 Fluorescence expression intensity of luciferase plasmid in cells in dual-luciferase reporter system(± s)
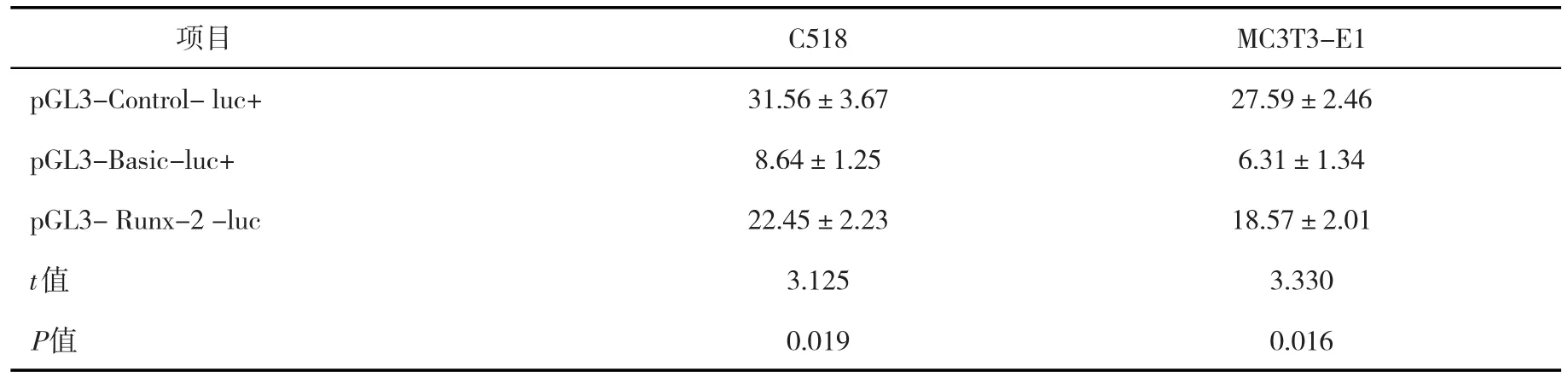
表5 细胞中双荧光素酶报告系统对质粒luciferase荧光强度表达结果(±s)Tab.5 Fluorescence expression intensity of luciferase plasmid in cells in dual-luciferase reporter system(± s)
项目pGL3-Control-luc+pGL3-Basic-luc+pGL3-Runx-2-luc t值P值C518 31.56±3.67 8.64±1.25 22.45±2.23 3.125 0.019 MC3T3-E1 27.59±2.46 6.31±1.34 18.57±2.01 3.330 0.016

图7 C518细胞中双荧光素酶报告系统对质粒luciferase荧光强度表达Fig.7 Fluorescence expression intensity of luciferase plasmid in C518 cells in dual-luciferase reporter system

图8 MC3T3-E1细胞中双荧光素酶报告系统对质粒luciferase荧光强度表达Fig.8 Fluorescence expression intensity of luciferase plasmid in MC3T3-E1 cells in dual-luciferase reporter system
NPY-Y1OE组Runx-2的启动子活性高于Con组,sh NPY-Y1组Runx-2的启动子活性低于Con组.结果见表6和图9、图10.
表6 双荧光素酶报告系统验证转录因子NPY-Y1调控Runx-2启动子活性(±s)Tab.6 Verification of transcription factor NPY-Y1 regulating promoter activity of Runx-2 by dual-luciferase reporter system(± s)

表6 双荧光素酶报告系统验证转录因子NPY-Y1调控Runx-2启动子活性(±s)Tab.6 Verification of transcription factor NPY-Y1 regulating promoter activity of Runx-2 by dual-luciferase reporter system(± s)
D K K 1(-)组别C o n s h N P Y-Y 1 N P Y-Y 1 OE t值P值C 5 1 8 6.5 4±1.0 5 3.2 9±0.6 7 9.6 7±1.4 7 2.8 7 1 0.0 2 4 M C 3 T 3-E 1 6.2 1±1.0 1 3.1 4±0.5 3 9.3 2±1.3 6 2.8 7 5 0.0 2 3 D K K 1(+)C 5 1 8 6.5 8±1.0 3 5.3 1±0.6 9 1 3.3 6±1.6 8 2.8 5 3 0.0 2 5 M C 3 T 3-E 1 6.1 8±1.0 2 5.1 9±0.5 2 1 2.2 8±1.5 1 2.8 1 2 0.0 2 6
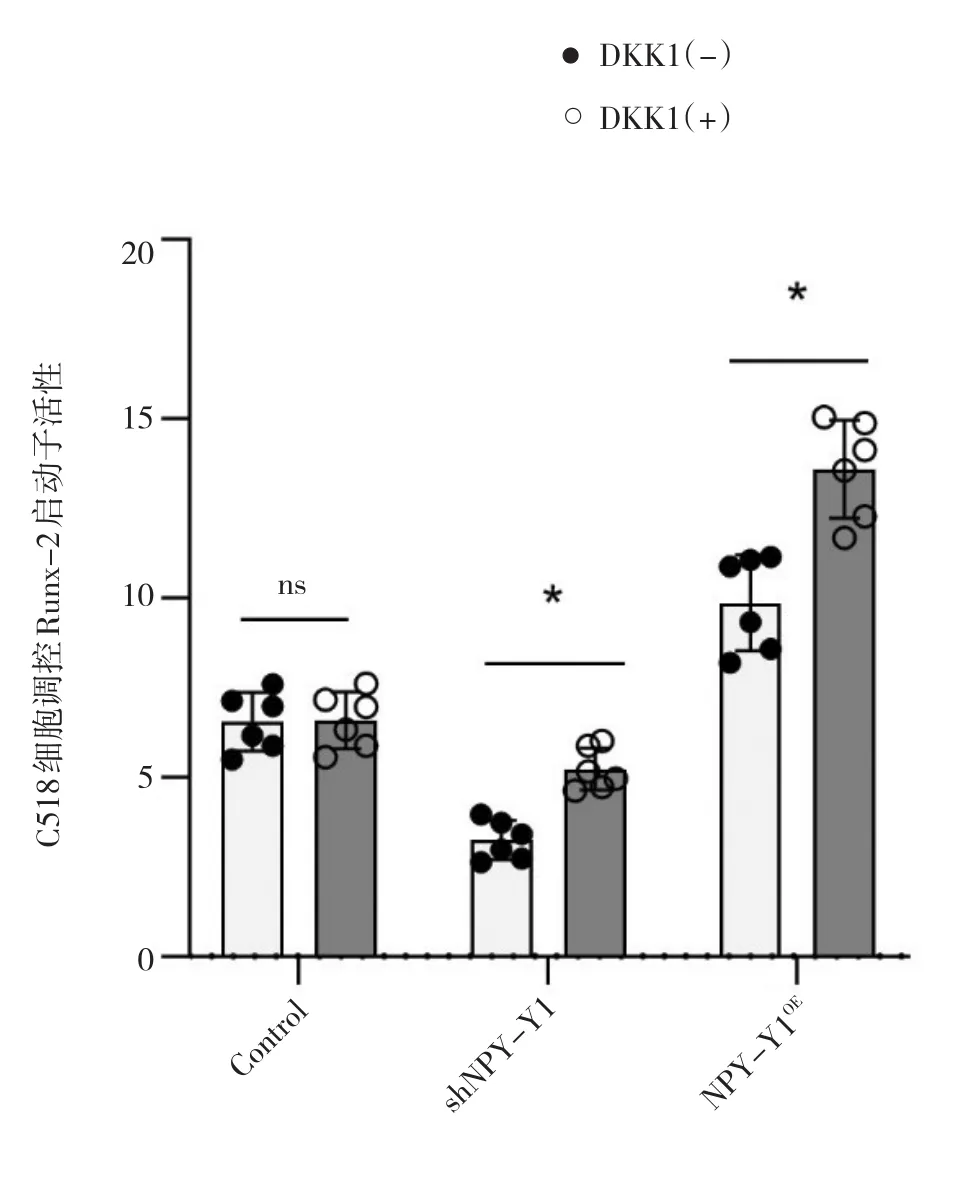
图9 C518细胞NPY-Y1调控Runx-2启动子活性结果Fig.9 Regulation of NPY-Y1 on promoter activity of Runx-2 in C518 cells

图10 MC3T3-E1细胞NPY-Y1调控Runx-2启动子活性结果Fig.10 Regulation of NPY-Y1 on promoter activity of Runx-2 in MC3T3-E1 cells
2.5 C518细胞中敲减Runx-2能挽救NPY-Y1对Runx-2表达的促进作用
在外源敲减Runx-2后,能够被顺利的调整回复原来的表达水平,说明敲减Runx-2能挽救NPY-Y1对Runx-2表达的促进作用.结果见表7和图11、图12.
表7 挽救实验中Real time PCR检测C518细胞Runx-2的mRNA水平(±s)Tab.7 Detection of Runx-2 mRNA level in C518 cell by Real time PCR in rescue experiment(± s)

表7 挽救实验中Real time PCR检测C518细胞Runx-2的mRNA水平(±s)Tab.7 Detection of Runx-2 mRNA level in C518 cell by Real time PCR in rescue experiment(± s)
DKK1(-)DKK1(+)项目Con sh NPY-Y1 NPY-Y1OE t值P值pcDNA3+pcDNA3 0.78±0.05 0.57±0.06 0.89±0.04 3.250 0.017 pcDNA3+p NPY-Y1 7.32±1.25 5.54±1.36 7.76±1.49 3.365 0.016 p NPY-Y1+p sh Runx-2 0.39±0.06 0.28±0.03 0.45±0.05 3.152 0.018 pcDNA3+pcDNA3 0.79±0.04 0.68±0.05 0.97±0.02 3.412 0.015 pcDNA3+p NPY-Y1 7.33±1.26 7.02±1.33 9.58±1.26 3.553 0.014 p NPY-Y1+p sh Runx-2 0.40±0.06 0.34±0.02 0.48±0.04 3.114 0.019

图11 挽救实验中Real time PCR检测不同组C518细胞Runx-2的mRNA结果Fig.11 Detection of Runx-2 mRNA in different groups of C518 cells by Real time PCR in rescue experiment

图12 挽救实验中Western blot检测不同组C518细胞Runx-2的蛋白水平Fig.12 Detection of protein level of Runx-2 in different groups of C518 cells by Western blot in rescue experiment
2.6 RNA-seq对C518细胞不同组别差异表达基因测序
RNA-seq对C518细胞不同组别差异表达基因测序中,NPY-Y1与Runx-2和Osterix差异比较分析、热图及分层聚类见表8,图13.

表8 RNA-seq的NPY-Y1与Runx-2和Osterix差异表达结果Tab.8 Differential expression of NPY-Y1,Runx-2 and Osterix in RNA-seq

图13 RNA-seq差异表达mRNA的热图及分层聚类Fig.13 Thermal diagram and hierarchical clustering of differential expression mRNA in RNA-seq
3 讨论
骨质疏松症目前发病率日益增多,已经不局限于中老年人,甚至在青年人群中也常有发病[3].骨质疏松症可以诱发其他骨代谢性疾病的发生,目前骨质疏松症的发病机制尚不明确[4].介导Wnt/β-catenin信号转导通路的调控与骨质疏松症发病中的成骨细胞靶向分化过程密切相关,Wnt基因按照其生物学功能差异可以划分为各自具有不同生物学功能的亚群[5].在促进骨成熟的生成方面,接受胞外信息后与LRP/Fz相结合,通过系列传导将信息传递给下游的β-catenin,进而发挥重要作用[6].Runx-2基因和Osterix基因是成骨细胞在细胞分化前期重要基因,是促进骨发育中的成骨细胞靶向分化成熟的特异性基因,两者各自在成骨分化不同时期起到调控作用[7-9].Osterix是Runx-2下游作用靶点,对成骨细胞具有高度特异性,影响多种成骨基因表达[10].本文研究运用Wnt/β-catenin信号转导通路特异性抑制剂DKK1,阻断信号蛋白的传递[11-13].NPY在骨质疏松症中表达增加,作用可能是通过与Y1R结合而发挥的,在骨质疏松症模型中,内源性和外源性NPY都可以发挥抗成骨细胞作用[14].
笔者应用Wnt/β-catenin信号通路抑制剂DKK1处理细胞并用Western blot验证,研究结果为,DKK1对NPY-Y1、Runx-2和Osterix显著下调,差异显著,有统计学意义.通过研究表明DKK1处理使各组中Wnt/β-catenin通路抑制,结果显示,NPY-Y1、Runx-2和Osterix mRNA及蛋白表达水平显著下降.这就明显说明信号转导通路的阻断,完全抑制了转录因子NPY-Y1对靶基因Runx-2和Osterix的调控,考虑转录因子NPY-Y1与靶基因Runx-2和Osterix是直接结合作用.
研究结果证实,DKK1未处理时sh NPY-Y1组和NPY-Y1OE组Wnt的mRNA和蛋白明显高于Con组,DKK1处理后sh NPY-Y1组和NPY-Y1OE组Wnt的mRNA和蛋白显著下调.shNPY-Y1组和NPY-Y1OE组的NPY-Y1 mRNA和蛋白差异显著.Runx-2和Osterix mRNA和蛋白较DKK1未处理时明显下调.NPY-Y1OE组Runx-2的启动子活性高于Con组,sh NPY-Y1组Runx-2的启动子活性低于Con组.DKK1处理后结果差异显著,有统计学意义(P<0.05).在外源敲减Runx-2后,Runx-2蛋白定量上调,说明敲减Runx-2能挽救NPY-Y1对Runx-2表达的促进作用.DKK1处理后结果差异显著,有统计学意义(P<0.05).
不同组别的RNA-seq研究中的结果显示,C518和MC3T3-E1成骨细胞株测序为显著差异基因为45个,其中定量上调的基因为25个,定量下调的基因为19个,NPY-Y1、Runx-2和Osterix基因为最为明显的特异性基因.通路分析为Wnt/β-catenin信号转导通路.
综上所述,通过DKK1处理,抑制 Wnt/β-catenin信号通路活性,抑制NPY-Y1、Runx-2和 Osterix基因表达.揭示了NPY-Y1介导的Wnt/β-catenin信号转导通路调控可能在骨质疏松症发病的分子机制中起着重要作用.

