磁性纳米Fe3 O4类芬顿体系降解甲基紫的研究
董洪霞,龙佳俊,陶文杰,严钱钱,李子璐
(上饶师范学院 化学与环境科学学院,江西 上饶 334000)
Fe0~Fe3+等的类芬顿反应在水污染控制领域已成为热门研究,而其中的Fe3O4则具有磁性、环境友好性、易回收性等独特的性质,从而成为最有潜力的代替芬顿试剂的材料[1]。磁性Fe3O4除了应用于水污染控制的领域,也可用于生物医学方面,如纳米探针、肿瘤治疗、定向输送载体等[2]。在Fe3O4/H2O2类芬顿反应体系中,随着四氧化三铁粒径的减小,相应的比表面积就增大,由此可以增强四氧化三铁的催化活性[3]。目前,很多学者对磁性纳米Fe3O4催化降解性能进行了广泛研究,常用的纳米Fe3O4制备方法主要包括溶剂热法[4]、共沉淀法[5-6]、高温分解法[7-8]、微乳液法[9]和溶胶-凝胶法[10]等。溶胶-凝胶法的优点是对反应温度低、节省能源,制得的纳米颗粒粒径小,分布均匀,产物纯度较高;与传统方法相比,可制备其不能或难以制得的产物。目前,采用纳米Fe3O4微粒降解甲基紫的研究尚未见报道。
1 试验材料与方法
1.1 主要仪器
722G可见光分光光度计(上海仪电分析仪器有限公司),PHS-3C型p H计(上海仪电科学仪器股份有限公司),H H-4数显恒温水浴锅(金坛市白塔金昌实验仪器厂),SQP型电子天平(赛多利斯科学仪器有限公司,)DZF-6021真空干燥箱(上海一恒科学仪器有限公司),JB-3型定时恒温磁力搅拌器(上海雷磁仪器厂),80-2B电动离心机(金坛市医疗仪器厂),Miniflex600多功能X射线衍射仪(日本理学),NICOLET6700型傅里叶红外光谱仪(美国赛默飞世尔科技公司)。
1.2 主要试剂
FeSO4·7H2O、KOH、KNO3、3%(质量分数)H2O2、甲基紫,以上试剂均为分析纯,实验用水为二次蒸馏水。
500 mg/L甲基紫标准贮备液[11]:准确称取0.050 0 g的甲基紫,加入一定量的无水乙醇对其助溶,待完全溶解后,转移至100 m L的容量瓶中,用纯水定容,摇匀,移入棕色瓶中备用。
甲基紫标准使用液(5 mg/L)[11]:移取500 mg/L的甲基紫储备液2.5 m L,转移至250 m L的容量瓶中,定容,备用。
1.3 试验方法
1.3.1 磁性Fe3O4的制备方法
移取20.0 m L的0.075 mol/L KOH溶 液 于50 m L具 塞 比 色 管 中,再 加 入20.0 m L的0.02 mol/L KNO3溶液,充分混匀后,缓慢加入10.0 m L的0.025 mol/L FeSO4溶液,此时反应溶液呈墨绿色,并产生大量的絮状沉淀,充分混匀后置于60℃恒温水浴中陈化反应3 h,可得到黑色的Fe3O4凝胶溶液,将此凝胶溶液置于磁场中利用磁倾析的方法分离出Fe3O4固体颗粒,并用去离子水清洗3~4遍,将洗净的Fe3O4颗粒在25℃常温下真空干燥2 h,得到黑色的磁性Fe3O4固体[2]。
1.3.2 降解甲基紫试验方法
准确移取5 mg·L-1的甲基紫标准溶液50.0 m L于100 m L的洁净小烧杯中,再加入0.060 g磁性纳米Fe3O4,调节p H至8.0,加入3%(质量分数)H2O21.2 m L,移至磁力搅拌器中搅拌,反应70 min后,用离心机分离出Fe3O4,取上部清液,用10 nm比色皿,在590 nm处测定吸光度,计算甲基紫的脱色率。
1.3.3 脱色率的计算
甲基紫反应初始溶液的吸光度为A0,经过降解试验后溶液的吸光度为A,则脱色率可表示为:
D(%)=(A0-A)/A0×100%[12]。
2 结果与讨论
2.1 磁性Fe3 O4制备条件的优化
2.1.1 不同摩尔比的磁性Fe3O4的制备
周洁等[2]采用溶胶-凝胶法,通过改变各反应物浓度制备出不同尺寸的Fe3O4磁性颗粒。本次试验选用了四种不同摩尔比制备Fe3O4,利用其对甲基紫的脱色反应,优化其制备条件,如表1所示。

表1 不同摩尔比的Fe3 O4对脱色率的影响
利用不同摩尔比的磁性Fe3O4进行甲基紫降解试验,由表1可知,其降解率为:1∶3磁性Fe3O4>1∶2磁性Fe3O4>3∶5 Fe3O4>4∶5磁性Fe3O4,故制备磁性Fe3O4最佳的摩尔比为1∶3。
2.1.2 制备最佳反应温度的确定
改变反应温度,分别设置为50℃、60℃、70℃、80℃、90℃。通过控制不同的反应温度来制备磁性Fe3O4。温度不仅决定了反应的快慢,有时还会影响合成样品的结构、表面晶形、产品产率以及样品的稳定性等,过高的温度还会导致Fe3O4的水解,磁性下降,不利于回收[13]。利用制备的不同摩尔比磁性Fe3O4进行甲基紫降解试验,计算不同温度下制备的磁性Fe3O4的脱色率。由图1可见,摩尔比为1∶3和3∶5的磁性Fe3O4在50~60℃脱色率逐渐升高,在60~90℃范围内,脱色率随温度的升高而降低,温度为60℃脱色率最高;而1∶2和4∶5摩尔比磁性Fe3O4降解甲基紫效果最佳的温度为70℃,总体上看,不同摩尔比磁性Fe3O4降解效果不同,小于70℃时,1∶3磁性Fe3O4>3∶5磁性Fe3O4>1∶2磁性Fe3O4>4∶5磁性Fe3O4,60℃时1∶3磁性Fe3O4对甲基紫脱色率最高达到87.51%。故选择制备1∶3磁性Fe3O4的最佳温度为60℃。

图1 温度对不同摩尔比Fe3 O 4的甲基紫脱色率的影响
2.1.3 制备最佳反应时间的确定
改变反应时间,分别设置为1 h、2 h、3 h、4 h、5 h,制备磁性纳米Fe3O4,进行降解试验,由图2可见,不同摩尔比磁性Fe3O4的降解效果不同:1∶3磁性Fe3O4>1∶2磁性Fe3O4>3∶5磁性Fe3O4>4∶5磁性Fe3O4。反应时间的长短对脱色率的影响也是明显的,反应时间过短,Fe3O4材料形成不完全,影响材料的稳定性,反应时间过长(超过3 h)会引起Fe3O4材料部分分解,影响材料的磁性,故选1∶3磁性Fe3O4的最佳合成反应时间为3 h。

图2 时间对不同摩尔比Fe3 O 4的甲基紫脱色率的影响
2.2 磁性Fe3 O4降解甲基紫性能的试验条件优化
2.2.1 甲基紫最大吸收波长的选择
取5 mg/L的甲基紫溶液,用10 mm比色皿,在550~620 nm范围内,每隔2 nm或10 nm测定其吸光度。实验结果表明,在550~590 nm范围内,吸光度随波长的增加而逐渐地增大,在590~620 nm范围内,吸光度随波长的增加而逐渐减小,在波长为590 nm时,吸光度达到最大值,因此选择590 nm为甲基紫的最大吸收波长[14]。
2.2.2 Fe3O4加入量对甲基紫脱色效果的影响
改 变 磁 性Fe3O4的 用 量,分 别 加 入0、0.010、0.020、0.030、0.040、0.050、0.060、0.070、0.080、0.100、0.120 g磁性Fe3O4,测定溶液吸光度,并计算甲基紫的脱色率。由图3所示,当磁性Fe3O4加入量为0~0.060 g时,随磁性Fe3O4加入量增加,脱色率增加;当磁性Fe3O4加入量为0.060~0.120 g时,随磁性Fe3O4加入量增加,脱色率降低。这是因为磁性Fe3O4加入量过少无法充分反应,加入量过多则由于磁性Fe3O4本身粒径很小,色度的影响会增大,因此选择磁性Fe3O4最佳加入量为0.060 g。

图3 Fe3 O4加入量对甲基紫脱色率的影响
2.2.3 H2O2的加入量对甲基紫脱色效果的影响
调节H2O2加入量,分别加入3%(质量分数)H2O20、0.5、1.0、1.2、1.4、1.6、1.8、2.0、2.5 m L,测定溶液吸光度,并计算甲基紫的脱色率。如图4所示,当3%(质量分数)H2O2加入量为0~1.2 m L时,随着加入量增加,脱色率增大;尔后随着H2O2加入量的增加,脱色率几乎无变化,故选择H2O2的最佳加入量为1.2 m L。

图4 H 2 O2加入量对甲基紫脱色率的影响
2.2.4 p H对甲基紫脱色效果的影响
调节反应体系的p H,分别设置p H为3.5、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,测定溶液吸光度,并计算甲基紫的脱色率。如图5所示,在p H在3.0~8.0时,随着p H的减小,脱色率也逐渐减小。由于在酸性条件下,Fe3O4逐渐溶解,其色度对脱色率的影响不断增大,脱色率减小。而在中性和碱性条件下,Fe3O4能够保持比较稳定的状态,且反应不会太过剧烈,色度保持稳定。由图6可知,p H在8.0左右达到最佳脱色效

图5 p H对甲基紫脱色率的影响
果,故选择最佳反应p H为8.0。
2.2.5 降解时间对甲基紫脱色效果的影响
在0~80 min范围内调节反应时间,每隔10 min取出一份试样离心,测定溶液吸光度,并计算甲基紫的脱色率。由图6可知,最初10 min反应速率最快,甲基紫脱色效果最明显;而后随着时间的增加,反应速率逐渐减小,脱色率缓慢增加;当反应时间超过70 min时,脱色率几乎无变化,故选择最佳降解时间为70 min。

图6 降解时间对甲基紫脱色率的影响
2.3 正交试验
2.3.1 正交试验
采用正交法确定甲基紫脱色效果的最佳方案,以甲基紫的脱色率为指标,选择对试验效果影响较大的因素:Fe3O4加入量、H2O2加入量、p H值、降解时间,然后分别以选出的影响因素作为研究对象设计4因素3水平正交试验并对其影响效果进行探究,设计因素分析表如表2。

表2 因素分析表L 9(34)
极差R值越大,则此影响因素对实验效果的影响就越大。因此,由表3可得出影响因素的主次顺序为:B>C>A>D,即:H2O2加入量>p H值>磁性Fe3O4加入量>降解时间。由表2得出最佳优水平设计方案为B2C3A2D3,进而可得出磁性Fe3O4加入量为0.060 g,3%(质量分数)H2O2加入量为1.2 m L,p H值为8.0,降解时间为70 min。
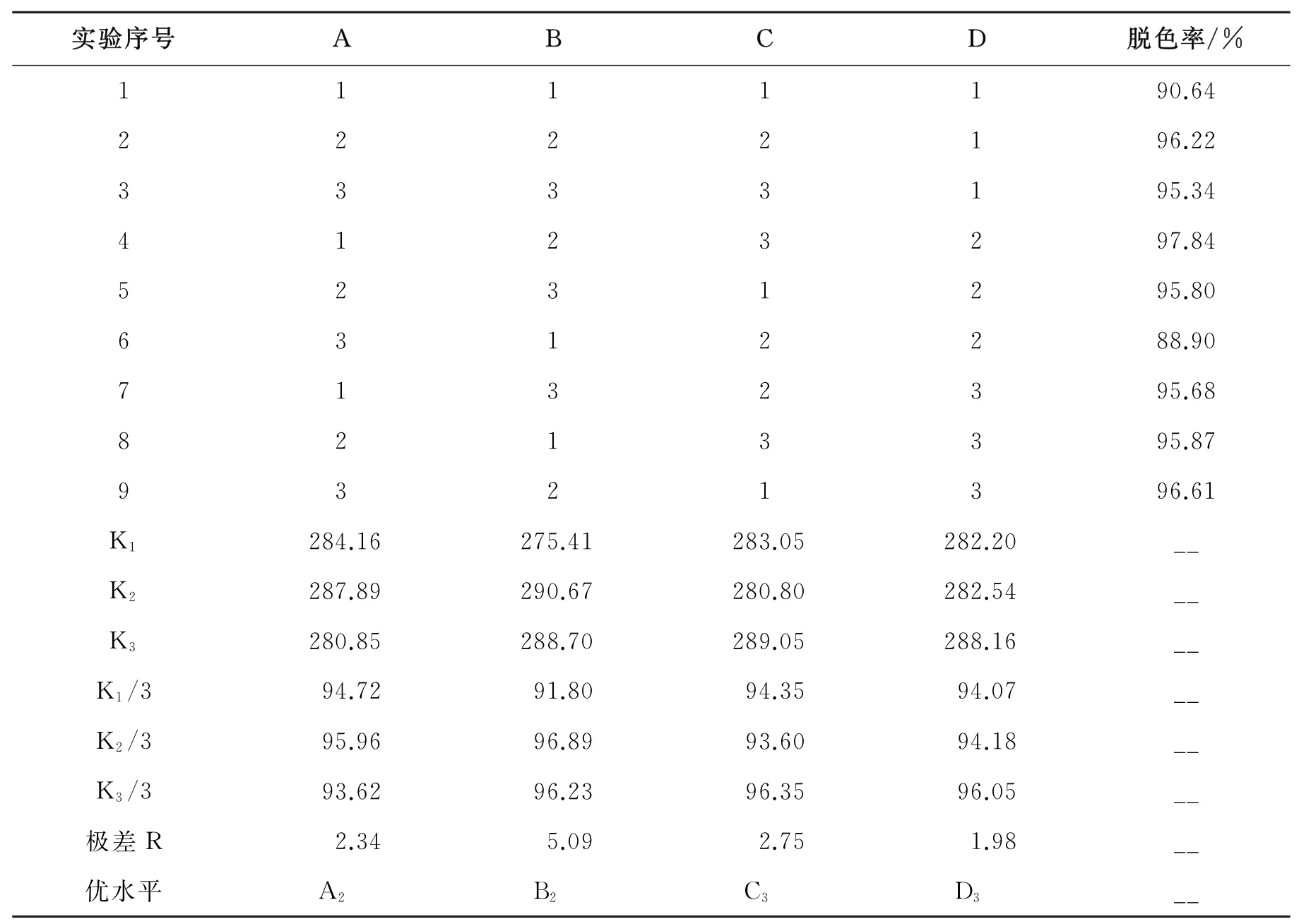
表3 正交实验结果
2.3.2 验证试验
根据正交试验结果B2C3A2D3为最佳试验方案,在正交试验结果基础上选定最优水平进行重复验证试验。以最优水平条件B2C3A2D3,即磁性Fe3O4加入量为0.060 g,3%(质量分数)H2O2加入量为1.2 m L,p H值为8.0,降解时间为70 min。进行了3次重复试验,脱色率平均值可达到97.97%。因此,正交试验优化效果较好,B2C3A2D3可用作最佳试验方案。
2.4 回收分析
将类Fenton反应后的磁性Fe3O4,使用磁倾析方法分离,用去离子水洗涤并真空烘干后,连续重复使用4次,发现甲基紫的去除率由97.97%降到了62.56%,有研究表明,磁性纳米Fe3O4在水溶液中容易团聚,而在潮湿的空气中又极易被氧化,这可能是造磁性成纳米Fe3O4类Fenton性能不稳定性的主要原因[15]。为了探究性能下降的原因,刘焕联等[2]将纳米Fe3O4洗涤并干燥后,对其结构进行表征后发现:纳米Fe3O4仍为球状,晶体结构并没有发生变化,但其粒径略微减小,且分散性明显下降,出现了团聚现象,从而导致Fe3O4的比表面积下降,吸附能力减小,这是处理效果降低的原因之一。
2.5 磁性纳米Fe3 O 4结构的表征
2.5.1 磁性纳米Fe3O4红外光谱分析
由图7可见,570 cm-1的吸收峰归属于Fe3O4的Fe-O键吸收峰[16]。

图7 磁性Fe3 O4纳米微球的红外图谱
2.5.2 磁性纳米Fe3O4的XRD表征
图8 为所制备样品的XRD图谱,与标准卡片JCPDSNO.65-3107中的数据对比可知未有其他杂峰,制备获得的是具有立方反尖晶石结构的纯相Fe3O4磁铁矿,其最高衍射峰为38°附近的311晶面的衍射峰,而且样品的衍射峰尖锐,信噪比较高,结晶度良好,纯度高[17]。

图8 磁性Fe3 O4纳米微球的XRD图谱
2.5.3 Fe3O4微粒合成机理和脱色反应机理分析
通过溶胶-凝胶法制备Fe3O4微粒,以FeSO4·7H2O作为铁源,与KOH反应生成Fe(OH)2和Fe(OH)3,在加热的条件下生成Fe3O4微粒,对甲基紫进行降解,其合成反应机理为:


生成的二价铁离子和三价铁离子与溶液中原有的H2O2形成芬顿试剂,形成链式反应从而不断生成·OH,·OH具有很强的氧化性,从而能够氧化有机染料而使其褪色。
3 结论
(1)在制备磁性纳米Fe3O4时,制备反应的时间、温度、溶剂配比均会对其降解甲基紫染料造成影响。这是由于不同配比下生成的磁性纳米Fe3O4粒径不同,表现出不同的磁特性,且反应的温度和时间均会影响Fe3O4颗粒的结构。经过试验,其制备FeSO4与KOH最佳摩尔比为1∶3,最佳反应温度为60℃,最佳反应时间为3 h。
(2)通过磁性纳米Fe3O4/H2O2类芬顿体系降解甲基紫染料的单因素试验与正交试验得知,影响甲基紫脱色率主次关系,依次为H2O2加入量>p H值>磁性Fe3O4加入量>降解时间。同时,最佳反应水平为:磁性Fe3O4加入量为0.060 g,p H为8.0,3%(质量分数)H2O2加入量为1.2 m L,反应时间为70 min。
(3)磁性纳米Fe3O4重复使用后催化性能下降,4次重复使用后降至62.56%。通过查询资料发现,在p H值为8.0的条件下,使用前后的纳米Fe3O4会发生团聚现象,比表面积减小,导致磁性纳米Fe3O4催化能力降低。

