VEGFR-3通过PI3K/AKT信号通路促进触液神经元增殖的作用机制
胡 茜 颜海健
贵州医科大学附属医院急诊科,贵州贵阳 550000
脊髓损伤(spinal cord injury,SCI)可致患者残疾[1-3]。神经干细胞巢中的触液神经元(cerebrospinal fluidcontacting neurons,CSF-CNs)的作用特殊,能通过释放活性物质促进神经修复[4-6]。血管内皮生长因子受体-3(vascular endothelial growth factor receptor-3,VEGFR-3)是神经细胞生长的调节剂[7-9],但机制有待探究。本实验首次研究VEGFR-3 对CSF-CNs 体外增殖的影响,通过观察VEGFR-3 对PI3K/AKT 信号通路的影响,探讨其促进脊髓修复的机制。
1 材料与方法
1.1 实验材料
SPF 级C57 新生3 d 健康小鼠10 只,体重1.5~2.5 g,雌雄不限,雅培奶粉(雅培公司,美国)喂养,贵州医科大学实验动物中心提供,实验动物许可证SYXK(黔)2018-0001,实验动物合格证NO.43072621 010022871,经贵州医科大学实验动物伦理委员会许可。DMEM 培养基、雷帕霉素、牛血清(武汉汉万科技有限公司),VEGFR-3 质粒(上海博达有限公司),GAPDH、HRP 标记二抗、PI3K、VEGFR-3、AKT、p-AKT(上海碧云天生物有限公司,货号分别为AF5201、A0208、ab32089、ab182651、ab179463、ab8805)。
1.2 研究方法
1.2.1 CSF-CNs 获取及鉴定 C57 新生3 d 鼠取颈髓组织获得CSF-CNs,采用神经元特异性烯醇化酶(neuron-specific enolase,NSE)鉴定CSF-CNs;利用CSFCNs 特异标志物PKD2L1 进一步验证,计算纯度:CSFCNs 纯度=PKD2L1 阳性细胞/DAPI 阳性细胞数[10]。实验独立重复3 次。
1.2.2 CSF-CNs 培养及分组处理 DMEM 培养液培养,隔日用含EDTA 的胰酶消化,当细胞密度达到80%,用胰蛋白酶进行消化传代。取CSF-CNs 分为四组:①正常对照组,DMEM 培养基培养;②空载质粒对照组,培养基中加入空载质粒;③VEGFR-3 质粒组,加入质粒转染稀释液100 μg,Western blot 检测正常对照组、空载质粒对照组和VEGFR-3 质粒组的VEG FR-3表达量,验证转染成功[11],实验独立重复3 次;④抑制剂组,转染成功的细胞加入10 μl PI3K/AKT 抑制剂LY294002,培养24 h。
1.2.3 神经球数目、直径检测 各组培养24 h 后,吹打神经球形成单细胞悬液,种植在24 孔板,每组3 个复孔。3 d 后,每组选择4 个视野检测神经球个数,选择15 个神经球测量神经球平均直径,各组重复测量5 次。实验独立重复3 次。
1.2.4 Western blot 检测 PBS 液洗涤3 次,添加细胞裂解液。各组取等量蛋白行SDS-PAGE 电泳,转PVDF 膜,5%脱脂牛奶封闭1 h。配制小鼠一抗VEGFR-3、PI3K、AKT、p-AKT、GAPDH 抗体(浓度分别为1∶1000、1∶200、1∶200、1∶200、1∶1000),一抗4℃孵育过夜;洗涤后,山羊抗小鼠IgG 1∶1000 室温孵育1 h,TBST 液洗涤,压片、照相,Image Pro Plus 7.0 进行图片分析。实验独立重复5 次。
1.3 统计学方法
采用SPSS 22.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间比较用t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 CSF-CNs 培养及鉴定
流式细胞分选获得CSF-CNs,用NSE 进行鉴定,见图1。检测标志物PKD2L1 抗体,其纯度为(90.1±1.1)%,确认为CSF-CNs,见图2(封三)。

图2 PKD2L1 免疫荧光鉴定CSF-CNs(n=3)(见内文第24 页)
2.2 转染效果
48 h 的VEGFR-3 质粒转染效率最高,见图3A。与正常对照组、空载质粒对照组比较,VEGFR-3 质粒组VEGFR-3 表达量增加,差异有统计学意义(P <0.05),见图3B。
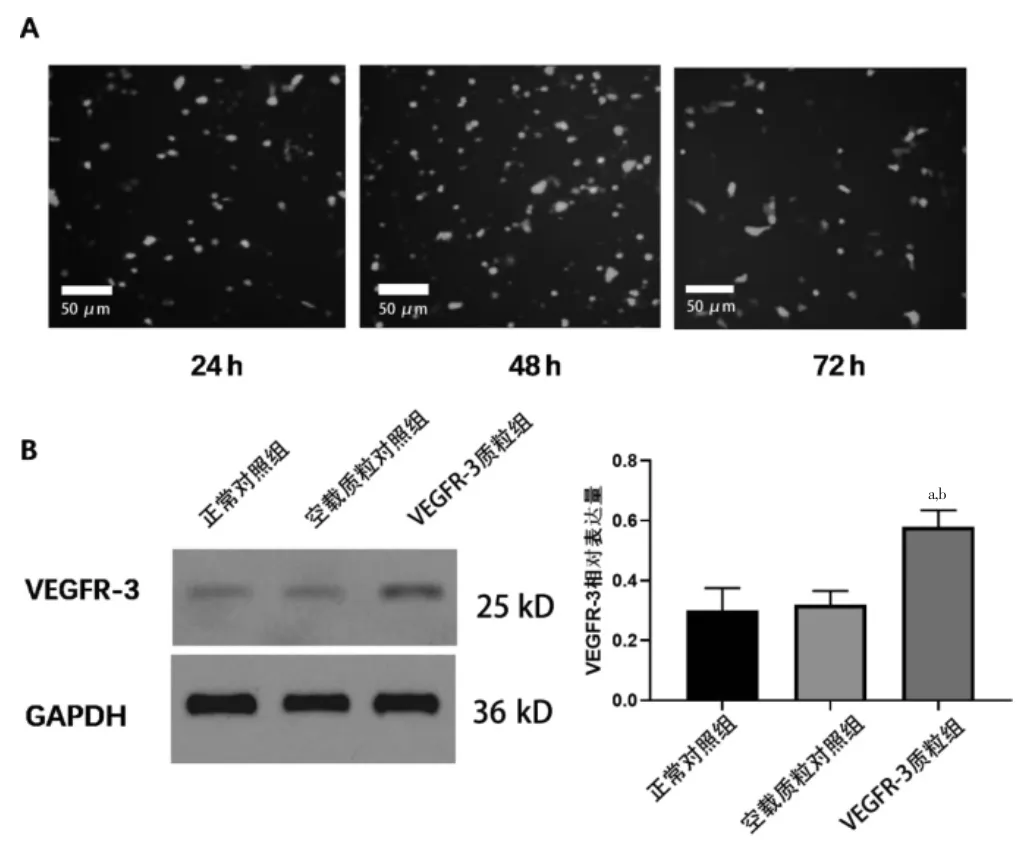
图3 VEGFR-3 质粒转染效果(n=3)
2.3 VEGFR-3 过表达促进CSF-CNs 增殖
正常对照组与空载质粒对照组神经球计数比较,差异无统计学意义(P >0.05);与空载质粒对照组、抑制剂组比较,VEGFR-3 质粒组神经球的计数比较,差异有统计学意义(P <0.05)。见表1。
表1 各组神经球计数比较(,n=3)
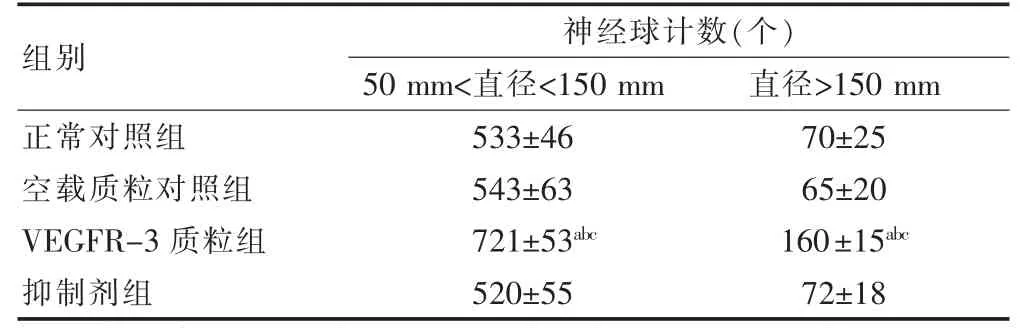
表1 各组神经球计数比较(,n=3)
注:与正常对照组比较,aP <0.05;与空载质粒对照组比较,bP <0.05;与抑制剂组比较,cP <0.05。VEGFR-3:血管内皮生长因子受体-3
2.4 各组PI3K、AKT 及p-AKT 表达水平比较
正常对照组与空载质粒对照组比较,差异无统计学意义(P >0.05);与空载质粒对照组、抑制剂组比较,VEGFR-3质粒组PI3K、AKT及p-AKT表达升高,差异有统计学意义(P <0.05)。见图4。
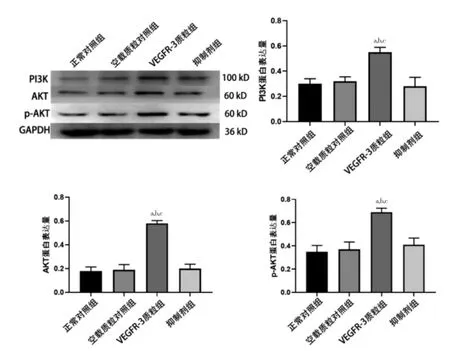
图4 各组PI3K、AKT 及p-AKT 蛋白表达水平(n=5)
3 讨论
SCI 可进一步破坏脊髓组织,引起脑脊液变化[12-17]。CSF-CNs 可以与脑脊液、脊髓实质接触,将脊髓实质和脑脊液有效联系在一起,在SCI 修复中有重要作用[18-20]。
本研究利用C57 新生小鼠分离CSF-CNs,将其培养成神经球并观察其增殖情况,验证了CSF-CNs具有神经干细胞属性。此外,本研究还进一步证实CSF-CNs 能特异表达VEGFR-3,并且VEGFR-3 可以通过调控PI3K/AKT 信号通路促进CSF-CNs 增殖。本研究猜测CSF-CNs 在AKT 信号激活后作用于脊髓实质,促进脊髓修复。
VEGFR-3 与特异性配体VEGF-C 结合可激活多种信号[21-22],诱导细胞增殖[23-25]。其中PI3K/AKT 信号通路介导丝裂原依赖性生长和存活,是重要的信号转导通路,该通路的激活可明显抑制SCI 引起的细胞凋亡[26-28]。
综上所述,在CSF-CNs 中VEGFR-3 可以调控PI3K/AKT 通路促进细胞增殖,LY294002 能阻断该通路抑制CSF-CNs 增殖。

