黄精转录组特性分析及相关功能基因研究
王 宇,谭福燕,张利萍,何玉丰,范建辉,李 旺,彭柿杰,邱庆华
(1.攀枝花学院 附属医院,四川 攀枝花 617000;2.攀枝花学院 医学院,四川 攀枝花 617000;3.攀枝花学院 康养学院,四川 攀枝花 617000)
黄精(Polygonatum sibiricum)是我国传统中药,为百合科黄精属多年生草本植物,常呈圆柱状,结节膨大,根茎可入药[1].最早关于黄精的记载来自《名医别录》:“性平、味甘,归脾、肺、肾经,具有补肾益精、滋阴润燥的功能,用于滋补强身和肺虚燥咳及医治肾虚精亏之证,久服轻身、延年、不饥[2].”现代药理学研究证实,黄精具有抗肿瘤、抗氧化、抗衰老、抗抑郁,调节免疫和血糖,抑制骨质疏松,改善睡眠等作用[3-5].此外,黄精还有丰富的营养成分,可以作为一种食材.
黄精的主要有效成分为多糖、皂苷和黄酮,但核心的药用功效还需进一步验证[6].目前,关于黄精的研究主要集中在药理活性、化学成分、提取工艺和临床应用等方面,关于重要功能基因及转录组信息的研究却很少,限制了黄精的深入开发及遗传改良等后续工作的开展.目前,国内外学者尚未对黄精的基因组和转录组进行研究,只是对黄精叶绿体基因组进行了测序[7].因此,本研究通过转录组学分析挖掘重要的代谢成分以及标记基因,有利于为黄精药性理论研究和优良品种的选育奠定基础.
本实验利用高通量测序技术对黄精进行转录组分析,得到关于多糖、皂苷、黄酮等多种代谢产物的分子数据,对功能注释、分类和代谢通路进行分析,找出黄精的药用成分以及次生代谢相关的功能基因,为黄精遗传育种和生命节律研究提供丰富的数据资源.
1 材料与方法
1.1 材料
1.1.1实验材料 植株由攀枝花市丰盛源农林开发有限公司提供.
1.1.2主要仪器与试剂 凝胶成像系统和电泳仪购于美国伯乐公司,超微量核酸分析仪购于杭州奥盛仪器有限公司,RNA 提取试剂盒、反转录试剂盒和纯化试剂盒购于天根生化科技有限公司.
1.2 方法
1.2.1黄精RNA的提取 按照RNA 提取试剂盒说明提取黄精总RNA,使用凝胶电泳和超微量核酸分析仪对质量和浓度进行分析.
1.2.2文库的构建及测序 用磁珠富集poly(A)mRNA,随后以mRNA 为模板,经逆转录反应合成第一链cDNA和第二链cDNA,随后用纯化试剂盒纯化cDNA,将纯化的双链cDNA进行末端修复、加尾和加接头,构建成cDNA 文库,利用Illumina HiSeq 平台测序.
1.2.3Unigene 序列的获得和生物信息学分析对获得的初始数据用软件Cutadapt 去除接头,采用组装软件Trinity 对样品数据从头组装,组装分析后得到Unigene序列,使用BLAST将获得的Unigene序列与Nr、Swi-ssProt、GO、KEGG和COG数据库进行序列比对,得到黄精基因的蛋白功能注释和分类.
2 结果
2.1 转录组数据分析一共获得原始数据4.37 G,经处理后得到有效数据4.35 G(表1),146 072条Unigene,92 865 800 个碱基,Unigene 最大为8 827 bp,最小为201 bp,平均为635.75 bp.不同长度Unigene分布比例显示(表2):长度在200~500 bp的Unigene 占64.10%,长度≥2 000 bp 的占4.92%.

表1 黄精初始数据统计Tab.1 Initial data statistics of Polygonatum sibiricum
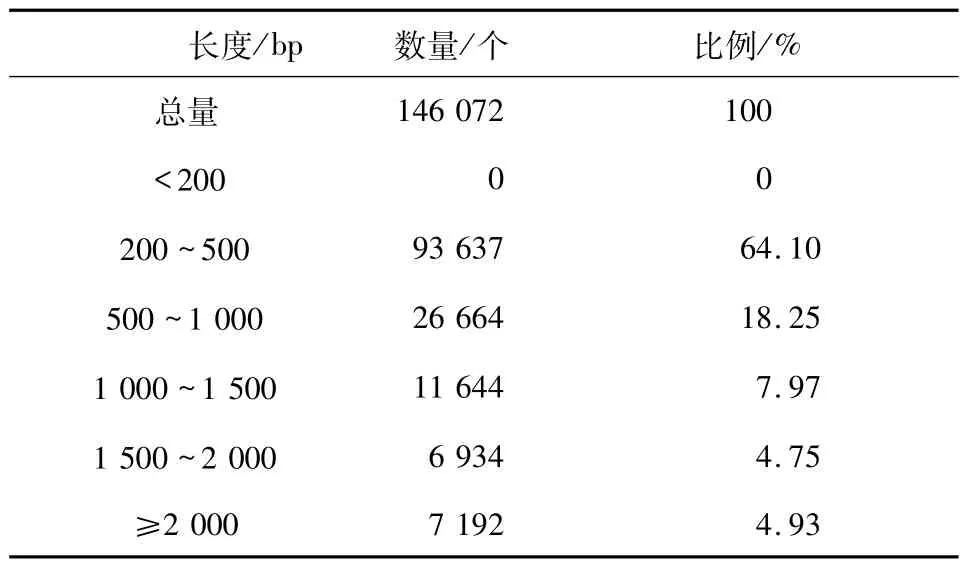
表2 Unigene 不同长度分布比例Tab.2 Distribution of Unigene different length
2.2 Unigenes 功能注释将组装得到的146 072条Unigene 序列与NR、Swiss-Prot、KOG、KEGG 数据库比对,75 845 条Unigene 在NR 数据库中获得注释,占51.92%,;52 802 条在Swissprot 数据库中获得注释,占36.14%;41 239 条Unigene 在COG 数据库中获得注释,占28.23%;11 789 条在KEGG数据库中获得注释,占8.07%(表3).
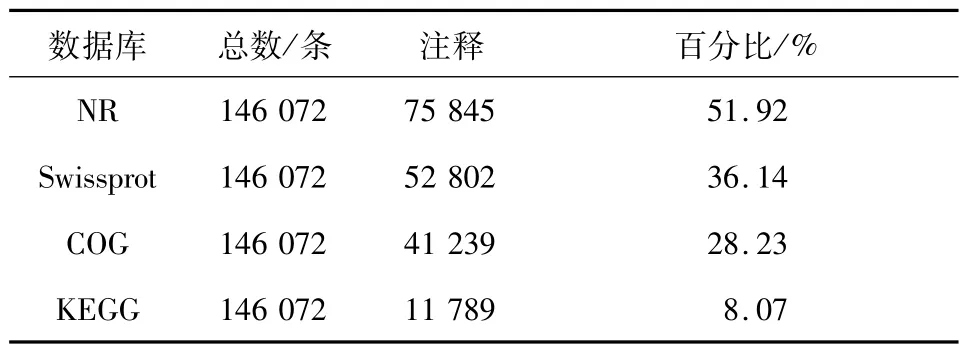
表3 Unigene功能注释Tab.3 Unigene function annotated
2.3 NR 数据库注释与分类通过BLAST 与NR数据库进行对比,结果如图1 所示(1 鸡血藤,2 指趾凤凰,3 马六甲,4 肩胛鱼,5 莲属,6 葡萄,7 粳稻群体,8 滴虫,9 木豆,10 甜橙):在鸡血藤和指趾凤凰中获得同源注释的Unigene 数量最多,分别占29.90%和22.80%,在马六甲、肩胛鱼、莲属、葡萄中获得同源注释的Unigene 数量较多,分别占9.20%、5.80%、3.00%和1.90%,还有较少Unigene注释到粳稻群体、滴虫、木豆、甜橙中,分别占比0.90%、0.80%、0.69%和0.68%,其余24.33%注释到其它物种中.
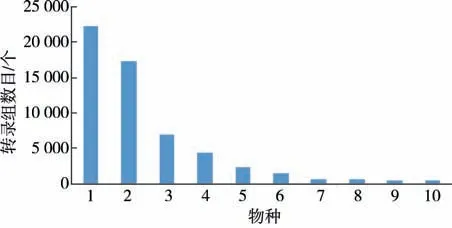
图1 NR 库中主要物种分布Fig.1 Main species distribution in NR
2.4 COG 数据库注释与分类将所有Unigene与COG 数据库进行比对,预测基因功能并分类统计,见图2(A:RNA 过程与修饰;B:染色质结构和变化;C:能量生产和转化;D:细胞循环控制,细胞分裂及染色体参与;E:氨基酸运输和新陈代谢;F:核苷酸运输和新陈代谢;G:糖类运输和代谢;H:辅酶运输和代谢;I:脂类运输和代谢;J:翻译,核糖体结构和生物合成;K:转录;L:复制,重组和修补;M:细胞壁膜生物合成;N:细胞移动;O:翻译后修饰蛋白质折叠和分子伴侣;P:无机离子运输和代谢;Q:次生代谢合成运输和代谢;R:一般功能预测;S:未知功能;T:信号传导机制;U:细胞内交通分泌及囊泡运输;V:防御机制;W:细胞外结构;X:未知;Y:核结构;Z:细胞骨架).结果表明:46 414 条Unigene注释到26 种COG 分类中,其中一般功能预测基因最多,为5 332 个,占11.5%;其次,涉及翻译后修饰蛋白质折叠和分子伴侣的基因也较多,为5 100个,占11.0%;而涉及细胞外结构、核结构以及细胞移动的基因较少,分别占比0.04%、0.23%和0.49%.
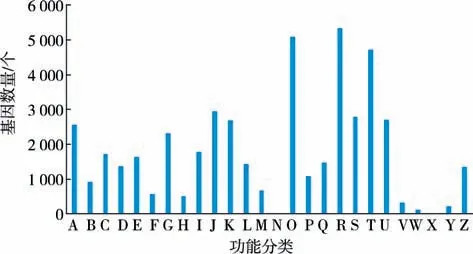
图2 COG 功能注释分布Fig.2 The annotation distribution of COG’function
2.5 GO 注释与分类36 724 条Unigenes 在GO分类中被注释到生物进程、细胞组分和分子功能相关3 个类别52 个小组中(图3)(1 代谢过程,2 细胞过程,3 单一生物过程,4 生物调节,5 对刺激的反应,6 本土化;7 发展过程,8 多生物过程,9 生长、增长、发展、种植,10 免疫系统过程,11 细胞成分组织或生物发生,12 有节奏的过程,13 生殖过程,14运动,15 生物粘附,16 再生产,17 发信号,18 行为,19 生物学阶段,20 多细胞生物过程,21 细胞杀伤,22 细胞部分,23 细胞器,24 膜,25 细胞器部分,26大分子复合物,27 膜部分,28 细胞外区域,29 膜封闭的管腔,30 细胞连接,31 类核,32 病毒部分,33细胞外区域部分,34 细胞外基质成分,35 病毒,36其他生物部分,37 细胞外基质,38 粘合物,39 催化活性,40 转运活动,41 结构分子活动,42 电子载体活动,43 核酸结合转录因子活性,44 酶调节剂活性,45 抗氧化活性,46 分子换能器活动,47 脒-核苷酸交换因子活性,48 分子功能调节剂,49 蛋白结合转录因子活性,50 营养库活性,51 金属伴侣活性,52 蛋白质标签).在生物进程类别中,参与代谢过程(4 463 个)、细胞过程(3 763 个)和单一生物过程(1 945 个)的基因数量多;在细胞组分类别中,细胞部分(3 161个)、细胞器(2 293 个)和膜(1 312个)功能组包含的Unigenes 数量最多;在分子功能类别中,注释较多的主要有粘合物(5 828 个)、催化活性(5 532个)和转运活动(604 个)功能组.
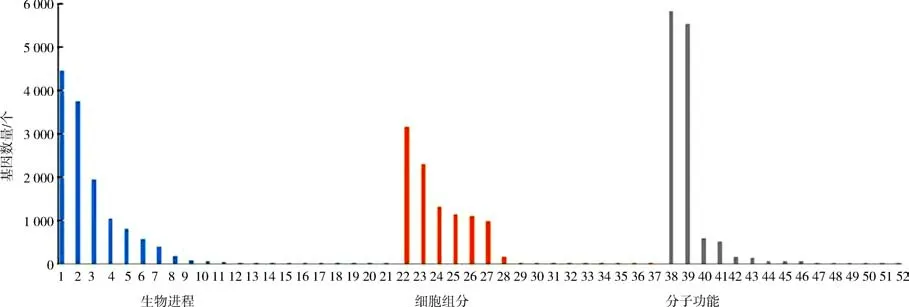
图3 GO 注释分布结果Fig.3 GO classification analysis of all unigenes
2.6 KEGG 注释与分类在KEGG 代谢通路注释中,Unigenes 主要被注释到核糖体、碳代谢、氨基酸等生物合成相20 个KEGG 代谢通路中(图4),其中代谢途径通路注释的基因数最多,为4 316,其他次生代谢产物合成通路注释基因数次之,为2 294.
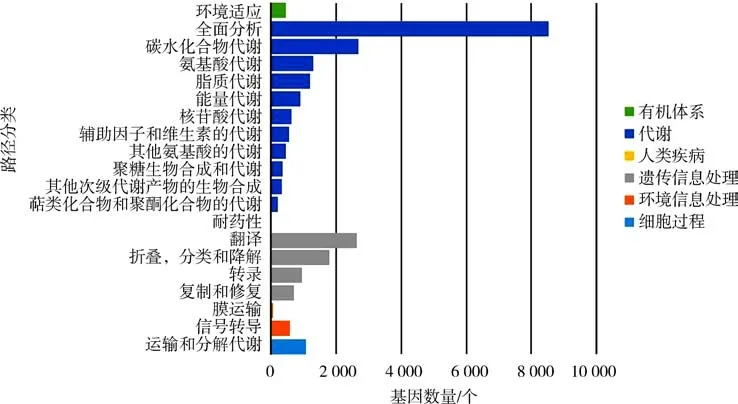
图4 主要的KEGG pathway 类型归纳统计Fig.4 Inductive statistics of main KEGG pathway types
2.7 参与黄精多糖、甾体皂苷、黄酮生物合成的催化酶基因筛选本研究结合多糖类化合物、甾体皂苷类化合物及黄酮类化合物生物合成途径进行分析.根据Unigene功能注释,鉴定出21 种共165 个可能参与黄精多糖生物合成的关键酶基因(表4).主要包括己糖激酶(hexokinase,HK)、甘露糖-1-磷酸鸟嘌呤基转移酶(mannose-1-phosphate guanylyltransferase,GMPP)和β-呋喃果糖苷(beta-fructofuranosidase,sacA)等,筛选出22 种共125 个可能参与甾体皂苷生物合成途径的催化酶基因(表5).共鉴定出参与甲羟戊酸(MVA)途径的关键酶25 个,2-甲基-D-赤藻糖醇-4-磷酸(MEP)途径的关键酶31 个,以及下游途径的关键酶69 个;筛选鉴定出10 种35个黄精黄酮类化合物合成相关的基因(表6),主要是查尔酮合酶(Chalcone synthase,CHS)和查尔酮异构酶(Chalcone isomerase,CHI)等.
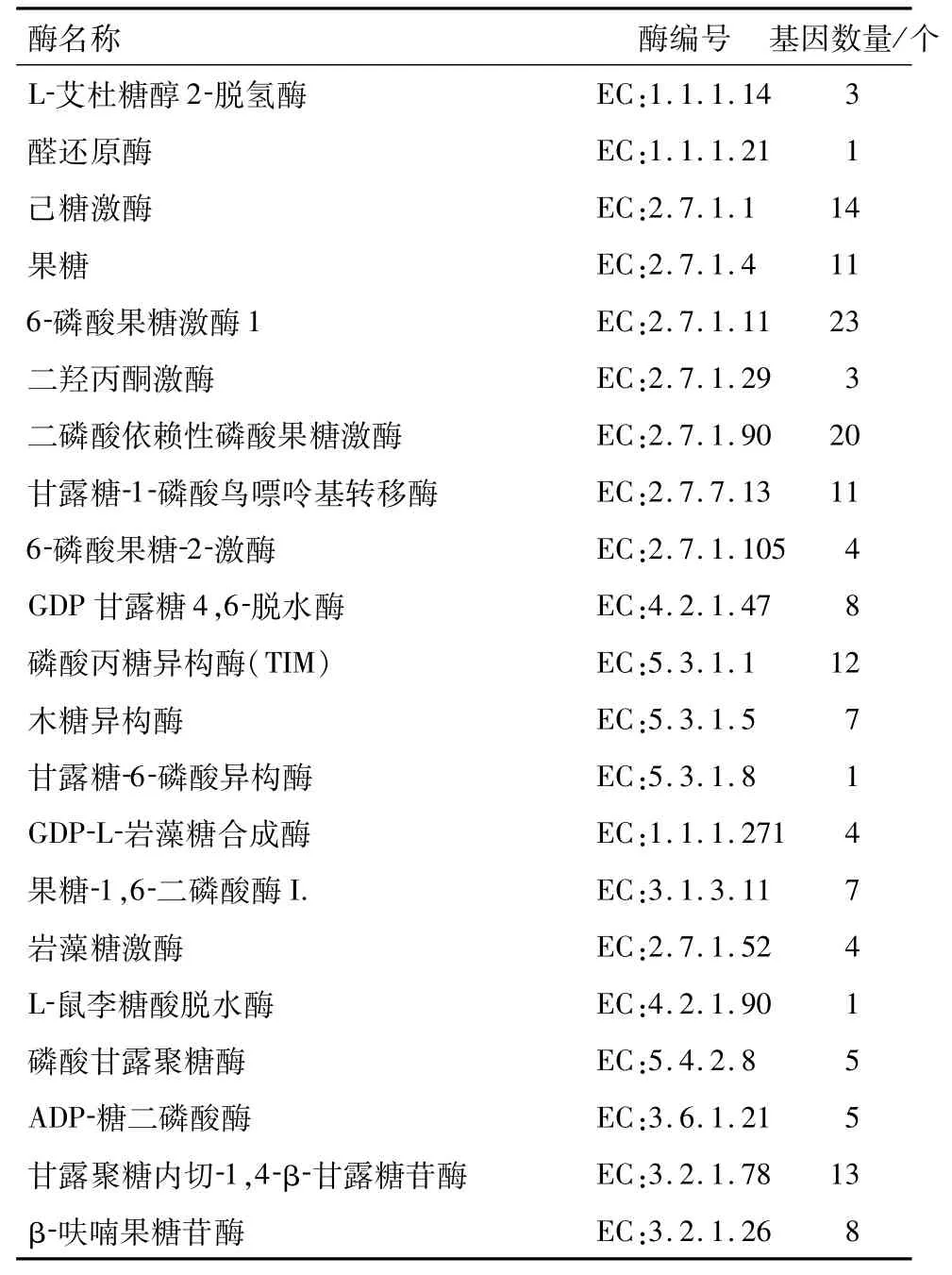
表4 黄精多糖代谢的关键酶Tab.4 Key enzymes involved in fructose and mannose metabolism
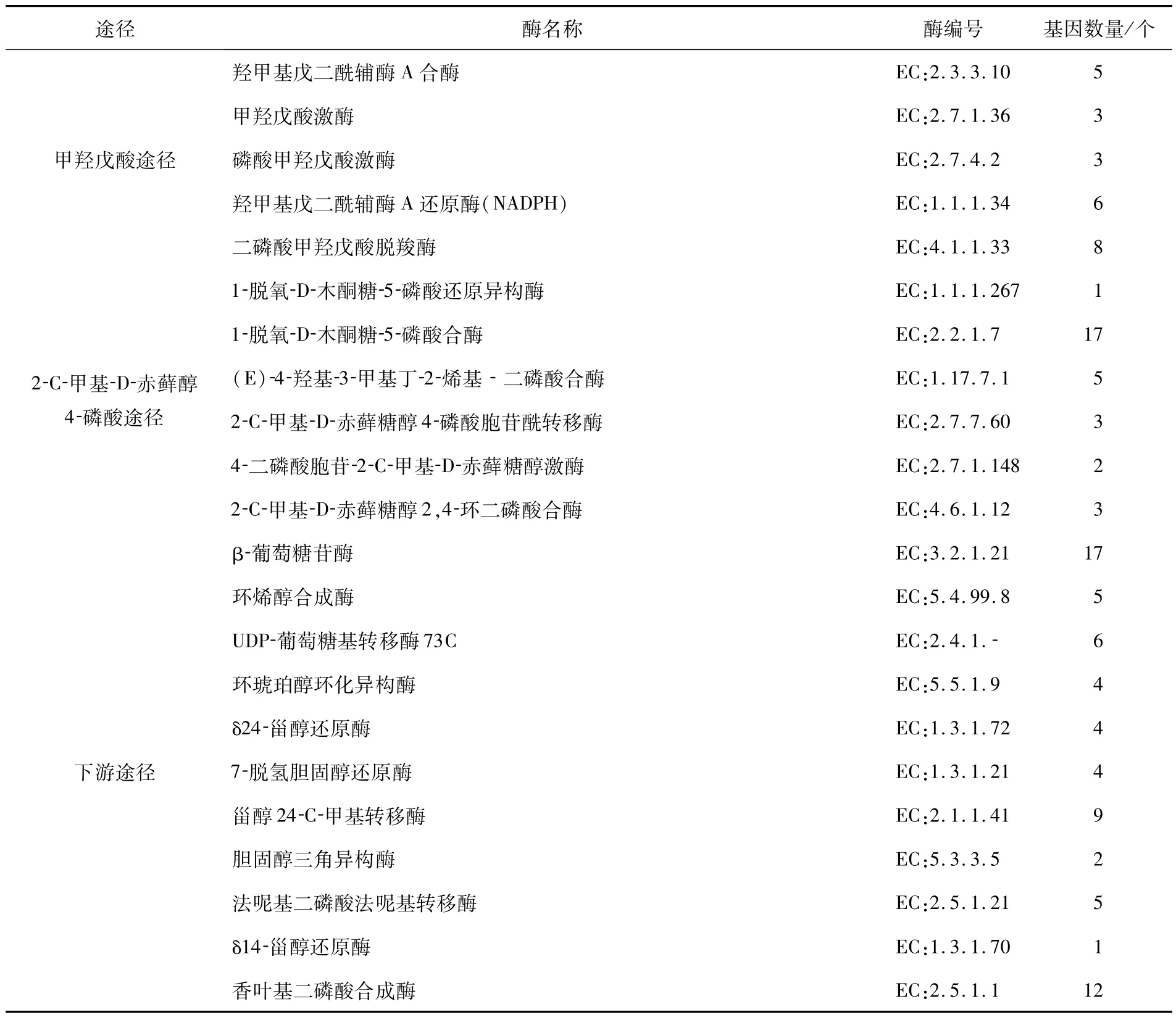
表5 皂苷元生物合成的关键酶Tab.5 Key enzymes involved in sapogenin biosynthesis
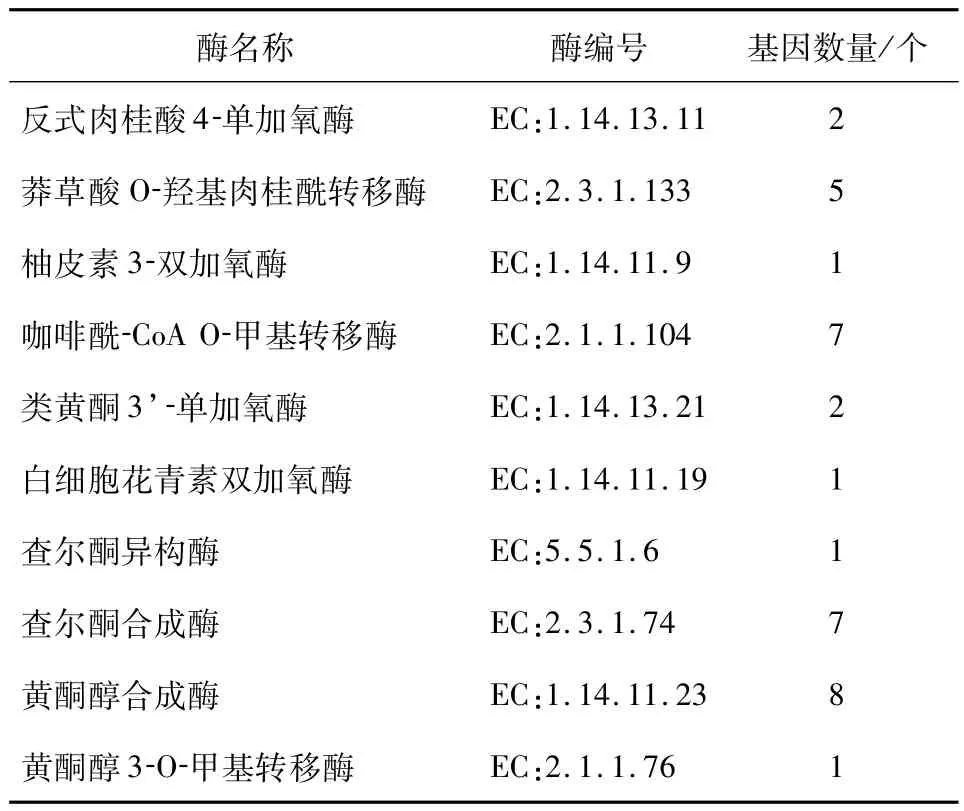
表6 黄酮类化合物合成的关键酶Tab.6 Key enzymes in the synthesis of flavonoids
3 讨论
本研究通过转录组分析和序列组装拼接得到146 072个Unigene.黄精多糖均由阿拉伯糖、葡萄糖、甘露糖与半乳糖组成,其中甘露糖含量最高.黄精多糖具有抗肿瘤、降低血糖和防止动脉粥样硬化的药理功效[8-9].本研究共筛选出21 种(165 条unigene)可能参与黄精多糖生物合成的关键酶基因,其中主要有己糖激酶、甘露糖-1-磷酸鸟嘌呤基转移酶和β-呋喃果糖苷.有研究发现[10],多糖含量与甘露糖-1-磷酸鸟嘌呤基转移酶、β-呋喃果糖苷的表达量成正相关,但与己糖激酶的表达量呈负相关,由此,可通过检测这几种基因的表达量来判别黄精的多糖含量,进而选育高品质的黄精植株培育.β-呋喃果糖苷酶具有蔗糖水解酶活性,不受生物碱活性影响,这一功能基因的存在可能与黄精抗生物胁迫相关.
黄精中甾体皂苷类成分可广泛参与避孕药、消炎药等药物合成[11],还具有抗抑郁、抗肿瘤、抗炎和抗病毒等功效[12].本实验筛选到了甾醇24-C-甲基转移酶、环烯醇合成酶和UDP-葡萄糖基转移酶73C 等关键酶基因可能参与黄精甾体皂苷类成分下游合成的生物途径.目前,国内外分别从燕麦[13]、盾叶薯蓣[14]中发现了与甾体皂苷生物合成的关键酶基因.本研究在黄精的转录组中总共有6条Unigene 被注释为UDP-糖基转移酶(Uridine diphosphate-glycosyltransferases,UGTs),为 UTG73类型.UGTs常参与次生代谢产物合成的最后阶段,对于生物活性成分终端产物的结构修饰、稳定性和多样性具有重要意义.据报道,GT73B6 是直接催化生成红景天苷的关键酶[15],UGT73C6 与黄酮类化合物的糖基化相关[16].因此,后续研究可着重对UTG73C 做进一步的表达分析与功能验证,以挖掘出确实与黄精甾体皂苷生物合成相关的甾体皂苷糖基转移酶基因.
黄酮类化合物具有广泛的药理活性,如抗菌、抗氧化和抗肿瘤的作用[17].因此,研究与黄酮类化合物合成的相关功能基因具有重要作用,本研究共筛选出10 种(35 条unigene)可能参与黄酮类化合物合成的关键酶基因.其中包括查尔酮合酶(CHS)、查尔酮异构酶(CHI)等关键酶基因.CHS是类黄酮生物合成途径中的第一个关键酶.国内外已从百合[18]、蝴蝶兰[19]中克隆并鉴定了CHS 基因.CHS可参与植物花色素的形成及增强植物防御病原体[20],还可调控花粉粒中类黄酮的积累,影响其常规授粉[21].查尔酮异构酶作为类黄酮合成途径中的第二限速酶,Muir 等[22]把矮牵牛中编码的CHI基因转入番茄中,由于芦丁的累积,导致转基因番茄果皮中的黄酮醇含量显著增加.拟南芥中III型CHI具有脂肪酸结合蛋白功能,可以影响植物细胞中脂肪酸的生物合成,且储存于发育中的胚胎中[23],但目前还没有关于黄精中CHS 和CHI关键酶基因的功能研究,因此,有待进一步探究.
黄精药理价值广泛,因此,挖掘参与调控黄精多糖、甾体皂苷和黄酮等质量标志性成分的功能基因,开展种内聚合杂交技术,选育优良品种,有利于黄精资源更好的开发利用.
致谢国家级大学生创新创业基金资助项目(202011360025)对本文给予了资助,谨致谢意!

