玻璃化冷冻和程序化冷冻人卵巢组织的效果
刘艳丽 申峻涵 杜姗姗 刘景 申春艳 肖小帅 管一春
郑州大学第三附属医院生殖中心(郑州450000)
近年来,恶性肿瘤的发病率逐年增高且呈年轻化,其中70%肿瘤患者有生育需求[1]。医疗技术的进步和治疗方案的改进使肿瘤患者生存率得到明显提高,但肿瘤的化、放疗及手术治疗对患者的生育力带来不可逆转的损伤,造成女性卵巢早衰、闭经甚至生育力丧失,严重影响其生殖功能和生存质量[2]。因此,生育力保存成为亟待解决的热点问题。
女性生育力保存方法包括卵子冷冻、胚胎冷冻和卵巢组织冷冻[3]。卵子/胚胎冷冻保存技术是一项非常成熟的技术,但需控制促排卵过程,可能会延迟疾病的治疗,对青春期前女性、儿童和激素依赖性肿瘤患者进行超促排卵亦为禁忌。卵巢组织冷冻技术可一次性将数百甚至上千个窦前卵泡保存起来,不仅保存了生育能力,还能恢复生殖内分泌功能。卵巢组织冷冻适合于青春期前HPO 轴未成熟、没有足够时间进行超促排卵和激素敏感性肿瘤患者[4],成为保存女性生育力最具潜力的选择。卵巢组织冷冻常用的方法有玻璃化冷冻法和程序化冷冻法,不同的学者对两种方法效果孰优孰劣存在着争议,尚未定论。因此,本文针对这一问题,从组织学、单个卵泡的分离计数和卵巢组织体外培养等方面对不同卵巢组织冷冻方案冷冻效果进行评价,为临床开展卵巢组织冷冻工作提供实验基础。
1 材料与方法
1.1 卵巢组织来源收集2020年1-12月在郑州大学第三附属医院12 例因卵巢疾病患者需手术切除的卵巢组织标本。患者年龄28 ~ 37 岁,其中卵巢浆液性乳头状囊腺瘤2 例,宫颈癌行附件切除术3 例,畸胎瘤2 例,卵巢巧克力囊肿5 例。患者近6 个月无服用激素药物史,术前3 个月未进行放化疗。本研究经郑州大学第三附属医院伦理委员会批准,患者均签署知情同意书。
1.2 卵巢皮质的制备将手术切除的卵巢组织用生理盐水冲洗干净,去除血迹。在超净工作站内处理卵巢组织。若卵巢组织表面有肉眼可见的卵泡,用注射器抽取卵泡液,用眼科剪小心去除卵巢髓质,将卵巢皮质处理至1 mm 厚度。用手术刀将处理好的卵巢皮质剪成10 mm×10 mm×1 mm 的组织块,并随机分为新鲜对照组、程序化冷冻组和玻璃化冷冻组,每组6 块进行后续的实验,其中新鲜对照组未经过冷冻处理。
1.3 卵巢组织的玻璃化冷冻及复苏采用商品化的试剂盒(KITAZATO VT301S/VT302S)。在室温条件下,将卵巢皮质片放入冷冻液1(cryo1)和冷冻液2(cryo2)中各5 min,然后在玻璃化液3(cryo3)中15 min 进行组织的透化脱水,最后放在冷冻载杆上,投入液氮中冷冻保存。复苏时取出待解冻的卵巢组织片,迅速投入37 ℃的解冻液1 中,1 min后于室温下依次放在解冻液2 中3 min 和解冻液3中5 min。
1.4 卵巢组织的程序化冷冻及复苏冷冻液是含有10%白蛋白的PBS 基础液,将处理好卵巢皮质块切片放置预先加入0.8 mL 冷冻保护液(1.5 mol/L DMSO、0.1 mol/L 蔗糖)的冷冻管中,4 ℃平衡25 min后放入可编程冷冻仪中,按以下程序进行冷冻:从20 ℃开始以2 ℃/min 降至-8 ℃,植冰,保持10 min,再以0.3 ℃/min 降至-30 ℃,以30 ℃/min 降至-197 ℃,直接投至液氮中冷冻保存。复苏时从液氮罐中取出冷冻管,室温2 min,37 ℃水浴箱中水浴2 min,肉眼可见冰晶完全溶解后,取出卵巢组织置于培养液中。
1.5 卵巢组织的形态学分析将新鲜组、玻璃化冷冻组和程序化冷冻组的卵巢组织各两片置于4%多聚甲醛中固定,石蜡包埋,以4 μm 厚度连续切片,苏木精和伊红染色(hematoxylin and eosin,HE)进行染色。所有组织均进行连续切片,在高倍显微镜下随机选择含有卵泡的10 个视野进行形态学分析。根据国际认可的Gougeon 标准进行卵泡分级,完整的卵泡形态有完好的细胞核,核内核仁清晰,卵泡基底膜完整,卵泡周围的颗粒细胞分布均匀。若出现卵母细胞皱缩或核固缩、颗粒细胞排列紊乱、颗粒细胞与卵母细胞分离或与卵泡周围的基膜分离及基底膜不完整中任一项,视为异常卵泡。卵泡的完整率=计数的完整卵泡数/计数的所有卵泡数。另根据组织学分析结果筛选出8 例患者卵巢组织中富含各级卵泡,用于后续的卵泡计数和卵巢皮质培养。
1.6 卵巢组织中卵泡的计数将新鲜对照组、玻璃化冷冻组和程序化冷冻组的卵巢组织块,采用机械法和酶法进行消化,将卵巢组织放入1.5 mL的EP 管中,用眼科剪将卵巢组织剪碎,加入1 mL Liberase DH 酶于37 ℃恒温水浴箱消化,消化完全后加入终止液,离心后留取0.5 mL 混悬液倒入培养皿中,在体视显微镜下用170 μm 的剥卵针挑取各级窦前卵泡并分类计数,卵泡分级标准参照Gougeon 分级标准。
1.7 卵巢皮质的体外培养E2水平可以反映卵巢组织的内分泌功能和卵泡的活性的主要指标。分别取新鲜对照组、玻璃化冷冻组和程序化冷冻组的卵巢组织块放在四孔培养皿中,每孔加入0.6 mL 培养液中进行培养,每48 小时进行半量换液,收集体外培养卵巢组织的培养液,采用电化学光法检测培养液中E2水平(仪器和试剂均为罗氏),判断不同冷冻方法对卵巢组织中卵泡内分泌功能的影响。
1.8 统计学方法采用SPSS 22.0 统计软件进行数据分析。计量资料采用均数±标准差表示,计数资料采用率(%)表示;根据分组方法,计量资料采用随机区组设计方差分析;分类变量采用Cochran′s 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 卵巢组织形态学改变与新鲜卵巢组织相比,玻璃化冷冻组始基卵泡和窦前卵泡形态学上无明显差异,结构完整,颗粒细胞分布均匀,基质紧密,仅少数次级卵泡出现仅卵母细胞形态不规则,细胞质内出现空泡,核浓缩;程序化冷冻组卵巢组织次级卵泡皱缩现象明显增多,颗粒细胞排列紊乱、缺失、塌陷等损伤表现,间质疏松;程序化冷冻组次级卵泡形态学上损伤高于玻璃化冷冻组,见图1。
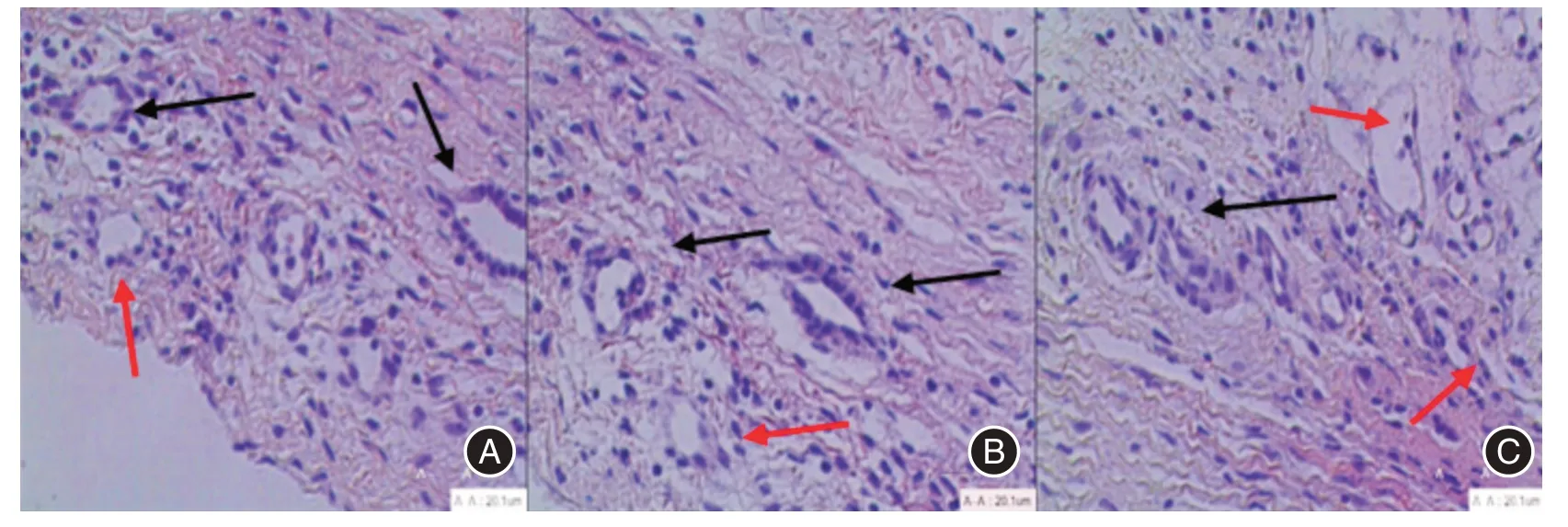
图1 各组卵巢组织中的卵泡形态(HE×400)Fig.1 Follicular morphology in ovarian tissues of each group(HE×400)
计数新鲜对照组、玻璃化冷冻组和程序化冷冻组卵巢组织各级卵泡,玻璃化冷冻组和程序化冷冻组始基卵泡的完整率均明显低于新鲜对照组(P<0.001);程序化冷冻组的次级卵泡完整率明显低于新鲜对照组(P<0.05)。见表1。
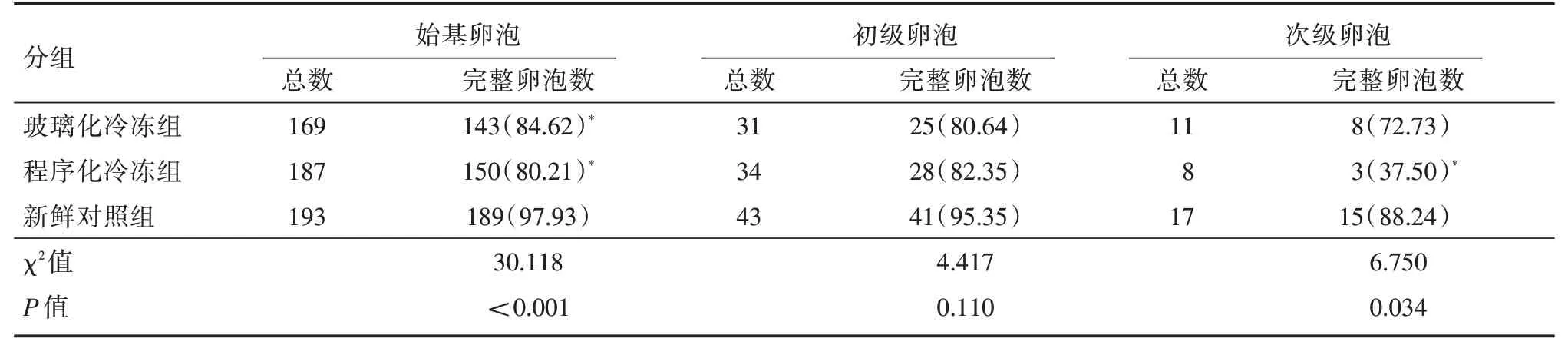
表1 不同冷冻方案各级卵泡的完整率Tab.1 The follicle integrity rate in all levels with different freezing methods 例(%)
2.2 卵巢组织混悬液中不同级别卵泡的计数程序化冷冻组卵巢组织混悬液始基卵泡、初级卵泡和次级卵泡的密度均明显低于新鲜对照组(P<0.05);玻璃化冷冻组卵巢组织混悬液中初级卵泡和次级卵泡密度和新鲜对照组差异无统计学意义(P>0.05)。见表2。卵巢组织混悬液中各级卵泡的形态见图2。

图2 卵巢组织混悬液中分离出的各级卵泡(×400)Fig.2 All levels of Follicles isolated from ovarian tissue suspension(×400)
表2 不同冷冻方案卵巢组织混悬液中各级卵泡的计数Tab.2 The number of follicles in ovarian tissue suspension with different Freezing methods±s,个/100 μL 混悬液
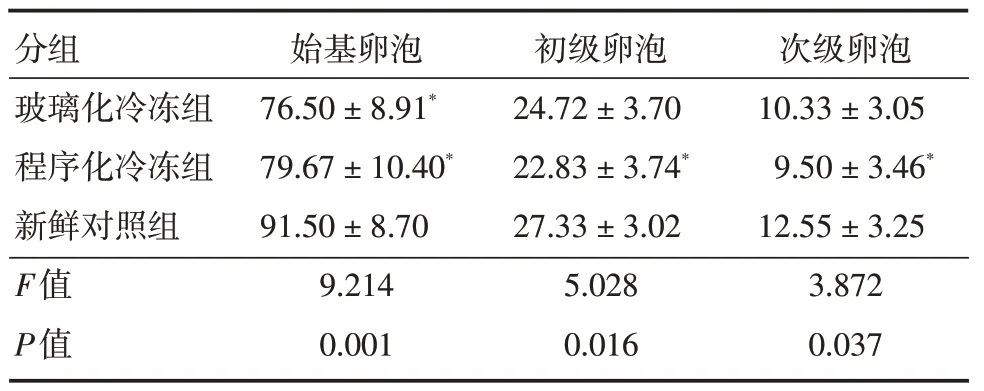
表2 不同冷冻方案卵巢组织混悬液中各级卵泡的计数Tab.2 The number of follicles in ovarian tissue suspension with different Freezing methods±s,个/100 μL 混悬液
注:与新鲜对照组相比,*P<0.05
分组玻璃化冷冻组程序化冷冻组新鲜对照组F值P值始基卵泡76.50±8.91*79.67±10.40*91.50±8.70 9.214 0.001初级卵泡24.72±3.70 22.83±3.74*27.33±3.02 5.028 0.016次级卵泡10.33±3.05 9.50±3.46*12.55±3.25 3.872 0.037
2.3 卵巢组织体外培养上清液中E2 水平卵巢皮质体外培养初期阶段(D2⁃D6),玻璃化冷冻组和程序化冷冻组卵巢皮质体外培养的雌二醇水平均低于新鲜卵巢组,差异有统计学意义(P<0.05);当培养至D8,程序化冷冻组E2水平明显低于新鲜对照组,D10⁃D14,两冷冻组E2水平与新鲜对照组差异无统计学意义(P>0.05)。见图3。
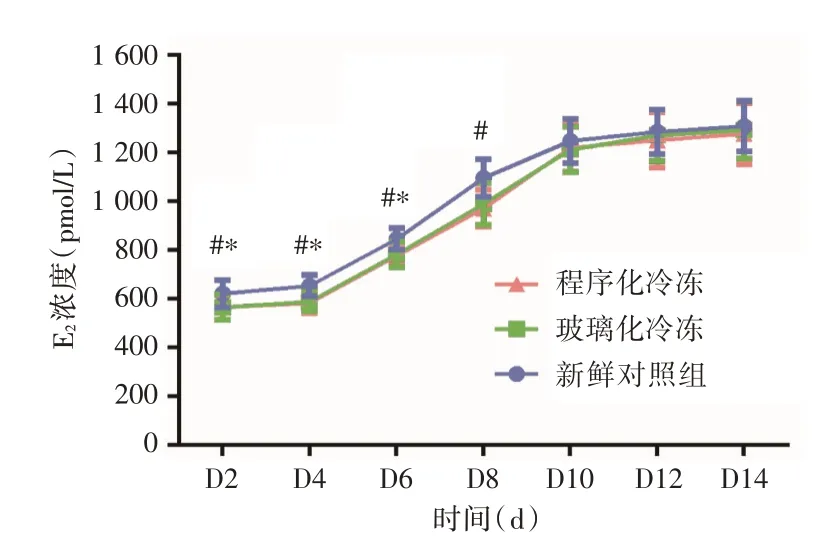
图3 体外培养各组卵巢皮质中E2浓度Fig.3 The concentration of E2 in the ovarian cortex of each group cultured in vitro
3 讨论
2004年,DONNEZ 等[5]首次报道人类卵巢组织冻融和移植取得成功;2014年,MACKLON 等[6]报道了患者进行冻融卵巢组织移植5年后获得了活产婴儿,为冻融卵巢组织移植术后的长期时效增加了证据支持。卵巢组织冷冻不仅保存了一定数量的卵泡,还可恢复女性的生殖内分泌功能,是激素敏感型肿瘤的最佳生育力保存方法。人卵巢组织冷冻和自体移植后活产率为25.4% ~ 30.6%,已被证实为生育力保存的有效方法[7]。美国生殖医学会指出对于希望保留生育能力的年轻癌症患者,卵巢组织冷冻和移植不再是试验性的方法[8]。
程序化冷冻和玻璃化冷冻均为保存卵巢组织常用的方法。程序化冷冻采用低浓度的冷冻保护剂,对细胞毒性小,是目前公认的是卵巢组织冷冻的标准方法,但需昂贵的程序化冷冻仪,步骤繁琐,耗时较长,易产生细胞内冰晶致细胞损伤。玻璃化冷冻无需任何设备,简便易行,使细胞内外的液体物质迅速通过冷冻敏感区,最大限度避免细胞内冰晶形成和降低细胞的损伤,亦被认为是保存卵巢组织有效的方法[9-10],但采用浓度相对较高的冷冻保护剂对卵巢组织的毒性尚不明确。LEE 等[11-12]认为程序化冷冻能更好地保存人卵巢组织中卵泡活性和细胞增殖能力,玻璃化冷冻技术对始基卵泡的形态上造成较严重的损伤;SILBER 等[13-14]认为相对于程序化冷冻而言,玻璃化冷冻技术可能更适合冷冻卵巢组织,尤其是卵巢基质细胞。TERRACIANO 等[15]等认为玻璃化方案可以更好地保存卵巢干细胞,实现卵泡的自我更新和再生,适用于卵巢早衰导致的不孕。SUGISHITA等[16]发现玻璃化冷冻和程序化冷冻法复苏的卵巢组织卵泡分布的密度、形态学差异及DNA 碎片率无显著差异;尽管卵巢组织冷冻已进行了大量的研究,但关于两种冷冻方法的优劣尚未定论。
本文从卵巢组织冷冻前后卵泡形态学改变、卵巢组织混悬液中卵泡密度和卵巢组织体外培养液中的E2变化方面进行研究,分析玻璃化冷冻法和程序化冷冻法的冷冻效果。本实验的结果显示两种方法冻存卵巢组织中始基卵泡的效果相似,始基卵泡的完整率差异无统计学意义;两冷冻组始基卵泡的完整率均明显低于新鲜对照组,说明冷冻过程对卵泡有一定的损伤;程序化冷冻组卵巢组织次级卵泡完整率与新鲜对照组相比有明显差异,且低于玻璃化冷冻组,说明程序化冷冻对次级卵泡的保存效果较差。KLOCKE 等[17-18]认为两种方法在保存卵泡活性上相当,但玻璃化冷冻对于卵巢基质保存效果更好;LABRUNE 等[19]认为玻璃化冷冻保存卵泡形态优于程序化冷冻组,这均与本文的结果一致。DALMAN 等[14]认为程序化冷冻比玻璃化冷冻对次级卵泡保存效果好,可能是因为程序化降温速度和玻璃化冷冻方案存在差异。
卵泡是女性最基本的生殖单位,卵巢组织冷冻过程中卵泡的完好是冷冻成功的关键。本实验中窦状卵泡数量太少,因此未进行统计。本研究两冷冻组卵巢组织混悬液的始基卵泡密度均明显低于新鲜对照组(P= 0.001),说明冷冻保存过程中卵泡有损伤;程序化冷冻组卵巢组织混悬液中初级和次级卵泡密度均明显低于新鲜对照组,玻璃化冷冻组和新鲜对照组相比无明显差异,说明玻璃化冷冻法对初级和次级卵泡的保存效果优于程序化冷冻法。DESAI 等[20]认为玻璃化冷冻组单个卵泡的损伤较小;SANFILIPPO 等[21]认为玻璃化冷冻组卵巢皮质中卵泡的密度0.6 个/mm2高于程序化冷冻组0.5 个/mm2;HERRAIZ 等[22]认为玻璃化冷冻后卵巢组织始基卵泡密度大于程序化冷冻组;虽然后两者分析卵巢组织切片中卵泡的密度,但对于单个卵泡的保存效果有一定的提示作用。
卵巢组织体外培养无需分离单个卵泡,卵泡的活性不会因酶解或机械分离而受损。另外,卵巢组织体外培养保持了卵母细胞及其与周边支持细胞间的结构[18]。卵巢皮质体外培养一方面反映出解冻后卵泡的生长能力,另一方面也反映出冷冻过程对各级卵泡的损伤程度。本研究通过测定卵巢组织体外培养的卵泡液E2的折线图看出,在体外培养过程中,卵巢组织能够继续生长,并具有一定的内分泌功能。培养的初始阶段(D2⁃D6),两冷冻组卵巢组织分泌的E2水平较低,相对于新鲜卵巢组织差异均有统计学意义,可能原因:其一,冷冻的卵巢皮质复苏后可能存在一个适应阶段,逐渐恢复其活性;其二,E2主要靠初级或次级卵泡分泌,在冷冻过程中,因初级卵泡和次级卵泡体积增大、卵泡液增多,冷冻损伤相对较大。随着培养时间的延长(D8⁃D14),始基卵泡或初级卵泡发育并逐渐成熟,两冷冻组卵巢皮质培养液中E2与新鲜培养组接近,差异无统计学意义(P>0.05),这说明玻璃化冷冻和程序化冷冻可较好的保存卵巢组织中卵泡的活性,特别是始基卵泡和初级卵泡;LOCATELLI 等[23]报道的体外培养的羊卵巢组织E2的分泌遵循相同的趋势,两种冷冻法卵巢组织的E2在培养的第6 天后显著增加,在培养的D9 与新鲜组织E2分泌量相近;OKTEM 等[24]研究结果显示,人新鲜卵巢组织、程序化冷冻组和玻璃化冷冻组卵巢组培养至D3,新鲜卵巢组织的E2水平明显高于两冷冻组。与本研究的结果相似。
此外,从经济效益学分析,程序化冷冻法需要昂贵的程序化冷冻仪和消耗大量的液氮,操作步骤繁琐,用时较长,消耗大量的人力和物力;玻璃化冷冻法无需大型冷冻设备,简便易行,冷冻过程相对较短(<30 min),其发展方向有可能像胚胎的玻璃化一样普遍。
由于标本收集的特殊性,本研究纳入的标本量相对较小,存在一定的局限性,结果可能不完全具有代表性,应扩大样本量进一步验证。且本文主要针对不同冷冻方法对卵泡活性的研究,对移植后卵巢皮质的基因表达和激素水平尚需在后续的研究中进一步评估。
综上所述,无论采取何种冷冻方案,卵巢组织均能很好的耐受冷冻损伤,保存大部分卵泡活性。相对于程序化冷冻,玻璃化冷冻卵巢组织起步相对较晚,但操作简便、高效,且对次级卵泡的保存效果较好,其临床应用将如同胚胎和卵子玻璃化冷冻一样普遍。另外,冷冻过程应考虑卵巢皮质的制备、冷冻保护剂的高渗透率和低毒性、操作人员的专业技能等因素,才能达到最佳的冷冻保存效果。人冻融卵巢组织的发育潜能尚需大量的异种移植实验进一步验证。

