CD4+T细胞计数及单核细胞人类白细胞抗原⁃DR表达率在预测老年脓毒症患者预后中的价值
伍松柏 何峻
长沙市第一医院重症医学科(长沙410005)
免疫功能紊乱是脓毒症主要的病理生理学特征之一,其不仅表现为高炎症反应状态所导致的多脏器功能损害,更发展为由失控的免疫激活所导致的严重免疫抑制,而严重的免疫抑制与院内感染发生率、病死率和长期并发症增加有关[1-3]。脓毒症与免疫衰老是相互影响的恶性循环,老年脓毒症患者更容易早期出现免疫麻痹,且早期免疫麻痹与院内病死率独立相关[4-5]。针对老年脓毒症患者进行动态免疫功能监测对疾病诊疗分层管理及预后判断尤为重要。CD4+T 细胞及单核细胞在机体的固有免疫和适应性免疫中均扮演重要角色,CD4+T 细胞计数是适应性免疫重要指标,而单核细胞人类白细胞抗原⁃DR(mHLA⁃DR)表达是天然免疫检测的首选指标,两者联合更能准确反映机体免疫功能[6-7]。脓毒症的早期死亡主要与炎症反应失控导致器官功能障碍有关,但高炎症反应期后的病死率则主要与持续的免疫抑制相关,改善脓毒症免疫抑制将有利于降低脓毒症的中、远期病死率。本研究重点探讨免疫功能指标在预测脓毒症早期治疗后死亡风险中的价值,为脓毒症患者免疫调理治疗提供循证依据及探寻新的靶标。
1 对象与方法
1.1 研究对象选择2018年10月至2020年1月我院重症医学科老年脓毒症患者,按照90 d 内全因死亡与否将老年脓毒症患者分为死亡组、存活组。死亡组33 例(男14 例,女19 例),年龄(76.24± 6.91)岁,存活组76 例(男36 例,女40 例),年龄(77.13±6.62)岁。
入选标准:(1)年龄≥65 岁;(2)符合“2016 拯救脓毒运动:脓毒症和脓毒性休克的管理国际指南”诊断标准[8];(3)本院住院时间>7 d。
排除标准:(1)HIV、血液系统疾病、晚期肿瘤患者、长期使用激素及免疫抑制剂患者;(2)存在需外科干预的感染灶未进行感染灶清除及充分引流;(3)本院住院时间<7 d;(4)患者存在研究者认为不合适参加研究的因素。
本研究符合医学伦理学要求,经医院伦理委员会批准,所有治疗及处理得到患者或家属知情同意并签署知情同意书。
1.2 研究方法
1.2.1 收集一般资料所有入选患者记录性别、年龄、是否合并休克、降钙素原(PCT),询问冠心病(coronary heart disease,CHD)、肾功能衰竭(renal failure,RF)、糖尿病(diabetes mellitus,DM)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等一般资料,入组时进行序贯脏器衰竭估计评分(SOFA 评分)及急性生理与慢性健康评分(APACHEⅡ评分),记录相关临床生化指标、辅助检查结果等。
1.2.2 一般治疗所有患者一般治疗均按照“2016拯救脓毒运动:脓毒症和脓毒性休克的管理国际指南”进行规范的早期目标导向性治疗及相应的系统性治疗,其他脏器功能支持、营养支持、稳定内环境及所存在的合并症等均依据相关指南共识进行治疗。所有的治疗过程由一名重症医学专业高级职称临床医师负责质控。
1.2.3 主要检测指标(1)治疗第1、7 天抽取所有入选患者清晨空腹外周静脉血5 mL,采用流式细胞仪检测CD3+T 细胞、CD4+T 细胞、CD8+T 细胞水平并计算CD4+/CD8+值;(2)荧光抗体标记外周血mHLA⁃DR,按照试剂说明书通过流式细胞仪检测mHLA⁃DR表达。所有实验室检测均在本院检验科实验室完成。
1.3 统计学方法数据分析采用SPSS 22.0 统计软件,服从或近似正态分布的计量资料以均数±标准差表示,比较采用成组t检验,计数资料以例(%)表示,比较采用χ2检验,采用多因素logistic 回归分析死亡的危险因素,并建立ROC 曲线分析免疫功能指标预测脓老年脓毒症患者90 d 病死率的准确性。P<0.05 为差异有统计学意义。
2 结果
2.1 两组间入组时一般临床资料比较见表1,两组在性别、年龄、基础病史(CHD、RF、DM、COPD)、休克、PCT 上比较差异无统计学意义(P>0.05),死亡组入科时SOFA 评分及APACHEⅡ评分显著高于存活组(P<0.05)。
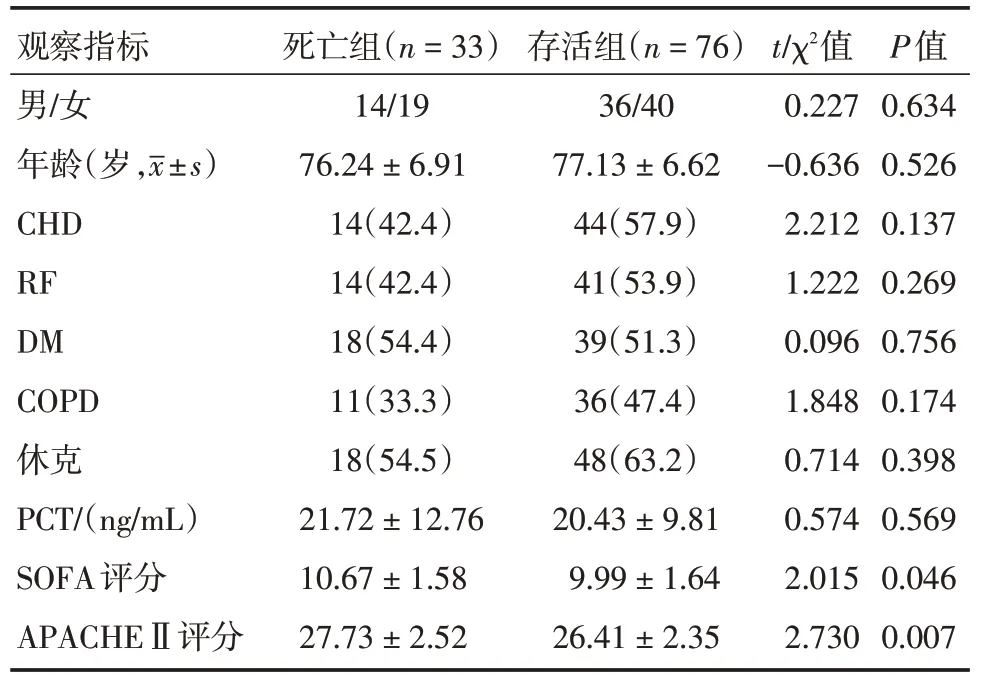
表1 两组间一般临床资料比较Tab.1 Comparison of general clinical data among the two groups 例(%)
2.2 两组间治疗前后免疫功能的比较见表2,与存活组比较,死亡组在治疗第1 天及第7 天CD3+T细胞计数、CD4+T 细胞计数、mHLA⁃DR 表达率显著降低,差异有统计学意义(P<0.05);治疗第1 天死亡组CD4+/CD8+T 细胞比值与存活组比较差异无统计学意义(P>0.05)。
表2 两组间免疫功能的比较Tab.2 Comparison of immunologic function among the two groups ±s
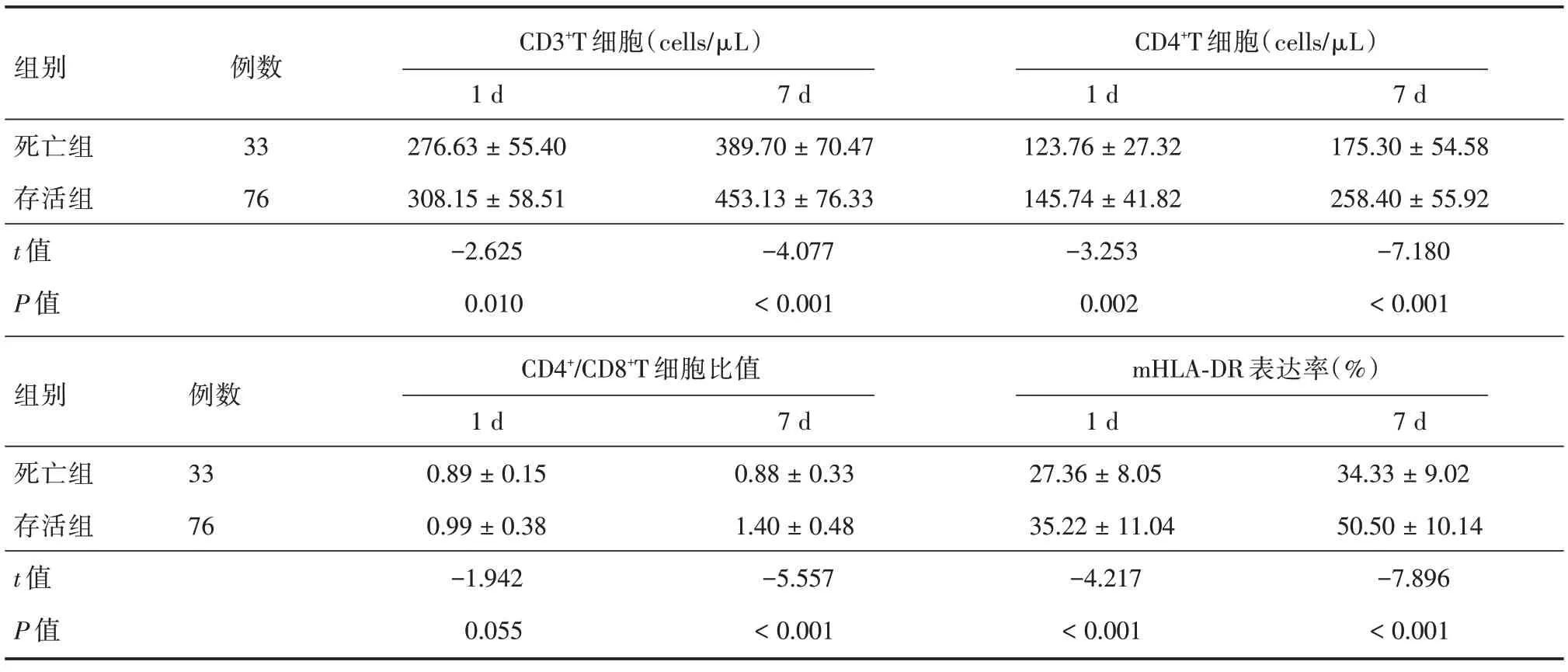
表2 两组间免疫功能的比较Tab.2 Comparison of immunologic function among the two groups ±s
组别死亡组存活组t 值P 值例数33 76 CD3+T 细胞(cells/μL)1 d 276.63±55.40 308.15±58.51-2.625 0.010 7 d 389.70±70.47 453.13±76.33-4.077<0.001 CD4+T 细胞(cells/μL)1 d 123.76±27.32 145.74±41.82-3.253 0.002 7 d 175.30±54.58 258.40±55.92-7.180<0.001组别死亡组存活组t 值P 值例数33 76 CD4+/CD8+T 细胞比值1 d 0.89±0.15 0.99±0.38-1.942 0.055 7 d 0.88±0.33 1.40±0.48-5.557<0.001 mHLA⁃DR 表达率(%)1 d 27.36±8.05 35.22±11.04-4.217<0.001 7 d 34.33±9.02 50.50±10.14-7.896<0.001
2.3 老年脓毒症患者90 d 病死率的影响因素logistic 回归分析以90 d 全因死亡与否(死亡=1,存活=0)为因变量,以CD3+T 细胞(7 d)、CD4+T 细胞(1 d)、CD4+T 细胞(7 d)、CD4+/CD8+T 细胞比值(7 d)、mHLA⁃DR(1 d)、mHLA⁃DR(7 d)、APACHEⅡ评分为协变量进行logistic 回归分析(设a入=0.05,a出=0.1),结果显示CD4+T 细胞(7 d)、mHLA⁃DR(1 d)及mHLA⁃DR(7 d)是老年脓毒症患者90 d 死亡的独立危险因素,见表3。
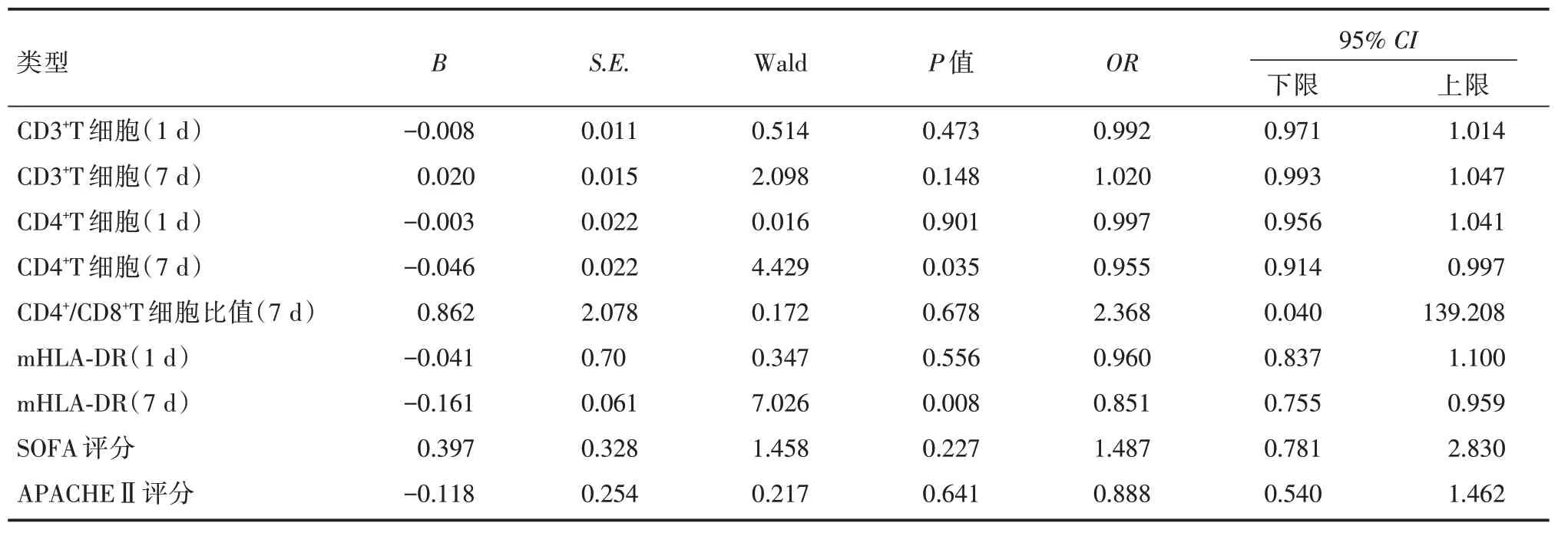
表3 老年脓毒症患者90 d 病死率的影响因素logistic 回归分析Tab.3 Logistic regression analysis on influencing factors of the 90 day mortality in elderly patients with sepsis
2.4 免疫功能指标预测老年脓毒症患者90 d 死亡的ROC 曲线分析CD4+T 细胞(7 d)及mHLA⁃DR(7 d)预测年脓毒症患者90 d 死亡的AUC 值均>0.8,两者的预测敏感性相似,mHLA⁃DR(7 d)特异性高于CD4+T 细胞(7 d),CD4+T 细胞(7 d)联合mHLA⁃DR(7 d)AUC 值可有所上升,敏感性下降,预测特异性更高,见表4、图1。
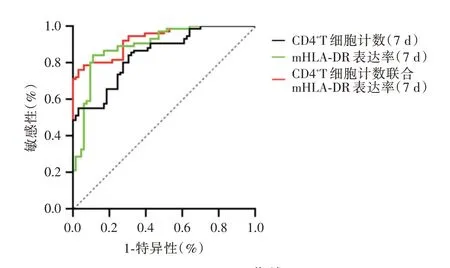
图1 ROC 曲线Fig.1 ROC curve

表4 预测老年脓毒症患者90 d 病死率的ROC 曲线分析Tab.4 Analysis of ROC curve for predicting the 90 day mortality in elderly patients with sepsis
3 讨论
有研究发现在老年患者中,对比非脓毒症患者,脓毒症患者CD3+T 细胞、CD4+T 细胞及CD8+T细胞显著减少(P<0.05)[9]。脓毒症诱导T 细胞特别是CD4+T 细胞减少如果不能恢复到足够的数量与不良预后显著相关,这一现象在中老年人群中体现的尤为明显[10-11]。本研究发现,对比存活组,死亡组脓毒症初始及治疗7 d 后CD3+T 细胞、CD4+T 细胞计数均显著减少,CD4+/CD8+T 细胞比值的失调并倾向于免疫抑制表现,此与YU 等[12]研究结果一致。脓毒症诱导的淋巴细胞的减少一方面与淋巴细胞的凋亡有关,另一方面与胸腺输出减少及CD4+T 细胞衰老增加有关,因此CD4+T 细胞的减少更为明显[13]。CD4+T 细胞是细胞免疫反应重要的组成部分,在B 细胞和CD8+T 细胞的发育和激活中起着不可或缺的作用,同时CD4+T 细胞还具有细胞毒性能力,在病原体清除发挥更直接的作用,持续的CD4+T 细胞减少提示机体处于免疫抑制状态[14]。本研究发现,虽然老年脓毒症患者初始及治疗7 d 后CD4+T 细胞计数均存在不同程度的减少,随着治疗多数患者CD4+T 细胞计数有不同程度的上升,只有治疗7 d 后CD4+T 细胞计数是老年脓毒症患者90 d 死亡的独立危险因素,这与CD4+T细胞在机体适应性免疫反应中具有更为重要的作用相关。MÉNDEZ 等[15]研究发现第4 天的CD4+T细胞计数<129 cells/μL 可以独立预测社区获得性肺炎30 d 病死率。本研究预测老年脓毒症90 d病死率的治疗7 d 后CD4+T 细胞计数临界值为197 cells/μL,高于MÉNDEZ等[15]的研究结果。本研究选择老年人为研究对象,年龄普遍偏大,病情严重程度普遍偏高,且检测时间点迟于MÉNDEZ等[15]研究,这可能是导致两者之间研究结果差异的主要原因。相比既往研究,本研究检测治疗7 d 后CD4+T 细胞计数作为预测指标更具有临床治疗指导价值,其最佳临界值可以作为脓毒症早期干预的靶标。
mHLA⁃DR 作为先天免疫应答的标志,是目前广泛认可的免疫功能监测指标,在多项干预性临床试验中都作为天然免疫的重要指标使用,并观察到脓毒症患者中mHLA⁃DR 表达水平往往较健康对照者明显下降,动态观察mHLA⁃DR 水平可以更好地评估脓毒症患者免疫状态和预测预后[16]。本研究结果同样发现,mHLA⁃DR 表达水平在老年脓毒症患者中显著下降,死亡组mHLA⁃DR表达水平显著低于存活组,此与既往多数研究相似。MAH⁃MOODPOOR 等[17]研究发现mHLA⁃DR 表达水平是脓毒症死亡的独立危险因素。本研究重点发现了脓毒症发病初始的mHLA⁃DR 表达水平并不能作为死亡的独立危险因素,而治疗后第7 天mHLA⁃DR 表达水平可以有效预测90 d 死亡结局,此与近期LEKKA 等[18]的一项研究结果相似。脓毒症免疫功能紊乱总体上分三个阶段,早期为高炎症反应阶段,中后期可能出现混合性免疫状态及免疫抑制状态,脓毒症早期免疫功能损伤可随病情的好转及治疗干预有所改善,但持续的免疫抑制状态将与中、远期死亡风险显著相关[19]。本研究通过进一步通过ROC 曲线分析确定mHLA⁃DR 表达率是预测90 d 死亡风险的有效指标,其最佳阈值为40.5%。LEKKOU 等一项研究观察到脓毒症死亡患者第10 天后mHLA⁃DR 表达率已无明显上升且mHLA⁃DR 表达率均<40%,mHLA⁃DR 表达率可以作为预测脓毒症预后的早期标志物。ZHUANG 等[20]研究也发现入院后24 h内的mHLA⁃DR 表达率可以独立预测严重社区获得性肺炎的28 d 病死率,其最佳阈值为27.2%。本研究在24 h内的mHLA⁃DR 表达率与ZHUANG 等的研究结果相似,但本研究发现入院24 h 内的mHLA⁃DR 表达率并不能独立预测脓毒症的90 d 病死率,而治疗7 d 后的mHLA⁃DR 表达率具有独立预测价值,一方面可能与本研究排除了治疗7 d 内的早期死亡病例有关,另一方面也说明了将提高mHLA⁃DR 表达率作为治疗靶点可能有利于改善脓毒症中期预后。
本研究发现mHLA⁃DR 表达率与CD4+T 细胞计数在预测老年脓毒症患者90 d 病死率上敏感性相似,但mHLA⁃DR 表达率的特异性高。mHLA⁃DR表达率是先天免疫系统重要的免疫标记物之一,mHLA⁃DR 的低表达能够准确反应先天免疫系统缺陷,而CD4+T 细胞计数反应适应性免疫系统,可以随着感染的控制在短期内增加,且适应性免疫系统缺陷不仅表现为CD4+T 细胞计数减少,还表现为CD4+T 细胞功能的下降,这在一定程度上可以说明mHLA⁃DR 表达率的预测特异性高的原因[21]。本研究分析了mHLA⁃DR 表达率联合CD4+T细胞计数的预测价值,发现较单一指标AUC 值明显提高,虽然敏感性有所下降,但特异性较单一指标明显提高,有效降低了误诊率。
综上所述,老年脓毒症患者治疗第7 天时CD4+T 细胞计数及mHLA⁃DR 表达率是90 d 死亡的独立危险因素,两者均为90 d 死亡的有效预测指标,CD4+T 细胞计数及单核细胞人类白细胞抗原⁃DR 表达率可以作为改善脓毒症预后的早期干预靶标。本研究存在一些局限性:(1)本研究重点探讨脓毒症早期治疗后的病死率,排除了入院后7 d 内的早期死亡病例,对90 d 总体病死率有一定的影响;(2)样本量相对偏小,需要进一步多中心、大样本的研究验证本研究的结果;(3)仅检测了治疗第1 天及第7 天的免疫功能指标,缺乏住院期间及出院后连续、动态的监测;(4)缺乏对脓毒症炎症反应细胞因子的连续动态监测,未能明确脓毒症炎症反应与免疫功能之间相互影响的关系。针对上述研究局限及不足之处有待进一步的研究阐明。

