石柱参SzPLC1基因的生物信息学分析及胁迫应答
王丹丹,齐彤彤
(辽东学院 农学院,辽宁 丹东 118003)
石柱参,又名柱参,隶属于五加科(Araliaceae)人参属(Panax)。人参(PanaxginsengC. A. Mey.)是我国东北地区名贵药材及补品,在辽宁省丹东市宽甸县多有分布。石柱参种植地毗邻鸭绿江,栽培方式不同于普通园参,且生长速度缓慢(长成成品需长达12~15 年时间)。在优越环境下生长的石柱参形态特征与野生人参相似,人参总皂甙含量高于普通园参,在国际中药市场享有盛誉。
磷脂(Phospholipid)是细胞膜的主要成分,其含量与组成存在个体差异,在细胞生长和应激反应中发生动态变化。磷脂酶可催化细胞膜中磷脂重构,其间产生多种脂源性第二信使。磷脂酶根据磷酸酯键水解位点,分类为4个基团,即磷脂酶A1 (PLA1)、磷脂酶A2 (PLA2)、磷脂酶C (PLC)和磷脂酶D (PLD)[1]。它们存在于不同的亚科或科,在底物选择性、结构、辅助因子要求和反应条件方面均有不同。
磷脂酶C基因家族是磷脂酶家族的重要成员,它能调控植物生长发育过程。根据底物不同,磷脂酶C可分为非特异性磷脂酶C (NPC)和磷脂酰肌肽特异性磷脂酶C (PI-PLC)。PI-PLC可以水解磷脂酰肌醇4, 5-bisphosphate (PIP2)而产生两个重要的信号分子:三磷酸肌醇(IP3)和甘油二酯(DAG)。蛋白激酶C (PKC)的家族成员可依靠上述信号分子释放细胞中的Ca2+,从而被激活并参与植物的生长发育过程。NPC可以水解磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)生成磷脂酰丝氨酸(PS)、DAG和相应的磷酸基团[2-3]。随着基因组测序技术的发展,越来越多的PLC基因被鉴定出来:拟南芥含有9个PI-PLC和6个NPC,番茄含有6个PI-PLC成员,棉花含有12个PI-PLC和9个NPC,玉米含有5个PI-PLC和4个NPC,水稻中有4个PI-PLC和5个NPC成员。在高等植物中,拟南芥和水稻中PLC家族基因的生物学功能分析较为明确:AtPI-PLC1参与高渗胁迫响应;AtPI-PLC2参与雌雄配子体发育的生长素调控;AtPI-PLC3参与干旱和盐胁迫的早期反应,属于转录因子AP2/ERF家族,是乙烯反应因子的下游靶基因;AtNPC1、AtPI-PLC3和AtPI-PLC9参与拟南芥的热胁迫响应;AtPI-PLC5过表达可引起拟南芥叶片早衰或烟草叶片点状枯萎;脱落酸可诱导AtPI-PLC6参与冷应激反应;生长素和细胞分裂素可将植物AtPI-PLC7和AtPI-PLC8表达上调,并在盐胁迫、干旱和冷害下亦能上调;AtNPC4及其衍生脂质可增强对高渗透胁迫的抵抗力、调节ABA反应机制,促进植物对干旱和盐胁迫的耐受性;AtNPC5和甘油三酯在轻度盐胁迫下促进植物侧根发育,OsNPC2对盐和低温处理敏感,特别是盐处理下OsNPC2的表达增加了近8倍;多种胁迫同时诱导OsPI-PLC3的表达,特别是盐处理下的表达增加了22倍。综上所述,植物PLC基因在应激反应中发挥着重要作用[4-8]。
目前,对石柱参的研究主要集中于栽培技术和功能基因的克隆上,对其PLC家族成员的克隆及表达研究还未见报道。因此,鉴定SzPLC家族成员并探讨其功能具有重要的意义。本研究参考拟南芥(NM_125254.2)的AtPLC1基因设计引物,采用RT-PCR与RACE技术克隆石柱参PLC1全长基因,命名为SzPLC1基因。通过蛋白序列比对、结构域分析、蛋白网络互作以及进化树构建,为深入研究SzPLC1蛋白的特性及功能,并为最终解释石柱参SzPLC1参与抗逆胁迫的分子机制以及基因工程手段在石柱参分子育种中的应用打下了良好的基础。
1 材料与方法
1.1 试验材料
5年生无病虫害、生长势良好的石柱参根组织,2020年7月采自丹东市宽甸满族自治县振江镇大青村。
1.2 总RNA提取
取新鲜石柱参根组织0.5 g置于液氮中研磨至粉末状,依据植物总 RNA 快速抽提试剂盒(Plant Total RNA Isolation Kit)说明书抽提石柱参总RNA,电泳检测RNA完整性。以石柱参总RNA为模板,采用AMV 第一链 cDNA 合成试剂盒(AMV First Strand cDNA Synthesis Kit)生成cDNA第一链,-20 ℃保存[9]。
1.3 石柱参SzPLC1全长基因的克隆
以拟南芥(NP_568881.1)的AtPLC1基因设计引物(见表1),克隆石柱参SzPLC1的核心片段,并根据核心片段设计5′-RACE和3′-RACE引物。采用生工生物工程(上海)股份有限公司的5′-RACE和3′-RACE试剂盒,以SzPLC1核心片段为模板快速扩增SzPLC1基因的5′-RACE片段和3′-RACE片段。PCR 扩增体系(50 μL):5′和3′-RACE cDNA 2.5 μL,LA缓冲液 (10×) 25 μL,LA聚合酶混合液1.0 μL,PCR-Grade H2O 15.5 μL,UPM(10×)5 μL,5′,3′GSP 引物1.0 μL。反应程序:95 ℃预变性5 min;95 ℃变性45 s,69 ℃退火45 s,72 ℃延伸3 min,40次循环;72 ℃延伸10 min。采用凝胶回收试剂盒纯化、回收PCR特异性扩增产物,连接pUC19载体后转化入感受态细胞,生工生物工程(上海)股份有限公司测序。 采用DNAstar软件拼接5′ -RACE、核心序列与3′-RACE 3个片段,最终获得石柱参SzPLC1全长基因[10-12]。

表1 引物信息
1.4 石柱参SzPLC1基因生物信息学分析
根据SzPLC1基因全长序列,采用ORF Finder预测SzPLC1基因开放阅读框,采用在线分析软件Prot Param分析理化特性,采用Prot Scale分析氨基酸序列的疏水性和亲水性,采用SWISS MODEL在线软件预测蛋白质三级结构,采用String(http://string-db. org/)预测其蛋白互作网络;采用DNAMAN软件与Blast在线软件对其同源氨基酸进行多重比对,用Clustalx和MEGA 7.0 软件构建石柱参SzPLC1基因系统进化树[13]。
1.5 干旱胁迫对石柱参SzPLC1基因的胁迫表达
对土壤进行3个含水量设置:充分灌溉处理(对照组),土壤相对含水量保持在(90±5) %;轻度干旱胁迫处理,土壤相对含水量保持在(65±5) %;重度干旱胁迫处理,土壤相对含水量保持在(35±5)%。每个处理5盆,在干旱处理的第0、6、12、20 d及复水后6 d取样并保存到冰箱。采用Primer Premier 6软件设计SzPLC1基因特异性引物PLC1-qF/R,以18S-F/R为内参引物,通过qRT-PCR对SzPLC1基因进行实时荧光定量(qRT-PCR)分析,检测干旱条件下SzPLC1基因表达量水平,3次生物学重复后取平均值[14]。
2 结果与分析
2.1 石柱参SzPLC1基因cDNA全长克隆
以拟南芥(NP_568881.1)序列为模板设计引物,采用RT-PCR与RACE技术克隆SzPLC1基因全长cDNA序列(图1),采用SeqMan程序将5’-RACE(521 bp)、核心序列(1 068 bp)与3’-RACE(387 bp)3段DNA序列进行拼接,获得1条长度为1 725 bp的DNA片段,以该序列为模板,采用Primer Premier 5.0设计SzPLC1基因特异性引物,以石柱参cDNA为模板克隆SzPLC1全长序列。结果显示,克隆得到的SzPLC1序列与拼接的序列长度一致,可确定为SzPLC1基因(见图1)。

2.2 石柱参SzPLC1基因理化特性分析
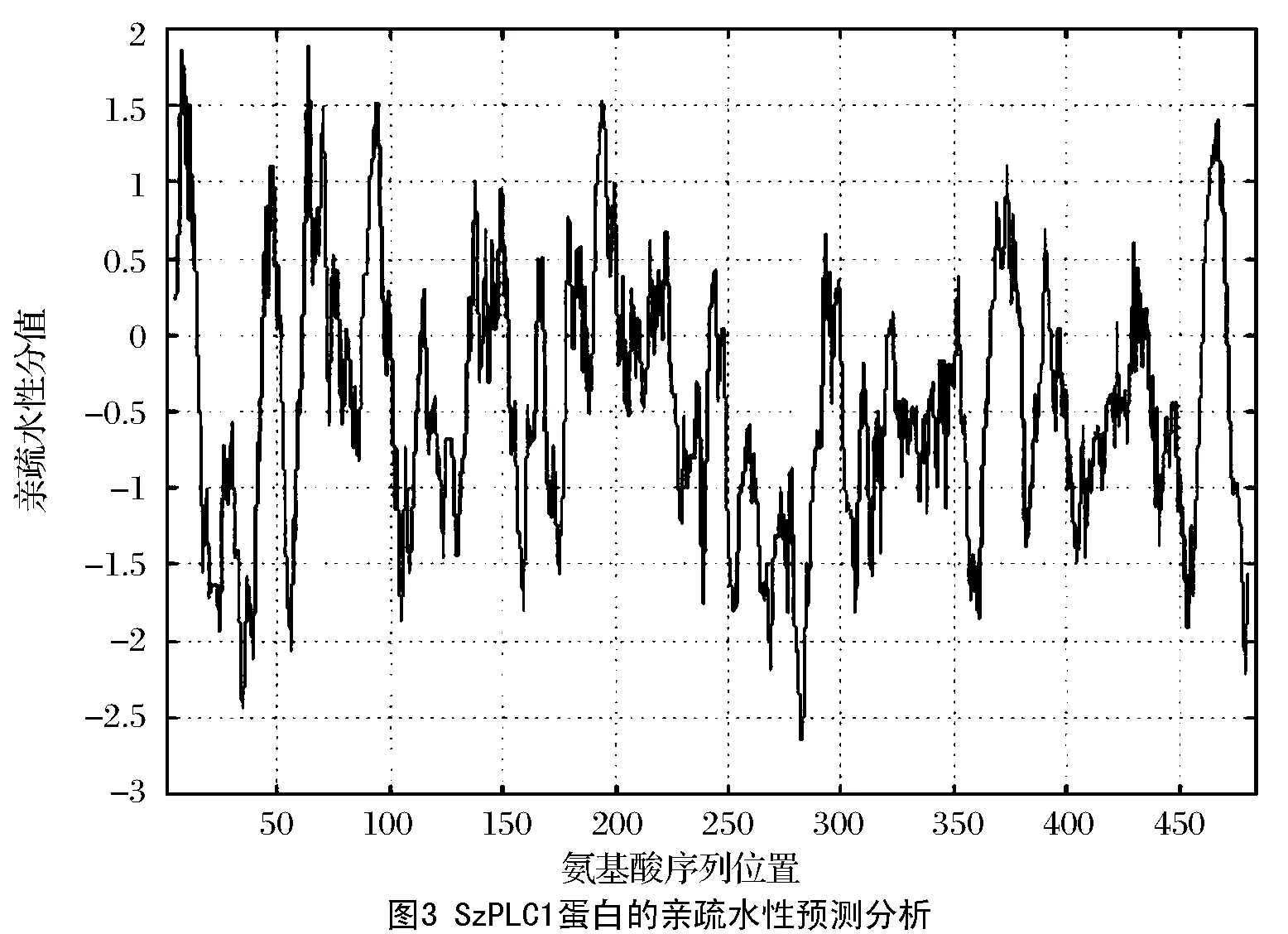
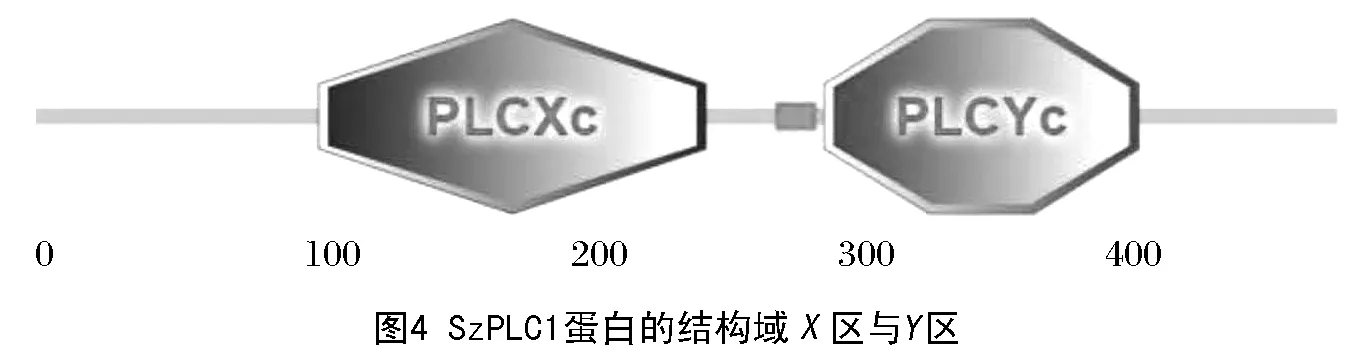
石柱参SzPLC1基因cDNA全长为1 725 bp(见图2),包含1个1 455 bp的完整开放阅读框(ORF),编码484个氨基酸,其5’-UTR长252 bp, 3’-UTR长18 bp。Prot Param 分析表明:SzPLC1蛋白质分子式为C2444H3803N655O738S21,含8147个原子,分子质量为54.8 ku,等电点pI为5.85,含有63个带负电荷氨基酸残基、55个带正电荷氨基酸残基;苏氨酸(Ser)含量最高(7.9%),半胱氨酸(Cys)含量最低(1.8%),脂肪系数为76.10。Prot Scale分析表明:SzPLC1蛋白亲水性氨基酸数量显著多于疏水性氨基酸数量,292、283位氨基酸残基的亲水性最强(MIN:-2.644),64位的疏水性最强(MAX:1.889),推断SzPLC1蛋白为亲水性蛋白(图3);SignalP-4.1预测SzPLC1蛋白无信号肽,无剪切位点,说明该蛋白翻译后无需跨膜转运;PSORT Prediction预测蛋白质的亚细胞定位表明该蛋白质可能存在于细胞质膜。Smart在线分析显示:GaSQS蛋白具有2个结构域(见图4),即X区(105~249,1.04×10-53)和Y区(293~410,1.55×10-61),约含有150和130个氨基酸残基;SOPMA预测SzPLC蛋白二级结构(见图5),包括无规则卷曲(40.91%)、α-螺旋(37.54%)、延伸链(18.39%)和β-转角(4.96%);SWISS-MODEL预测SzPLC蛋白三级结构(见图6),表明SzPLC蛋白具有由多个无规则卷曲和α-螺旋形成的中央激活位点空穴区域,符合磷脂酶的理化特性,有利于形成底物结合域和催化位点,该区域可与Ca2+结合,而Ca2+又能与底物二磷酸结合,因此推测该核心部位可能是酶的活性中心。



2.3 石柱参SzPLC1蛋白互作网络分析
String蛋白互作网络分析表明,与SzPLC1蛋白互作的蛋白质共有9个(见图7),即: G蛋白α亚基、G蛋白β亚基、G蛋白γ亚基1、G蛋白γ亚基2、 G 蛋白偶联受体、钙依赖性磷脂结合蛋白家族、SPA7蛋白、TATC膜蛋白和阿拉伯半乳糖蛋白。这些蛋白均是磷脂酰肌醇信号通路的重要酶类,说明SzPLC1是磷脂酰肌醇信号通路中关键的酶,其分子功能涉及催化活性和结合。生物过程主要涉及代谢过程、细胞过程、对刺激的反应、生物调节、生物过程调节和信号转导等。

2.4 石柱参SzPLC1蛋白的系统进化分析
经Blast比对,SzPLC1蛋白与较多十字花科植物均具有较高同源性(80%~98%)。从NCBI 数据库选取10个与SzPLC1蛋白高度同源的氨基酸序列,用MEGA7.0构建PLC1蛋白系统进化树(见图8)。结果表明:10个PLC1氨基酸序列汇聚为两大支,其中十字花科聚为一支,另一支均为豆科的PLC1氨基酸序列。石柱参SzPLC1蛋白与萝卜Raphanussativus(XP_018480211.1) 的PLC1蛋白表现出较高的同源性(95%),亲缘关系最为相近,说明该蛋白高度保守。

2.5 石柱参SzPLC1干旱胁迫表达
在干旱处理的第0、6、12、20 d及复水后6 d,分别对3种处理后的各时期石柱参SzPLC1蛋白的表达量进行测定,结果表明:充分灌溉处理(对照组)的SzPLC1蛋白表达水平相对较稳定;轻度干旱胁迫处理与重度干旱胁迫处理的石柱参植株SzPLC1蛋白表达水平随着干旱处理时间的延长而升高,直至20 d时达到峰值,复水后6 d表达量有明显下降趋势,其中,重度干旱胁迫处理的SzPLC1蛋白表达量高于其他两个处理,在干旱处理20 d时,SzPLC1蛋白的表达量约为对照组的5.4倍。说明SzPLC1蛋白的功能具有抗干旱胁迫的作用。

3 讨论
磷脂是细胞膜重要的组成成分,其水解产物是DAG和IP3,也是细胞跨膜信号转导中重要的2个第二信使,催化上述反应的水解酶便是磷脂酶类, IP3可激活PI-PLC水解PIP2,再次生成第二信使DAG和IP3,对植物细胞增殖、分化、代谢以及分泌等过程发挥作用,所以,磷脂酶C是一种重要的脂质水解酶,参与脂质介导的信号转导,在许多植物非生物胁迫信号转导和发育中发挥重要作用。根据基质的不同,PLC在植物中可分为PI-PLC和NPC。PI-PLC的结构主要由pH结构域(涉及膜靶向和蛋白结合)、EF-hand结构域(并非所有PI-PLC基因都含有EF-hand结构域)、催化结构域(X和Y结构域)和C2结构域组成,与动物的PLC相比,植物中的PLC缺少pH结构域。研究表明PI-PLC的催化活性严格依赖于X/Y结构域(涉及底物结合和催化)[15]。X结构域非常保守,存在于细菌、动物和植物中。X结构域中单个氨基酸的变化可以显著影响PI-PLC的功能。
非生物胁迫包括干旱胁迫、低温胁迫和盐胁迫,是植物在其生长发育过程中常见的胁迫,可导致植物减产。在各种非生物胁迫下,PLC基因被转录激活说明该信号转导酶在植物适应恶劣环境条件时的重要性。干旱胁迫诱导烟草NtPLC1、马铃薯StPLC1和StPLC2表达,此外,棉花GhNPC5和GhNPC9以及拟南芥的同源基因AtNPC1在高温胁迫下被强烈诱导,说明PLC基因在不同植物中具有相似的生理学功能,可通过系统进化预测不同物种PLC蛋白质功能。例如,OsPLC1和TaPLC1对盐胁迫比较敏感,胁迫后PLC蛋白质表达量明显上调,此外,提高玉米的耐旱性可通过过表达ZmPLC1蛋白[16-17]来实现。本研究发现石柱参SzPLC1对干旱胁迫表现出了良好的抗逆性,SzPLC1蛋白表达量随着干旱胁迫时间的延长而呈上升趋势,其中轻度干旱胁迫处理的SzPLC1蛋白的表达量明显低于重度干旱胁迫处理,说明SzPLC1参与了多种细胞代谢过程和信号转导途径,具有抗干旱胁迫的作用。

