瑞芬太尼通过抑制氧化应激减轻大鼠肝脏缺血再灌注损伤
李丽珍, 钟炜昕, 詹根明, 林 芩
肝脏缺血再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)可影响肝脏手术后的肝功能和肝组织再生,引起术后肝功能异常、原发性移植肝无功能,甚至多器官功能衰竭,增加患者肝功能衰竭的发生率和死亡率[1-2]。目前认为,大量氧自由基生成是发生HIRI的主要机制之一。肝脏缺血再灌注后,可大量产生氧自由基,引发肝脏氧化应激反应,不仅可通过氧化细胞的膜性结构产生脂质过氧化反应损伤细胞,还可通过氧化核酸酶破坏DNA双链结构导致细胞死亡,从而造成HIRI;瑞芬太尼后处理可减轻心肌、脑等组织器官的缺血再灌注损伤[3-7]。然而,目前国内外关于瑞芬太尼后处理是否对HIRI有保护作用的报道较少,其具体保护机制也尚未阐明。热休克蛋白70(heat shock protein 70,HSP70)的生理作用广泛,可在应激条件下(如高温、缺血、缺氧等)诱导合成,通过减轻机体或组织的氧化应激反应,产生细胞保护作用[8-9]。动物实验研究发现,HSP70可直接或间接保护肝脏切除术后大鼠的肝功能和肝组织再生,提高大鼠的存活率[10-11]。本研究拟探讨瑞芬太尼后处理是否可增强HSP70的表达和减轻大鼠HIRI,并通过设立HSP70抑制剂槲皮素对照组,进一步求证HSP70在瑞芬太尼后处理减轻大鼠HIRI中的作用,从而阐明瑞芬太尼后处理减轻HIRI的机制。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级成年健康雄性SD大鼠24只[许可证号:SCXK(沪)2017-0005,上海斯莱克实验动物有限责任公司],体质量300 g,鼠饲料喂饲,术前禁食12 h,自由饮水。
1.1.2 试剂和仪器 注射用瑞芬太尼(批号:国药准字H20030197,宜昌人福药业有限责任公司);槲皮素(批号:R006828,上海易恩化学技术有限公司);丙氨酸转氨酶(alanine transaminase,ALT)测定试剂盒(批号:S03030)和天冬氨酸转氨酶(aspartate transaminase,AST)测定试剂盒(批号:S03040)(深圳雷杜生命科学股份有限公司);总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号:A001-1)和丙二醛(malondialdehyde,MDA)测定试剂盒(批号:A003-1)(南京建成生物工程研究所);β-actin鼠单抗(GB12001,武汉赛维尔生物科技有限公司);HSP70兔单抗(AF1156,上海碧云天生物技术有限公司)。酶标检测仪(Epoch,美国BioTeK公司);光学显微镜(Nikon Eclipse E100,日本尼康公司);灰度分析软件(AlphaEaseFC,美国Alpha Innotech公司)。
1.2 方法
1.2.1 建立大鼠HIRI模型 根据本研究团队前期建立大鼠70% HIRI模型的方法[12-13],在支配大鼠肝左中叶的肝动脉、门静脉和胆管分支下方穿一条4-0线,可逆性结扎阻断肝脏左中叶血流45 min,松开可逆性结扎线再灌注3 h。
1.2.2 分组 根据随机数字表法将大鼠分为4组(n=6):假手术组(S组)、HIRI组(I/R组)、瑞芬太尼组(R组)和槲皮素组(Q组)。S组:在大鼠肝左中叶的肝动脉、门静脉和胆管分支下方只穿一条4-0线而不进行可逆性结扎,余操作同大鼠HIRI模型建立方法;I/R组:按照大鼠HIRI模型建立方法,行缺血45 min再灌注3 h;R组:于再灌注开始10 min内静脉推注瑞芬太尼4 μg/kg,余操作同I/R组;Q组:于再灌注开始10 min内先给予槲皮素7 mg/kg,再给予瑞芬太尼4 μg/kg,余操作同R组。
1.2.3 检测血清ALT和AST活性 再灌注3 h后,大鼠开腹取腹主动脉血3~4 mL,促凝离心留取上清液待测。采用全自动生化仪按照试剂盒说明书测定血清ALT和AST活性。
1.2.4 观察肝组织病理形态学并测定SOD活性、MDA和HSP70含量 切取左中叶的肝组织,一部分切片行H-E染色,光镜下观察肝组织的病理形态学变化;一部分制备肝组织匀浆,按照试剂盒说明书检测肝组织的SOD活性和MDA含量;一部分采用Western-blot法,以β-actin鼠单抗和HSP70兔单抗检测HSP70蛋白表达,经组织总蛋白提取、BCA法测定总蛋白浓度、蛋白变性、电泳、转膜、免疫反应、化学发光,获得凝胶图像。采用Alpha Ease FC软件处理系统分析条带的灰度值,计算各样本的条带灰度值与β-actin条带灰度值的比值(表示各样本肝组织的HSP70含量)。
2 结 果
2.1 大鼠血清ALT和AST活性 I/R组、R组和Q组血清ALT和AST活性均显著高于S组(P<0.05);R组显著低于I/R组(P<0.05);Q组和I/R组差别无统计学意义(P>0.05,表1)。

表1 大鼠血清ALT和AST活性
2.2 肝组织病理形态学变化 肝组织经H-E染色后,光镜下可见,S组肝小叶为正常结构,中央静脉居中,肝细胞形态饱满,肝细胞索呈放射状整齐排列;I/R组和Q组肝小叶失去正常结构,中央静脉扩张,血管腔内淤积较多红细胞,肝细胞索排列紊乱,失去放射状,部分肝细胞出现空泡;R组仍可见中央静脉腔内有红细胞淤积,但肝小叶尚保持较正常结构,肝细胞索尚可见放射状排列,肝细胞较少出现空泡(图1)。

A、B:假手术组,肝小叶为正常结构,肝细胞形态饱满,肝索放射排列;C、D、G、H:C、D为HIRI组,G、H为槲皮素组,肝小叶失去正常结构,中央静脉腔扩张并有较多红细胞淤积,部分肝细胞出现空泡;E、F:瑞芬太尼组,肝小叶尚保持较正常结构,中央静脉腔内红细胞淤积和肝细胞内空泡较少。图1 光镜下大鼠肝组织H-E染色病理形态学变化Fig.1 Pathomorphological changes of H-E staining of rat liver under light microscope
2.3 肝组织SOD活性及MDA和HSP70含量 I/R组和Q组肝组织SOD活性显著低于S组,而R组显著高于S组(P<0.05)。I/R组、R组和Q组肝组织MDA和HSP70含量均显著高于S组(P<0.05)。R组肝组织SOD活性和HSP70含量显著高于I/R组,而MDA含量显著低于I/R组(P<0.05)。Q组与I/R组肝组织SOD活性及MDA和HSP70含量差别均无统计学意义(P>0.05,表2,图2)。
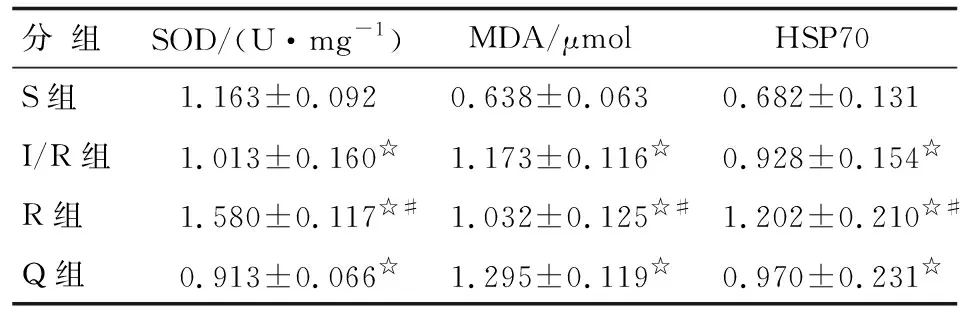
表2 大鼠肝组织SOD活性及MDA、HSP70含量
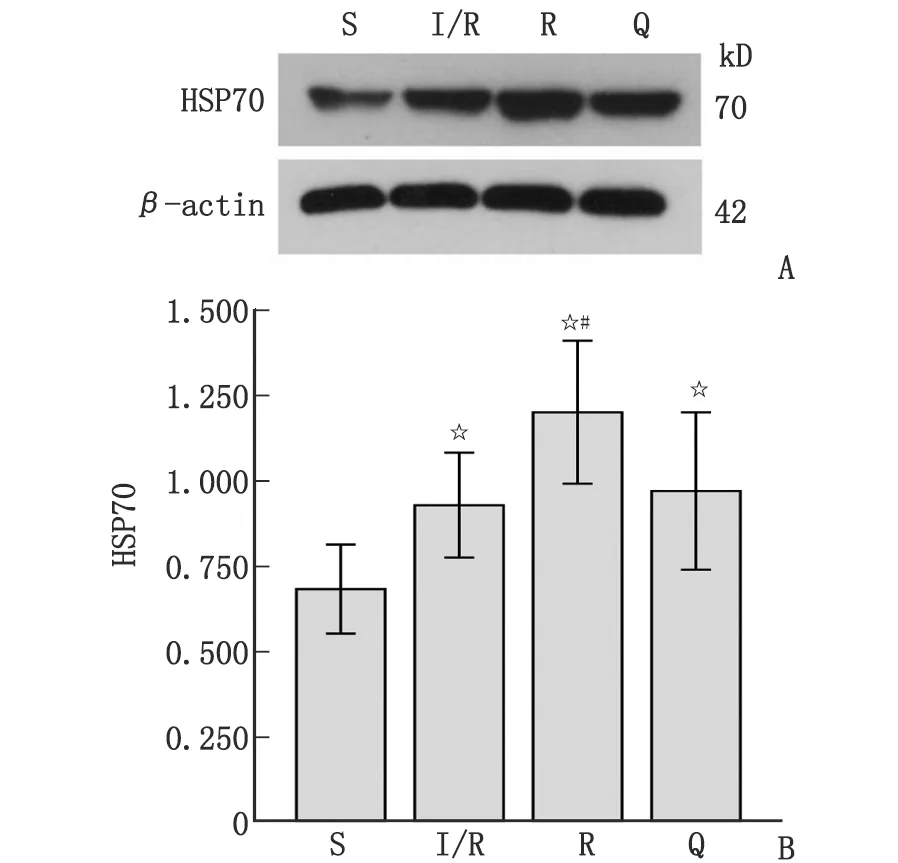
HSP70:热休克蛋白70。A:Western-blot法检测;B:灰度比值分析。S:假手术组;I/R:HIRI组;R:瑞芬太尼组;Q:槲皮素组。与S组比较,☆:P<0.05;与I/R组比较,#:P<0.05。图2 Western-blot法检测大鼠肝组织HSP70表达Fig.2 The protein expression of HSP70 in rat liver detected by Western-blot
3 讨 论
血清ALT和AST活性可敏感地反映急性肝损伤。本研究显示,I/R组血清ALT和AST活性明显高于S组,提示大鼠发生了急性肝损伤。光镜下,I/R组肝小叶失去正常结构,中央静脉扩张,血管腔内有较多红细胞淤积,肝细胞索排列紊乱,失去放射状排列,部分肝细胞出现空泡,说明大鼠HIRI模型建立成功。
HIRI机制复杂,其中氧自由基损伤是其重要的机制之一。HIRI时,肝组织中产生大量氧自由基,攻击生物膜,增强膜脂质过氧化,生成大量脂质过氧化产物MDA,从而造成细胞损伤。而生物体内重要的抗氧化酶SOD,被称为天然的氧自由基清除剂,可清除氧自由基,减轻细胞的脂质过氧化损伤。因此,MDA和SOD的高低常被用来反映机体或组织的氧化应激水平。本研究结果显示,I/R组肝组织MDA含量比S组升高,而SOD活性比S组降低,表明HIRI时,肝组织的膜脂质过氧化反应增强,从而使MDA含量升高,而SOD则因清除肝组织内氧自由基而消耗导致其活性降低。
药物后处理是指通过药物干预减轻长时间缺血后的器官或组织的缺血再灌注损伤,一般于再灌注前或再灌注开始的几分钟内进行干预。瑞芬太尼是目前临床上常用的超短效、强效的阿片类麻醉镇痛药,起效快,代谢快,长时间使用不易产生药物蓄积,且代谢不受肝肾功能影响。肝脏手术通常时间较长,且患者常合并肝功能不全,因此在肝脏手术麻醉中应用瑞芬太尼具有一定优势。王建珍等[14]对HIRI大鼠在再灌注开始时给予瑞芬太尼后处理,发现大鼠血清中的AST、ALT活性和白细胞介素-8浓度均降低,肝细胞的c-fos和c-jun表达均下调,肝组织病理学损伤减轻。本研究结果与上述文献一致。本研究中,R组于再灌注开始的10 min内给予瑞芬太尼后处理,再灌注3 h后,与I/R组比较,其血清ALT、AST活性和肝组织MDA含量均降低,肝组织SOD活性升高,肝组织病理形态学损伤减轻,表明瑞芬太尼后处理减轻了HIRI引起的急性肝损伤和脂质过氧化,抑制了氧化应激反应。
有研究报道,肝脏发生HIRI时,肝组织中HSP70表达升高,高表达的HSP70可发挥重要的肝脏保护作用[15-16]。本研究结果显示,I/R组、R组和Q组大鼠肝组织的HSP70含量均显著高于S组,证明了HIRI时肝组织中HSP70表达升高。本研究还发现,R组肝组织的HSP70含量显著高于I/R组,表明瑞芬太尼后处理可增强肝组织HSP70的表达;同时,R组肝组织的SOD活性也显著高于I/R组,而MDA含量却低于I/R组,原因可能是:HSP70不仅可抑制氧自由基的产生,还能增加内源性SOD的产生,增强SOD的活性,提高机体清除氧自由基的能力,从而减轻脂质过氧化,抑制机体的氧化应激反应[17-18]。为进一步证实瑞芬太尼后处理可通过增强HSP70的表达减轻HIRI,本研究设计了Q组,在瑞芬太尼后处理之前给予槲皮素,具体剂量见文献[13]。槲皮素是HSP70的抑制剂,可通过在转录水平抑制热休克转录因子的磷酸化下调HSP70的表达[19]。本研究中,Q组肝组织HSP70含量与I/R组差别无统计学意义,血清ALT、AST和肝组织SOD活性及MDA含量与I/R组差别也无统计学意义,肝组织病理形态学损伤相似,说明槲皮素使肝组织HSP70的表达减少,消除了瑞芬太尼后处理减轻HIRI的作用。由此可见,瑞芬太尼后处理减轻HIRI的作用机制与增强肝组织HSP70表达有关。
综上所述,瑞芬太尼后处理可减轻大鼠HIRI,减轻脂质过氧化,抑制氧化应激反应,这一作用与增强肝组织HSP70的表达有关。

