透明细胞肾细胞癌中Sema4D的表达及临床意义
许竞泽,杨天宇,钮 慧,娄晓莉,沈珊珊,张永胜
肾细胞癌(renal cell carcinoma, RCC)的发病率占成人恶性肿瘤的2%~3%,占肾脏恶性肿瘤的90%以上,是泌尿系统常见的恶性肿瘤之一[1]。透明细胞肾细胞癌(clear cell renal cell carcinoma, ccRCC)是RCC常见的组织学类型之一,占RCC的70%~80%。与其它泌尿系统肿瘤不同,ccRCC对放疗和化疗均不敏感,因此大部分肿瘤通过手术方式进行切除。然而,约30%的ccRCC患者在初诊时已发生不同程度的扩散或转移,20%~40%患者术后仍会复发,且复发者预后较差[2]。因此,寻找可靠的预后指标及有效的治疗靶点对提高ccRCC患者的生存率和生活质量至关重要。Semaphorin 4D(Sema4D)是信号素Semaphorins家族成员之一。Sema4D在免疫调节、轴突引导、血管生成、骨重塑、肿瘤迁移和侵袭等方面发挥重要作用。目前,Sema4D在ccRCC中表达的相关研究较少。因此,本文旨在探讨Sema4D在ccRCC中的表达意义,为ccRCC患者的预后评估提供新的指标。
1 材料与方法
1.1 材料收集2009年10月~2019年7月苏州大学附属第二医院存档的手术切除的ccRCC标本285例及癌旁正常肾脏组织标本253例作为对照。纳入标准:(1)由两名有经验的病理医师均确诊为ccRCC;(2)临床资料完整。排除标准:(1)合并其它器官恶性肿瘤;(2)术前接受放疗和化疗等相关治疗;(3)有遗传性家族病史。285例ccRCC中,男性194例,女性91例。年龄21~88岁,平均58.6岁,中位年龄60岁,其中≥60岁147例,<60岁138例。肿瘤直径≥5 cm 100例,<5 cm 185例。根据2009年美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第七版分期标准:TNM分期Ⅰ+Ⅱ期272例,Ⅲ+Ⅳ期13例。按照ISUP/WHO核分级将病例分为1~4级,其中193例为低分级(1~2级),80例为高分级(3~4级)。本实验获得苏州大学附属第二医院医学伦理委员会的批准,该实验经患者同意并签署知情同意书。随访截至2021年3月,随访时间1~129个月,中位时间51个月。
1.2 免疫组化采用免疫组化EnVision两步法染色检测Sema4D蛋白在ccRCC组织中的表达。按细胞着色强度计分:无阳性着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞所占百分比计分:阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~74%为3分,≥75%为4分。将两项计分结果相加作为最终结果:0~2分为低表达,≥3分为高表达。
1.3 qRT-PCR采用Trizol试剂盒提取ccRCC和癌旁正常组织总RNA,并逆转录成cDNA。利用qRT-PCR法检测Sema4D基因表达。Sema4D引物序列:上游5′-AAGCAGCATGAGGTGTATTGG-3′,下游5′-AGTTGAGGCACTCTGTCTGTT-3′。内参β-actin引物序列:上游5′-CACCATTGGCAATGAGCGGT TCC-3′,下游5′-GTAGTTTCGTGGATGCCACAGG-3′。PCR反应条件:95 ℃预变性5 min,95 ℃ 10 s、63 ℃ 30 s,合计40个循环,PCR反应结束后分析溶解曲线,每个组织样本设3个复孔,按照2-ΔΔCt计算基因的相对表达量。
1.4 GEPIA数据库分析采用GEPIA数据库(http://gepia cancer-pku.cn/)分析523例ccRCC组织中Sema4D mRNA的表达与患者总生存时间和无瘤生存时间的关联性。
1.5 统计学分析应用SPSS 25.0软件对所有数据进行统计学分析。采用χ2检验分析比较ccRCC中Sema4D表达与临床病理特征的关系。配对资料的比较采用配对t检验,利用Kaplan-Meier法绘制生存曲线,Log-rank法比较组间的生存差异。应用Prism 7.0软件绘制生存曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 ccRCC和癌旁正常组织中Sema4D蛋白的表达285例ccRCC组织中,Sema4D高表达89例(31.2%),低表达196例(68.8%)(图1A~D);在253例癌旁正常组织中,高表达219例(86.6%)(图1E),低表达34例(13.4%),差异有统计学意义(χ2=167.664,P<0.001)。
2.2 ccRCC中Sema4D的表达与临床病理特征的关系Sema4D蛋白表达与ccRCC的ISUP/WHO核分级(χ2=7.262,P=0.007)和脉管转移(χ2=4.066,P=0.044)有关;与患者性别、年龄、肿瘤直径、肿瘤发生部位、TNM分期等无关(P>0.05,表1)。
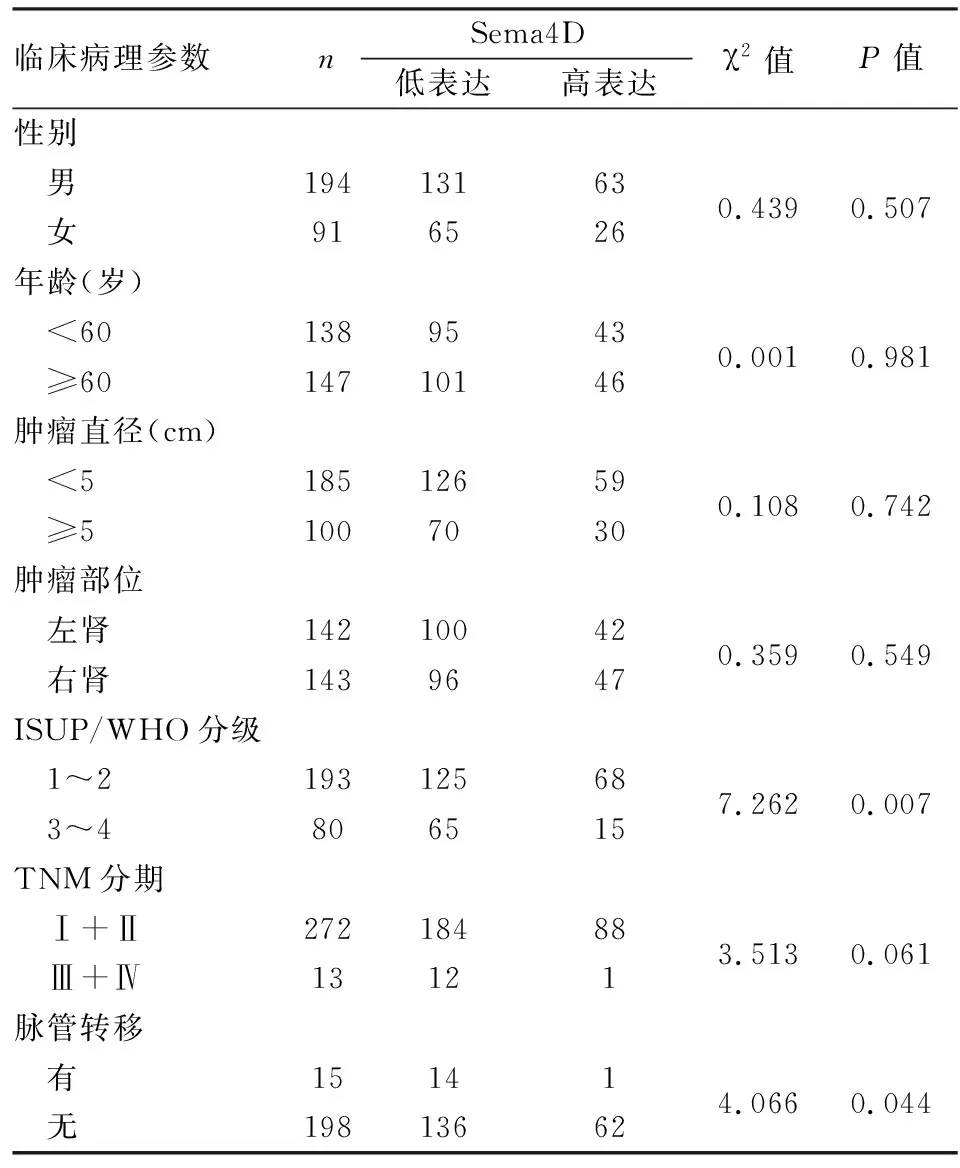
表1 透明细胞肾细胞癌中Sema4D表达与临床病理特征的关系
2.3 ccRCC和癌旁正常组织中Sema4D mRNA的表达qRT-PCR检测20对ccRCC组织和癌旁正常组织结果显示,Sema4D mRNA相对表达量在ccRCC组织中为0.013 2±0.002 9,在癌旁正常组织中为0.031 5±0.004 1,差异有统计学意义(t=3.807,P=0.001),表明Sema4D mRNA在ccRCC组织中表达下调。
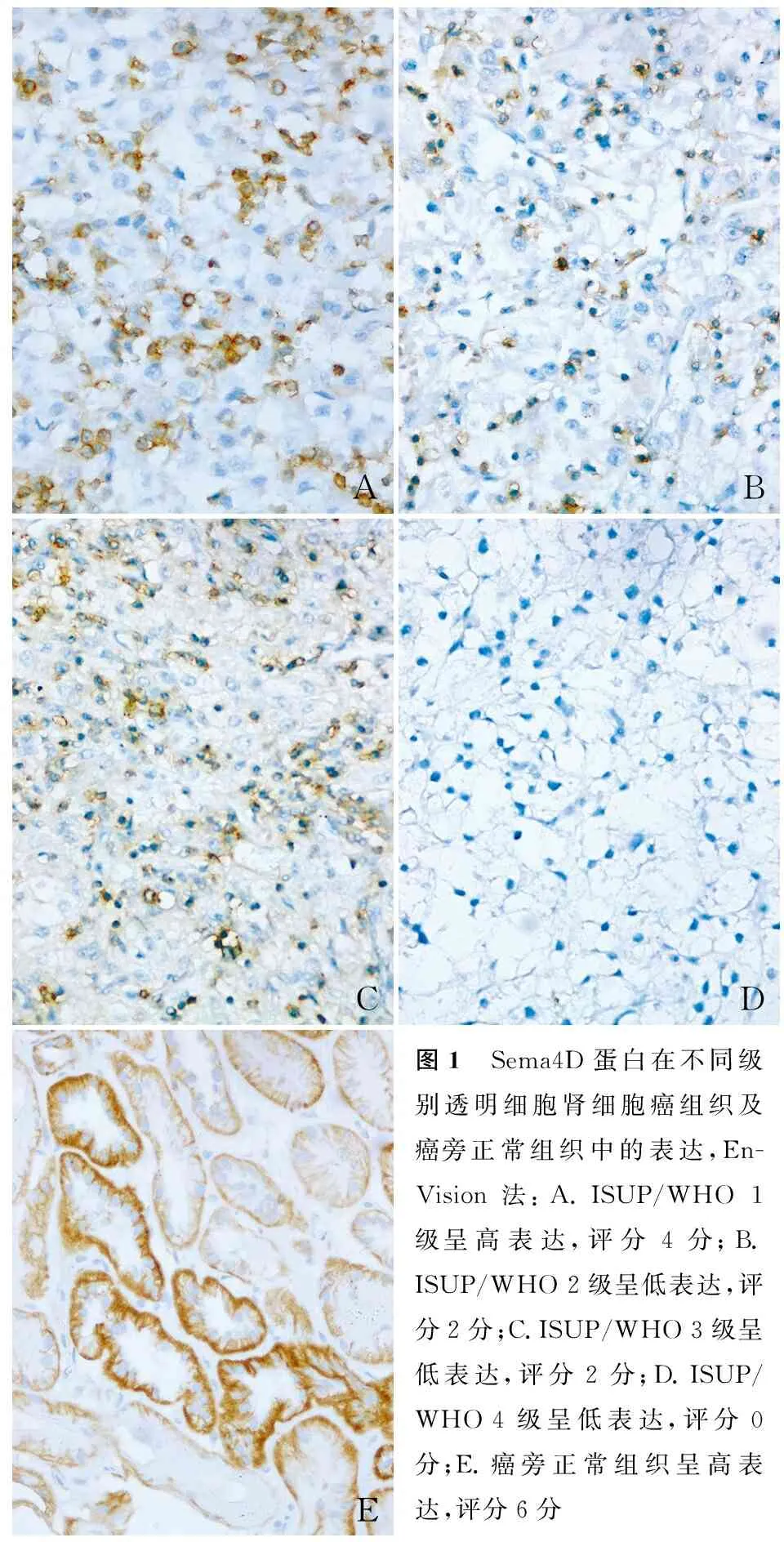
ABCDE图1 Sema4D蛋白在不同级别透明细胞肾细胞癌组织及癌旁正常组织中的表达,En-Vision法:A.ISUP/WHO 1级呈高表达,评分4分;B.ISUP/WHO 2级呈低表达,评分2分;C.ISUP/WHO 3级呈低表达,评分2分;D.ISUP/WHO 4级呈低表达,评分0分;E.癌旁正常组织呈高表达,评分6分
2.4 Sema4D表达与ccRCC患者预后的关系利用GEPIA数据库对Sema4D基因与ccRCC患者生存期的关联性进行分析,结果显示,Sema4D基因高表达ccRCC患者的无瘤生存时间(P=0.000 52)和总生存时间(P=0.001 6)均高于Sema4D基因低表达ccRCC患者(图2A、B),提示Sema4D基因高表达与ccRCC患者的预后良好密切相关。同时,收集207例ccRCC患者的随访资料进行生存分析,结果显示,ccRCC中Sema4D蛋白高表达组患者的生存时间高于低表达组(χ2=3.868,P=0.049,图2C),提示Sema4D蛋白低表达与较差的预后相关。
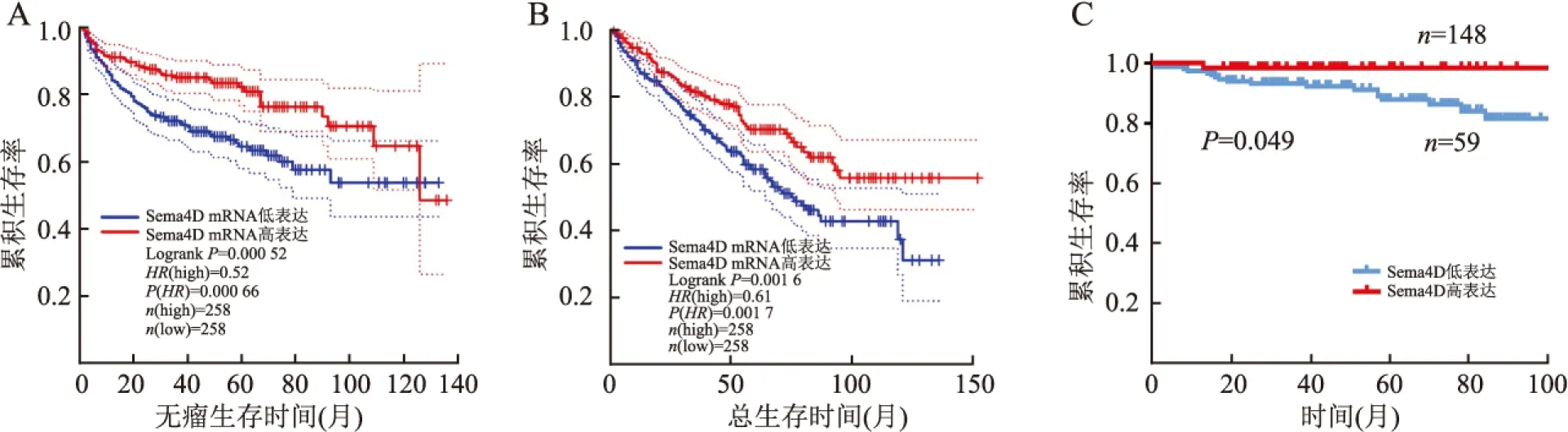
图2 A. Sema4D mRNA表达与透明细胞肾细胞癌患者无瘤生存时间的关系;B. Sema4D mRNA表达与透明细胞肾细胞癌患者总生存时间的关系;C. 透明细胞肾细胞癌中Sema4D高表达组和低表达组患者生存曲线
3 讨论
Sema4D又称CD100,属于Semaphorins信号素家族Ⅳ类成员。Semaphorins家族是一类具有高度保守结构的分泌蛋白和跨膜蛋白分子家族,其N端有一由500个氨基酸残基构成的Semaphorins结构域和下游的丛状蛋白-信号素-整合素结构域(plexin-semaphorin-integrin, PSI),这一特征结构与信号素的活性有关,并在一定程度上决定了受体结合的特异性[3]。根据Semaphorin分子结构的不同,可分为8个家族亚族:无脊椎动物种属中的Semaphorin蛋白为Ⅰ、Ⅱ类,脊椎动物种属中的Semaphorin蛋白为Ⅲ~Ⅷ类,非神经来源的病毒种属中的Semaphorin蛋白属于Ⅷ类[4]。Sema4D蛋白主要以同源二聚体膜结合糖蛋白形式存在,在炎症和肿瘤发生时也可从细胞表面释放,以可溶性蛋白形式存在[5]。Sema4D可通过结合丛状蛋白Plexin-B1、Plexin-B2和CD72等受体发挥血管生成、免疫调节、轴突引导等生理功能。Plexin-B1受体是Sema4D亲和力最高的受体,其主要分布于内皮细胞和上皮细胞,Sema4D的可溶性胞外结构域与Plexin-B1结合并激活酪氨酸激酶受体Met和相关的巨噬细胞刺激蛋白受体Ron,从而促进血管形成,促进肿瘤细胞的迁移、侵袭等生物学过程[6]。Sema4D是人类免疫系统中第一个被发现的信号素,CD72分子主要表达于抗原呈递细胞,如B细胞、树突状细胞和巨噬细胞等,是B细胞的负向调控因子。Sema4D可诱导CD72分子的酪氨酸去磷酸化,导致酪氨酸磷酸酶SHP-1从CD72胞质区尾部分离,从而关闭CD72的负调控作用,诱导B细胞的增殖、活化[7]。
多项研究表明,Sema4D在癌症中可能扮演着双重角色。Sema4D和Plexin-B1在多种癌症中表达上调,如前列腺癌[8]、乳腺癌[9]、卵巢上皮细胞癌[10]、头颈部鳞状细胞癌[11]等。Conrotto等[12]发现了Sema4D可作为一种促血管生成因子,介导Plexin-B1与Met酪氨酸激酶受体结合,从而促进血管生成。Lu等[13]研究发现Sema4D也能在膀胱癌中作为关键因子,通过激活PI3K/AKT通路导致肿瘤细胞增殖和转移。已有研究证明,破骨细胞可产生Sema4D,其与成骨细胞上的Plexin-B1受体结合,抑制成骨细胞运动以及随后获得产生新骨的能力[14]。Yang等[15]进一步发现,乳腺癌细胞过表达Sema4D分子,其能够诱导成骨细胞产生IL-8并刺激破骨细胞生成,从而促进乳腺癌的溶解性骨转移。Sema4D还可通过影响肿瘤微环境(包括血管、免疫细胞、成纤维细胞、细胞外基质),广泛参与肿瘤细胞的增殖、侵袭、转移和免疫逃逸。Wu等[6]发现Sema4D通过抑制单核细胞迁移和促进单核细胞向M2型巨噬细胞分化来调控肿瘤微环境,而M2型巨噬细胞可作为肿瘤启动子。另一方面,肿瘤相关巨噬细胞(tumour-associated macrophages, TAM)通过蛋白酶裂解膜结合Sema4D,使其以可溶性形式释放,从而允许Sema4D作用于局部和远处的肿瘤微环境[16],使肿瘤细胞诱导血管生成成为可能。然而,Lu等[17]发现Sema4D在嫌色性肾细胞癌、ccRCC和甲状腺癌中的表达下降,且在包括膀胱癌、ccRCC、黑色素瘤和胸腺瘤等实体肿瘤中,Sema4D高表达与更长的总生存时间相关。此外,该研究还发现,Sema4D表达与各种肿瘤的免疫浸润水平及多种免疫标志物呈正相关,如在包括ccRCC、黑色素瘤和胸腺瘤在内的大多数肿瘤中,Sema4D表达与CD8+T细胞、CD4+T细胞、B细胞、中性粒细胞和树突状细胞呈正相关,TAM标志物如CCL2、CD86和IL10均与Sema4D高表达显著相关,提示Smea4D可能参与肿瘤的免疫调节。Sema4D和Plexin-B1也可在乳腺癌中作为抑癌因子发挥作用。Malik等[18]研究发现,与无瘤生存的患者相比,乳腺癌局部复发患者的Sema4D、Plexin-B1和Plexin-B2表达降低,且Sema4D下调与更差的无瘤生存时间有关(中位生存时间111.6个月,95%CI=96.5~126.7)。进一步研究发现,ER可能参与调节信号素和丛状蛋白的表达:与ERα阴性患者相比,ERα阳性患者的Sema4D和Plexin-B1表达增加。另外,Gómez等[19]研究发现Plexin-B1在ccRCC中的表达也下降。qRT-PCR实验结果表明,与癌旁正常组织相比,ccRCC组织中Plexin-B1 mRNA表达水平下降达2~6倍。免疫组化显示209例ccRCC组织中Plexin-B1的阳性率为19.1%,而在所有正常肾组织中均阳性。细胞增殖实验进一步发现,转染Plexin-B1载体的细胞增殖率明显低于对照组ACHN细胞系。总之,Plexin-B1可能作为抑癌因子,通过抑制ccRCC细胞的增殖来发挥抑癌功能。本实验通过qRT-PCR和免疫组化检测Sema4D基因和蛋白在ccRCC组织中的表达,结果表明,与癌旁正常组织相比,Sema4D基因和蛋白表达均降低。进一步研究发现,Sema4D蛋白表达与ccRCC的ISUP/WHO分级和脉管转移有关。生存分析发现,ccRCC中Sema4D蛋白高表达组患者的生存时间长于低表达组;同时GEPIA在线数据结果表明,Sema4D基因高表达ccRCC患者的无瘤生存期和总生存期均高于低表达患者,以上结果提示Sema4D蛋白与ccRCC的发生、发展密切相关,并可能成为ccRCC潜在的治疗靶点,为ccRCC患者的预后评估提供重要指标。
综上所述,Sema4D在许多实体肿瘤中表达上调,而本研究发现Sema4D基因和蛋白在ccRCC组织中表达下降,且与ccRCC的ISUP/WHO分级和脉管转移相关,其生物学机制相关报道仍少见,这也为我们未来的研究指明了新的方向。鉴于Sema4D蛋白在肿瘤发生、发展中的重要作用,相信随着对其作用机制研究的不断深入,其有望在肿瘤的治疗上成为新的有效靶点。

