EBV相关性伴淋巴样间质胃癌4例临床病理分析
林泽泱,廖洪锋,郭舒静,庄国洪,叶宇涵,白婷婷,刘争进,殷 平
EBV相关性伴淋巴样间质胃癌(Epstein-Barr virus-associated gastric carcinoma with lymphoid stroma, EBVaGCLS)是一种少见的伴人类疱疹病毒4型(human herpesvirus-4, HHV-4)感染的特殊类型胃癌,其组织病理学、免疫表型与EBV阴性胃癌有所不同。因此,本文收集4例EBVaGCLS并结合相关文献探讨其临床病理学特征、免疫表型,旨在为该病的治疗及预后提供参考。
1 材料与方法
1.1 临床资料收集2019~2020年厦门大学附属中山医院1 371例原发性胃癌,收集其中4例EBVaGCLS,患者均为男性,年龄60~66岁,平均62岁,中位年龄63岁。所有病例均经两位有经验的病理医师重新阅片,诊断标准参照WHO(2019)消化系统肿瘤进行分类。
1.2 方法标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片,行HE染色。免疫组化采用EnVision两步法染色,一抗包括CKpan、CK-L、CK7、错配修复蛋白(MLH1、PMS2、MSH2、MSH6)、AFP、Heppar-1、Syn、CgA、CD56、CD3、CD20及Ki-67等;EBER原位杂交检测仅细胞核着色为阳性。抗体及EnVision试剂盒均购自福州迈新公司,具体操作步骤按试剂盒说明书进行。
2 结果
2.1 临床特点临床多表现为上腹部闷痛、不适、体重骤降、呕血。病变多单发,好发于近端胃(3例近端胃,1例残胃)。例1,40年前行胃大部切除术,具体不详,余3例均无特殊病史;术前未行辅助治疗,均行完整肿物切除术+辅助化疗,术后病理均为进展期胃癌(pTNM:T2N2M0 Ⅱb~T4bN1M0 Ⅲb)。术后随访5~12个月不等,有1例死亡(表1)。
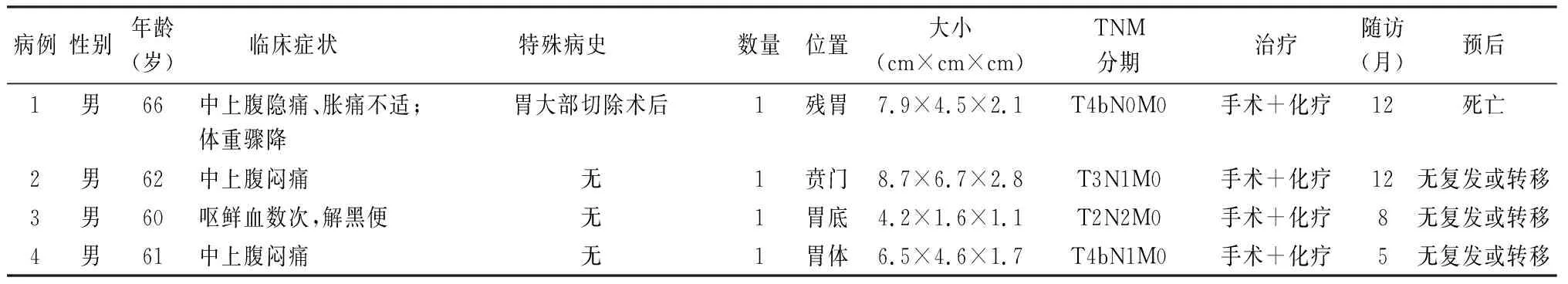
表1 4例EBV相关性伴淋巴样间质胃癌临床资料
2.2 病理检查
2.2.1眼观 肿物多表现为溃疡浸润型,大小4.2 cm×1.6 cm×1.1 cm~7.9 cm×4.5 cm×2.1 cm,界限欠清,质地灰白、实性、质中,无出血、坏死(图1)。
2.2.2镜检 肿瘤组织呈浸润性生长,与周围正常胃黏膜有分界,可见异性增生到浸润性癌的发展过程(图2),肿瘤呈分化差的腺管(图3)、条索或网状(图4)。肿瘤细胞界限不清,呈合体样,胞质丰富,核圆形或卵圆形,呈空泡状,可见小核仁。无促纤维结缔组织反应,可见大量成熟淋巴细胞、浆细胞浸润间质(图5);部分病例可见脉管内癌栓(图6)。
2.2.3免疫表型 肿瘤细胞CKpan、CK-L、CK7(图7)、MLH1、PMS2、MSH2、MSH6均阳性,所有病例肿瘤细胞EBER原位杂交呈阳性(图8),所有病例间质淋巴细胞CD3(图9)、CD20(图10)混杂阳性,Syn、CgA、CD56、APF、Heppar-1等均阴性,Ki-67增殖指数20%~80%。
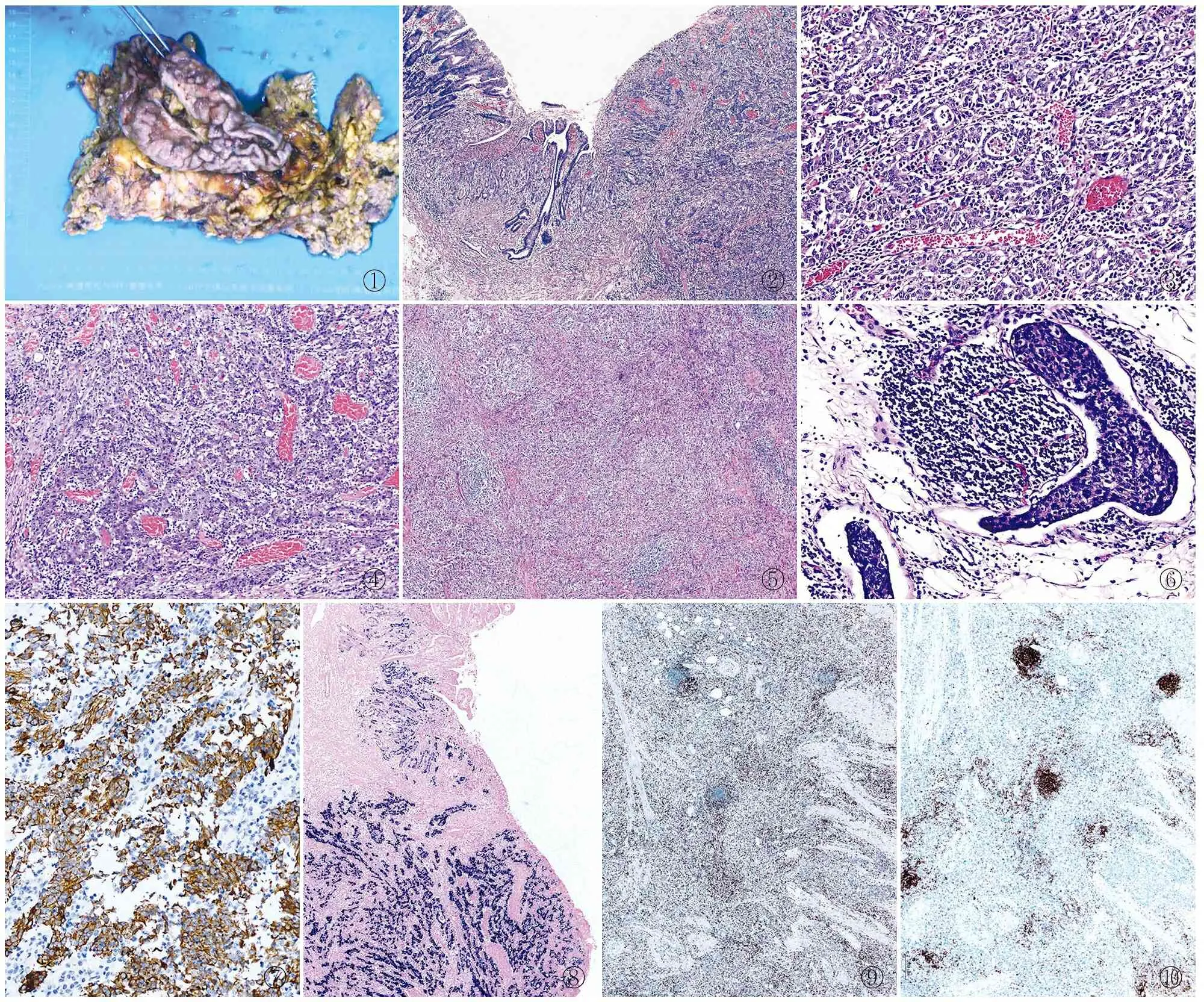
①②③④⑤⑥⑦⑧⑨⑩
3 讨论
伴淋巴样间质的胃癌(gastric carcinoma with lymphoid stroma, GCLS),又称髓样癌或淋巴上皮瘤样癌,由Burked等[1]于1990年首次发现并命名,占胃癌的1%~7%,其中80%以上存在EBV感染;其余部分则是错配蛋白修复缺陷相关性胃癌[2]。然而,并不是所有EBV感染的胃癌都表现为伴有淋巴样间质,EBV感染也存在于部分分化型胃癌,占1.8%~18%[3-4]。随着对胃癌研究的不断深入,WHO(2019)消化系统肿瘤也提出了胃癌的分子分型,包括EBV相关型、微卫星不稳定型、基因组稳定型和染色体组不稳定型。提示EBV感染相关性胃癌是一组具有特定分子特征和致癌机制的胃癌亚型,其中又以EBVaGCLS较为常见。
EBV是疱疹病毒家族中8种已知的人类疱疹病毒之一,也是人类最常见的致病病毒之一。儿童感染EBV通常无症状;成人感染EBV表现为不同程度的发热、咽痛、淋巴结肿大等症状。大多数可自行痊愈,少数患者病情迁延,发展为慢性感染及肿瘤。其中关系最明确的是地方性Burkitt淋巴瘤和鼻咽癌,其次为NK/T细胞淋巴瘤、霍奇金病、移植后淋巴组织增殖性疾病、鼻咽癌、胃腺癌、胆管癌、炎性假瘤等[2,5-7]。胃癌的发展是一个多步骤的过程,从正常到癌前病变再到高度恶性肿瘤,伴随着多种基因改变的积累,而特定的组织学类型也代表着不同的分子机制。依据TCGA数据分析,EBV相关性胃癌常出现PIK3CA(80%)、ARID1A(55%)和BCOR(23%)突变,以及CDKN2A启动子甲基化(45%),从而导致出现CDKN2A、JAK2、PD-L1和PD-L2过表达。但EBV是如何感染胃黏膜上皮细胞,目前尚未清楚[4,8-9]。
临床显示,EBVaGCLS亚洲多见,具有明显的男性发病倾向,好发于近端胃(胃底、胃体)[8],临床上无特异症状,主要表现为腹痛,影像学表现与经典型胃癌无差异,诊断主要依靠组织学检查及EBER原位杂交检测。
组织学上,EBVaGCLS呈溃疡凹陷或溃疡浸润型,与周围组织界欠清,切面灰白、实性。镜下肿瘤组织由上皮的异形增生到浸润性癌,肿瘤组织浸润性生长,呈分化差的腺管、条索或网状,无促纤维结缔组织反应,可见大量成熟淋巴细胞、浆细胞浸润间质。肿瘤细胞界限不清,呈合体样,胞质丰富,核圆形或卵圆形,呈空泡状,可见小核仁,可见核分裂象。免疫表型:肿瘤上皮标记CKpan、CK-L阳性,间质淋巴细胞呈杂合性反应增生。EBER原位杂交显示肿瘤组织及异形增生的上皮呈弥漫一致阳性,而正常胃黏膜及淋巴组织阴性,并且正常上皮与肿瘤之间移行过渡,进一步证明EBV感染在胃癌发生前,是胃癌的致病因素,与Shibata和Weiss[2]的结论相同。
鉴别诊断:(1)低分化癌伴淋巴组织反应性增生:患者常有放、化疗史,且EBER原位杂交阴性。(2)转移性伴淋巴样间质的癌(carcinoma with lymphoid stroma, CLS):好发于鼻咽,组织学常呈巢状排列,不含腺样结构,无胃黏膜与浸润性癌移行过渡的区域,免疫组化标记CK7阴性。(3)微卫星不稳定型胃癌(microsatellite instability associated gastric carcinoma, MSIaGC):其组织学类似EBVaGCLS,但免疫组化显示MMR蛋白表达缺失,EBER原位杂交阴性,而EBVaGCLS中EBER原位杂交阳性。
EBVaGCLS多为早期胃癌,淋巴结转移率较低,肿瘤局限于黏膜层(pT1a),其淋巴结转移率为0[10-11];当肿瘤浸润到黏膜下层(pT1b),淋巴结转移率为4.2%[12]。因此,ESD切除可作为治疗EBVaGCLS的主要手段[9,12-14]。对于进展期EBVaGCLS,Iwasaki等[15]报道7例同时有淋巴结转移的进展期EBVaGCLS,其淋巴结转移个数显著少于伴淋巴结转移的EBV阴性胃癌,其预后也明显好于EBV阴性胃癌。因此他大胆提出假设,对于不耐受辅助化疗的进展期EBVaGCLS,或许可以只进行根治性切除就能达到理想的预后。本组例1术后第4个月多发骨转移,继续随访9个月后死亡,高于文献报道胃癌骨转移的平均中位生存时间4个月[16];其余3例均无复发及转移,预后良好。
EBVaGCLS与EBV阴性胃癌相比,不管在早期胃癌、进展期胃癌或是经过化疗后的胃癌都具有良好的预后,与其较低的淋巴结转移率及丰富的淋巴间质相关,特别是CD8+T细胞;这与自身免疫反应呈正相关,当浸润的淋巴细胞越多,其预后越好,包括提高浸润的淋巴细胞对肿瘤的抗原提呈效果及激活T细胞的免疫活性[3,17-18]。
EBV相关性胃癌除了手术治疗,新辅助治疗也取得明显成果。如根据其特定的分子机制,针对PI3K/mTOR分子通路的抑制剂BEZ235的临床胃癌应用,以及针对PD-L1阳性肿瘤细胞的药物可瑞达的Ⅱ期临床试验均取得显著效果[7,18-20]。另外,针对EBV本身的治疗,包括促使EBV从潜伏期进入复制期,诱导宿主细胞的死亡而激活免疫反应,甚至EBV疫苗的研发也取得实质性进展[21]。然而在实践中,约20%分化型胃癌存在EBV感染,这部分病例由于缺乏淋巴样间质而错失EBV检测,错过靶向及免疫治疗的机会。因此我们提议,即使不能对所有的胃癌患者进行EBER原位杂交检测,也要对失去手术机会、复发的患者常规行EBV检测。
综上所述,EBVaGCLS作为TCGA胃癌分子分型的一个特殊亚型,具有独特的临床病理和分子遗传学特征。本文通过分析4例EBVaGCLS,阐述了其特殊的组织病理形态、免疫表型、良好的预后及靶向治疗的前景。但EBV导致胃癌的发生具体机制目前尚不清楚,进一步了解病毒基因组与宿主基因组的相互作用,将有助于早期诊断及个体化治疗。

