重度阻塞性睡眠呼吸暂停患者的异常前庭诱发肌源性电位△
罗慧娉 余菁 许信达 王璟 吴海涛 迟放鲁
(复旦大学附属眼耳鼻喉科医院耳鼻喉科 上海市听觉医学临床中心 卫生部听觉医学重点实验室 上海 200031)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种常见的耳鼻咽喉科疾病,表现为睡眠时呼吸气流减弱或停止,伴随夜间低氧血症和睡眠片段化,影响6%~13%的成年人群,如未得到及时诊治,会严重影响患者的身体健康和生活质量。夜间呼吸暂停和低通气,可造成慢波睡眠和快速动眼睡眠时空气流量和(或)氧饱和度减少,进一步影响神经滋养血管,导致中枢和外周神经系统损伤,影响各神经系统的生理反射通路[1]。内耳是重要的外周神经感受器官。有研究[2]显示,重度OSA患者的纯音听阈较高,畸变产物耳声发射异常,听性脑干反应(auditory brainstem response,ABR)潜伏期延长,说明耳蜗很可能受到呼吸暂停及低通气的影响。那么,作为重要的外周神经感受器官,前庭是否也有可能受到影响呢?Tsai等[3]发现,OSA患者的眩晕累积发生率明显高于正常人。Micarelli等[4]发现,与正常人相比,OSA患者的姿势维持功能出现异常,而且其异常程度与平均血氧饱和度呈负相关。此外,Sowerby等[5]对特发性头晕(idiopathic dizziness,ID)患者进行了量表评估分析,如Epworth嗜睡量表、柏林问卷和多变量呼吸暂停风险指数(multivariable apnea risk index,MAP)等测试,发现ID患者更容易出现白天嗜睡和睡眠呼吸暂停症状。这些研究结果提示,OSA患者可能存在前庭系统受损情况。眼肌前庭诱发肌源性电位 (ocular vestibular-evoked myogenic potentials,oVEMP)和颈肌前庭诱发肌源性电位 (cervical VEMP,cVEMP)已广泛应用于椭圆囊和球囊及其相应反射通路的功能评价[6-7]。本研究联合应用oVEMP及cVEMP评估重度OSA患者的椭圆囊和球囊及其传导通路的功能,并分析变化规律。
1 资料与方法
1.1 临床资料 按入选标准和排除标准招募2020年1~10月在我院鼾症诊疗中心就诊的重度OSA患者30例(60耳),为病例组,其中男性28例、女性2例;年龄22~50岁,平均(35.7 ± 9.6)岁。调取分析所有受试者的临床病历资料。全部受试者均有完整的耳鼻咽喉头颈外科常规体检资料,并接受了双温实验、oVEMP、cVEMP等检查。
入选标准:①根据最新指南[8]标准,患者均确诊为重度OSA患者,在多导睡眠图(polysomnography,PSG)中,呼吸暂停低通气指数(apnea hypopnea index,AHI)均>30次/h;②常规查体和问诊无其他眼耳鼻喉头颈等方面疾病;③既往无耳聋、耳病史;④耳镜、纯音测听、声阻抗检查正常;⑤同意参与试验并自愿签署知情同意书。
排除标准:①良性阵发性位置性眩晕、梅尼埃病、前庭神经元炎等周围性眩晕患者,以及合并中枢性眩晕的患者;②慢性病及全身系统性疾病患者,如糖尿病、高血压病且控制不良、已知神经系统疾病、心血管疾病患者;③有颅脑、耳部、颈部或眼部手术创伤史或听觉疾病史的患者;④颈椎、眼肌以及胸骨平面以上有畸形或活动障碍的患者;⑤代谢性疾病患者;⑥不同意签署知情同意书。
选取健康志愿者作为对照组。对照组既往无耳聋、耳病史及其他神经系统、全身疾病史,耳镜、纯音测听、声阻抗检查正常,均无睡眠打鼾伴张口呼吸或憋气主诉,PSG提示AHI<5次/h,且最低血氧饱和度>90%。共入组21例(42耳),其中男性16例、女性5例;年龄30~45岁,平均(37.1±3.1)岁。2组研究对象年龄、性别、身高、体重等差异均无统计学意义。
本研究检测项目通过我院伦理委员会审核批准。所有检测对象检测前签署知情同意书。
1.2 病案分析 病例组患者的完整病案(包括主诉、现病史、既往病史等)以及医师问诊的主要内容均被记录收集并进行详细分析。将其中关键词分为3类:①与鼾症相关的关键词,如“打鼾”、“睡眠憋气”、“睡眠时窒息感”等相似词汇;②与前庭相关的关键词,如“头晕”、“眩晕”、“走路及站立不稳”、“看到周围环境旋转”等相似词汇;③其他症状的关键词如“夜尿增多”、“记忆力下降”、“梦魇”、“心悸”、“大汗”、“头痛”、“乏力”、“注意力下降”等。
所有病案内容按照以下6个关注点进行分类计分,并进行关注度分析。
患者主动提及的:A.关于打鼾症状的主诉;B.关于平衡症状的主诉;C.关于其他症状的主诉。
医师主动询问的:D.关于打鼾相关病情的询问;E.关于前庭功能异常的询问;F.关于其他病情的询问。
每一份病案中,出现1项或多项属于上述关注点的内容,则在相应关注点得分上加1分。对所有病案总结的结果进行分析,表明了哪些方面的内容引起了患者或医师的更多关注。
1.3 PSG 本研究所有入组病例PSG均使用Embla N7000多导睡眠监测仪进行采集。睡眠监测通过全脑电导联、眼电导联、下颌颏舌肌电导联、双侧胫前肌电导联、体位传感器记录睡眠分期、体位和体动,呼吸监测内容包括鼻气流、热敏气流、鼾声、胸腹呼吸动度、指末血氧饱和度和心电监测,以记录呼吸事件和伴随的血氧饱和度下降。根据2018年美国睡眠医学会睡眠及相关事件判读规则(AASM MANUAL 2.5)进行睡眠分期及相关事件分析,其中呼吸暂停定义为气流完全停止超过10 s;低通气定义为气流波幅下降达到基础呼吸波幅30%以上部分持续10 s,并伴有3%的血氧饱和度下降或伴有微觉醒。OSA定义为有该疾病症状的患者在睡眠期间AHI>5次/h。
1.4 oVEMP和cVEMP VEMPs均在隔音检查室中施行。使用Bio-Logic Navigator PRO (Natus)仪器进行测试。ACS刺激声为500 Hz短纯音,上升/下降时间2 ms,峰时持续时间2 ms。带通滤波器10~1 500 Hz,叠加120次。ACS通过校准过的耳机传输至受试者耳中。为检查受试者是否能诱发出VEMPs,首先以125 dB SPL的刺激值作为起始强度。随后,以5 dB SPL为一个阶梯逐级减低刺激值。
oVEMP和cVEMP测试方法在既往文献[9]中已有详细描述,简述如下。受试者仰卧。oVEMP测试中,记录电极位于两侧眼眶下缘中点下方约1 cm处,参考电极置于记录电极下方,两侧对称,接地电极置于前额正中。极间电阻<5 kΩ。当受试者听到从耳机传来的声音时,要求其向前上方注视并保持。cVEMP测试中,记录电极位于两侧胸锁乳突肌中段,参考电极放置于两侧胸锁关节表面,两侧对称放置,接地电极置于前额正中。极间电阻<5 kΩ。当受试者听到从耳机传来的声音时,要求其抬头使得胸锁乳突肌收缩并处于持续紧张状态,并保持头部位置处于身体正中线。
记录并分析oVEMP的阈值、N1潜伏期、P1潜伏期、N1-P1波间期及振幅。记录并分析cVEMP阈值、P1潜伏期、N1潜伏期、P2潜伏期、P1-N1波间期及振幅、N1-P2波间期及振幅。
1.5 统计学处理 采用IBM SPSS 19.0.0进行分析。病例组和对照组oVEMP和cVEMP引出率的比较,采用χ²检验。病例组和对照组VEMPs各项参数的比较,采用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 病案分析总结 在病案分析中,病例组每位患者的主诉均记录为“夜间睡眠打鼾和憋气”或相似内容。30例患者均详细阐述了打鼾、白天日常生活、夜间睡眠情况,但少有主动提及前庭功能相关内容。医师在问诊时,也详细询问了打鼾等问题,而主动询问前庭功能的尚不多。
对病例组患者的完整病案进行关注点的评分分析,结果显示:关注点B和C分别与A比较,差异有统计学意义;关注点E和F分别与D比较,差异有统计学意义(表1)。

表1 病例组病案内容关注点的评分结果
2.2 对照组和病例组的测试结果 oVEMP、cVEMP结果显示引出率分别为97.6%和100.0%(表2)。病例组中,oVEMP和cVEMP的引出率分别为73.3%和81.7%。详见表2、图1。可见,在重度OSA患者中,部分患者的oVEMP和cVEMP引不出,既往文献[10]将其定义为“VEMP消失”。
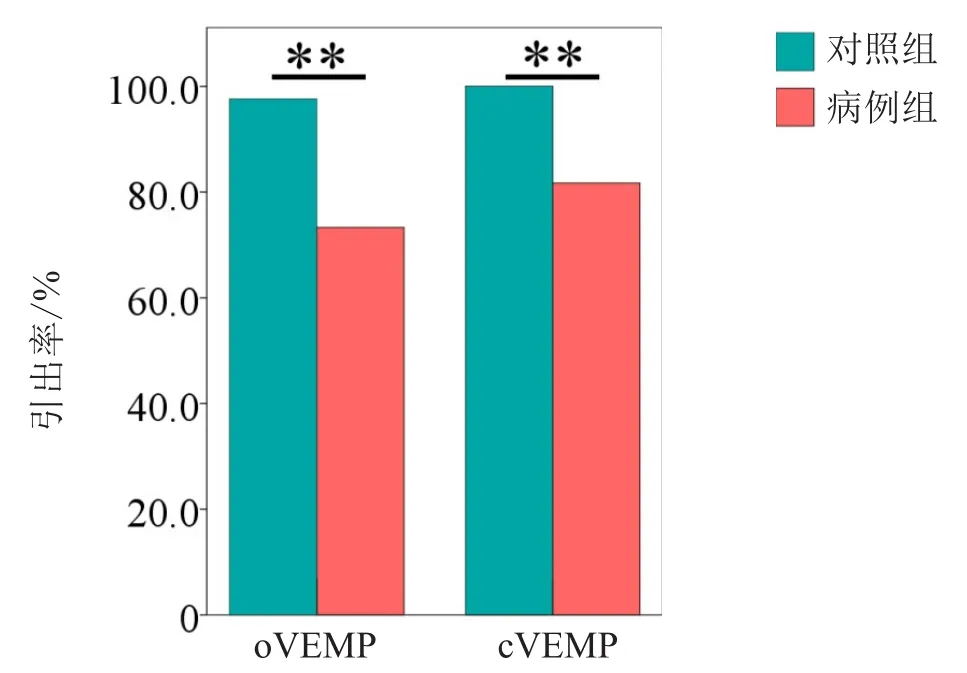
图1 病例组与对照组VEMPs引出率的比较 病例组的oVEMP和cVEMP引出率均显著小于对照组。**示卡方检验,P<0.01。
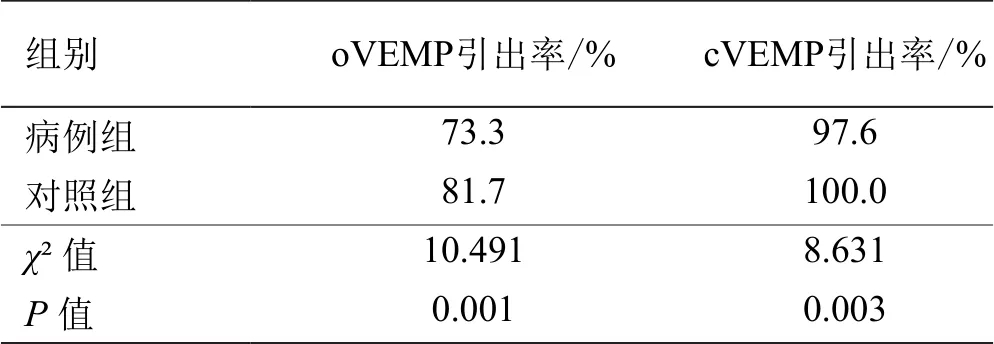
表2 病例组与对照组VEMPs的引出率比较
病例组中,在仍能够引出的VEMPs中发现了波形参数的异常变化(图2、表3、表4)。

图2 重度OSA患者VEMPs参数的异常变化 A.oVEMP病例组与对照组比较,可见病例组的N1潜伏期延长,N1-P1振幅缩小;B.cVEMP病例组与对照组比较,可见病例组的P1潜伏期延长,P1-N1振幅和N1-P2振幅缩小。

表3 病例组与对照组oVEMP的波形参数比较

表4 病例组与对照组cVEMP的波形参数比较
病例组与对照组相比,oVEMP的阈值、N1潜伏期、N1-P1波间期、N1-P1振幅差异均有统计学意义(P值均<0.001,图3),P1潜伏期未见明显差异(P=0.412)。病例组与对照组相比,cVEMP的阈值(P<0.001)、P1潜伏期(P=0.005)、P1-N1波间期(P<0.001)、P1-N1振幅(P<0.001)、N1-P2振幅(P<0.001)差异均有统计学意义(图4),N1潜伏期、P2潜伏期、N1-P2波间期,差异均无统计学意义。

图3 病例组与对照组oVEMP的参数对比 A.阈值;B.N1潜伏期;C.N1-P1波间期;D.N1-P1振幅。**示t检验,P<0.001。
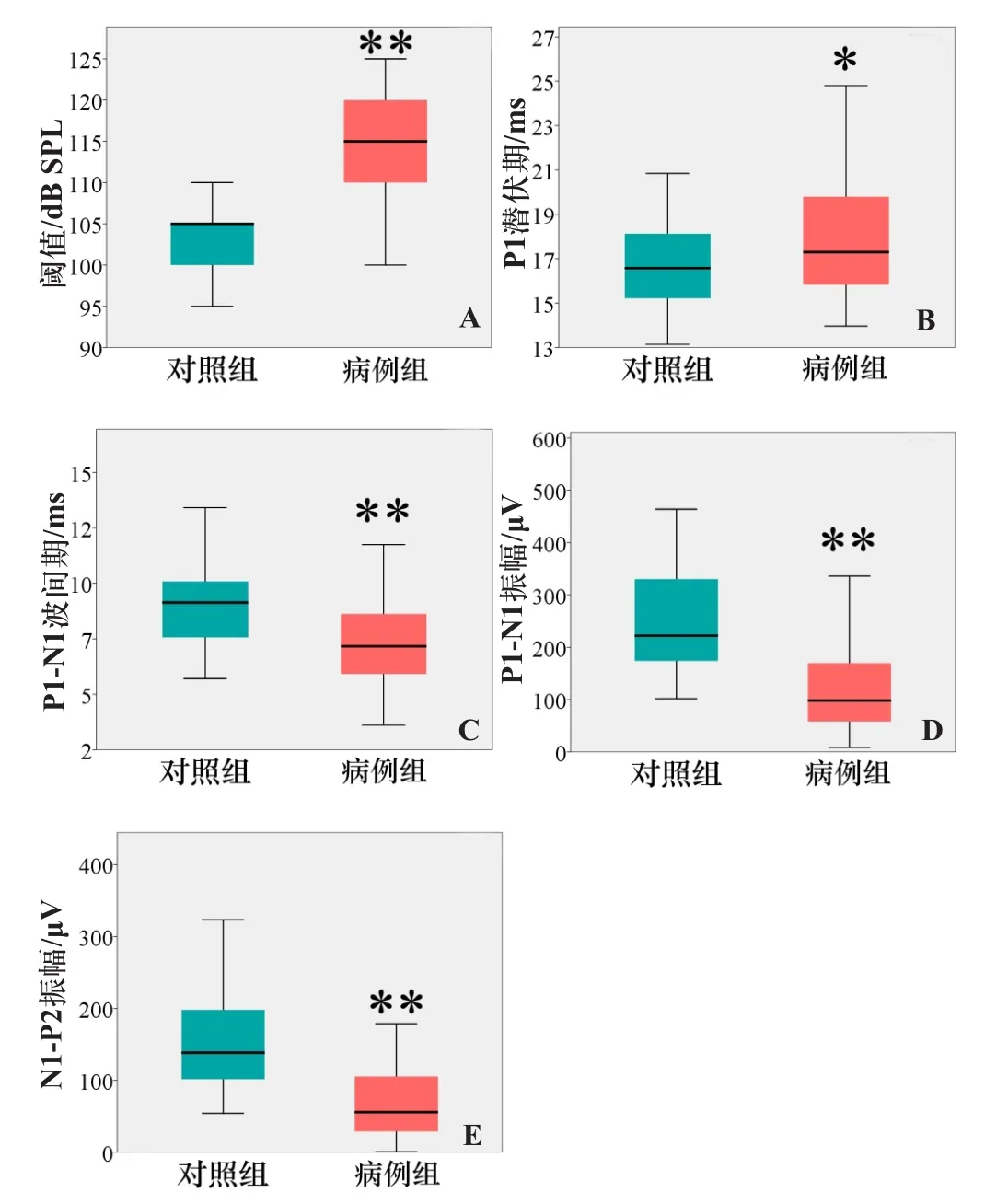
图4 病例组与对照组cVEMP的参数对比 A.阈值;B.P1潜伏期;C.P1-N1波间期;D.P1-N1振幅;E.N1-P2振幅。*示t检验,P=0.005;**示t检验,P<0.001。
病例组30例中有29例(58耳)完成了双温试验,提示50耳(86.2%)正常,8耳(13.8%)异常;对照组21例(42耳),双温试验提示38耳(90.5%)正常,4耳(9.5%)异常,2组差异无统计学意义(χ²=0.420,P=0.517)。
3 讨论
有研究[11]指出,在OSA患者的ABR检查结果当中,Ⅰ、Ⅲ、Ⅴ波潜伏期和波间期(Ⅰ-Ⅴ、Ⅰ-Ⅲ、Ⅲ-Ⅴ)均有不同程度的延长。Fu等[12]报道,OSA患者的ABR潜伏期延长,且与AHI密切相关。说明耳蜗及其传导神经通路可能受到呼吸暂停及低通气的负面影响。从解剖学上讲,前庭与耳蜗相邻,故前庭中的椭圆囊和球囊也可能同时受到呼吸暂停和低氧血症的影响,造成椭圆囊和球囊的感受器细胞损伤,甚至对声音刺激无反应,出现VEMPs异常。有研究者通过VEMPs来评估OSA患者前庭功能受损情况,并发现了一些规律。Ulusoy等[13]对轻、中、重度OSAHS患者各20例行VEMPs测试,结果显示中度和重度OSAHS患者的VEMPs引出率显著低于对照组和轻度患者。Mutlu等[14]对28例AHI>70次/h的患者和26例睡眠打鼾但AHI<5次/h的对照组进行cVEMP测试,结果发现重度OSAHS患者cVEMP引出率显著降低。在本研究中,重度OSA患者的oVEMP和cVEMP引出率分别为73.3%和81.7%,显著低于对照组,说明一部分患者出现“VEMP消失”[15]现象,提示椭圆囊和球囊以及其反射传导通路严重损伤。
在另一部分OSA患者中,oVEMP和cVEMP虽然仍能引出,但是阈值、振幅、潜伏期和波间期出现异常,即“VEMP受损”[15]。Ulusoy等[13]发现中度和重度OSAHS患者的cVEMP振幅显著低于轻度OSAHS患者。Mutlu等[14]观察到,重度OSAHS患者cVEMP的振幅降低。在既往文献中,oVEMP的规律性研究结果尚不多。本研究中,与对照组相比,oVEMP和cVEMP波形均出现了显著的阈值升高,也就是说,重度OSA患者需要更大的声刺激才能诱发椭圆囊和球囊毛细胞的反应,引起相关神经传导通路的反射;同时,本研究发现oVEMP的N1-P1振幅较对照组降低,cVEMP的P1-N1振幅及N1-P2振幅也显著降低,说明即使在最大刺激声刺激下,VEMPs的响应能力也表现出较正常人明显下降的特点。以上现象都说明,重度OSA患者的前庭椭圆囊和球囊及其传导通路功能整体呈现显著下降趋势。
VEMPs已被广泛用于外周和中枢神经系统疾病的检测,如帕金森病、多发性硬化和脑干卒中等引起的脑干损伤[16-19]。在多发性硬化症患者中,最常见的VEMPs表现是波形消失、潜伏期延长和振幅降低,且被认为是前庭通路或前庭核的脱髓鞘所致[16]。在对帕金森病患者进行VEMPs检查时发现,患者常常出现波形消失、振幅减低和潜伏期延长等异常状态[17]。Chen等[18]报道,脑干卒中患者的VEMPs出现无法引出或者潜伏期延长等现象。Heide等[19]也发现脑干梗死患者无法引出VEMPs波形,或可出现振幅减低和潜伏期改变。可见,帕金森病等中枢神经系统疾病患者的VEMPs表现为异常状态,而OSA作为多种神经系统疾病的诱因和危险因素,在其患者中也观察到大量VEMPs异常病例。我们推测有以下几种可能的机制。①OSA与脑缺血相关。OSA患者在呼吸暂停期出现平均动脉压和脑血流速度下降,引起低氧血症和脑灌注减少,导致夜间脑部缺血;而迷路及其相关神经通路等外周神经系统对缺血、缺氧敏感,故可能在此过程中受损[20]。②OSA与脑干神经核团损伤相关。缺氧豚鼠的脑干区出现神经元和胶质细胞凋亡等现象,可能同时会对脑干的前庭核团造成损伤[9],并波及椭圆囊和球囊及其神经传导通路。③OSA与氧化应激和系统性炎症相关。夜间间歇性低氧血症是一种反复发生的缺血-再灌注过程,会产生大量活性氧,导致氧化应激[21]和血管内皮功能障碍[22]等损害。而重度OSA患者的血液中,中性粒细胞比例增高并可释放炎症细胞因子、组织损伤酶等物质,增强炎症反应,导致血管内皮损伤[21,23],系统性影响血供,使得椭圆囊和球囊及其神经传导通路缺血受损。上述机制可能是OSA导致椭圆囊和球囊及其传导通路损伤的部分原因,临床上可以在VEMPs等客观前庭功能检查中观察到异常。
此外,在VEMPs的参数方面,本研究还针对oVEMP和cVEMP的潜伏期进行了详细记录和统计分析。我们发现,OSA患者的VEMPs第一波(oVEMP中为N1波,cVEMP中为P1波)潜伏期显著延长,而其后的波(oVEMP中为P1波,cVEMP中为N1波和P2波)潜伏期未见明显延长。值得注意的是,在重度耳聋与VEMP的一些研究中,虽然也发现了VEMPs阈值升高和振幅降低的典型变化,但第一波的潜伏期未出现OSA患者的此种典型现象[15]。笔者暂将此命名为VEMPs的第一波延迟现象,这一现象或可区别OSA等全身系统性疾病与重度耳聋等局部性疾病对椭圆囊和球囊功能影响的差异。比如,相比于耳聋,重度OSA更易造成VEMPs传导通路中的传入神经、脑干部分以及传出神经等多处损害。这一现象还可能说明,VEMPs的波形曲线潜伏期中,以第一波的波形最为敏感,在全身系统疾病影响周围神经时,第一波的损害更易被检测和发现。
“VEMP消失”和“VEMP受损”均提示了在重度OSA患者中发现了椭圆囊和球囊及其传导通路的功能障碍。然而,在对病例组30例患者的病案分析中,我们发现患者和医师均未重视平衡问题或椭圆囊和球囊功能障碍的问题。当然,视觉系统和本体感觉的补偿[24]可以解释这一现象,因为这种补偿可以代偿一部分平衡障碍症状,使得患者和医师都没能察觉椭圆囊和球囊功能的异常。对重度OSA患者和接诊医师来说,对OSA疾病本身的强烈关注也妨碍了对前庭功能障碍的关注。也就是说,虽然在重度OSA患者中,可以非常明确发现椭圆囊和球囊及其传导通路的功能障碍,但是由于前述诸多原因,这一现象很难在临床工作中被察觉,故表现为一种“亚临床”前庭功能障碍。这提示在重度OSA患者的临床诊断和治疗中,应同时考虑椭圆囊和球囊及其传导通路的功能障碍以及相关治疗,以确保对该类患者做出全面的诊断和恰当的治疗,更好地造福患者。

