基因表达谱技术在多发性骨髓瘤分子分型中的应用*
李瑾 综述 卢绪章 审校
多发性骨髓瘤是一种具有高度异质性的恶性浆细胞疾病。在过去的20年中,自体干细胞移植(autologous stem cell transplant,ASCT)、蛋白酶体抑制剂(proteasome inhibitors,PIs)、免疫调节药物(immunomodulatory agents,IMiDs)及达雷妥尤单抗(daratumumab,dara)逐渐应用于MM 的治疗,使得患者的预后得到了极大的改善,对于适合行ASCT 的患者其中位生存期可达8年[1]。然而,有部分极高危患者并不能从目前的治疗中获益,其预后仍然很差,总生存期<2年[2]。同时,仅10%~15%的患者能达到预期的生存[3],提示MM 的精准分层及个体化治疗是目前亟需解决的问题。
细胞遗传学异常是影响MM 预后的一大重要因素,随着现代诊疗技术的发展,特别是全基因组学的发展,在分子水平对疾病进行分型,使得骨髓瘤患者的个体化治疗成为可能[4]。目前,针对全基因组的大数据分析主要采用2 种方法:基于芯片技术的基因表达谱分析和基于二代测序技术的转录组测序(RNAsequencing,RNA-seq)分析[5]。基因表达谱分析是在CD138 阳性细胞分选的基础上进行的mRNA 转录组分析。这一分析过程的实现依赖于微阵列技术的应用。微阵列技术于1996年首次用于肿瘤的研究[6],其原理是将特定的DNA 样本(一般是cDNA 或寡核苷酸)密集排列在硅片、玻片等固体支持物上,然后与荧光标记或放射性标记的样本进行杂交,由特定的扫描仪检测杂交信号强度,获取图像信息。细胞的不同周期、疾病的不同阶段和不同的诱导治疗,细胞内基因表达(即mRNA)均不同,而基因表达谱描述的正是不同状态下基因表达的丰度信息。通过生物信息分析判断实验组与对照组之间表达是否存在差异,将某个基因或某几个基因与疾病表型相联系,进一步研制相关靶点药物,开展临床试验。或者分析某组基因集与预后关系,从全基因组层面建立精准的分子分型。本文旨在阐述常见的基于基因表达谱建立的临床预后模型,为MM 分子分型研究进展提供新思路。
1 TC 分型
有50%的MM 存在IgH 易位,最常涉及的5 组染色体位点和基因分别是:11q13(cyclin D1)、4p16(FGFR3/MMSET)、6p21(cyclin D3 )、16q23(cmaf)和20q11(mafB)[7]。Hideshima 等[8]采取基因表达谱分析,根据IgH 易位和cyclin D(CCND)表达情况最先提出了TC(translocation/cyclin D)分型,将MM 分为5 组,见表1。检测的指标较为简单,通过常规的FISH 检测即可对患者做出分型。虽然4p16、16q23 和20q11 并不直接涉及CCND 基因,但其易位与高水平的CCND2 表达有关。同时Bergsagel 等[9]发现有1/3 的MM 在无t(11,14)的情况下也会异常表达CCND1,这可能与肿瘤细胞和骨髓基质的相互作用有关。随后进一步提出TC8 组分型[10],见表2。在对单克隆免疫球蛋白血症(monoclonal gammopathy of undetermined significance,MGUS)样本进行分析时发现CCND 的表达模式与MM 样本高度相似,提示CCND 表达失调可能是起源于MGUS 的早期事件。同时,发现TC8 组分型与临床表型也有着紧密联系,尤其是溶骨性病变。但TC 分型也有其局限性,主要在于过分强调CCND 及IgH 易位带来的遗传学改变,忽视了超二倍体核型在MM 遗传学异常中也占据了相当大的比重。尽管各组均检测到细胞周期蛋白表达失调,但并非在所有组中都存在相关基因的表达失调,因此无法在遗传学层面解释疾病生物学表型与基因表达调控存在的差异。同时在转基因小鼠中发现,B 细胞高表达转基因CCND 并不会干扰正常的B 细胞增殖发育或导致肿瘤[11],故CCND 是否为启动恶性浆细胞疾病的始动因素并未深入研究。研究表明[12],CCND 表达失调几乎是所有肿瘤的一个共同特征,并非MM 所独有,故TC 分型仅在一定程度上预测了患者的预后,而难以解释其分型背后骨髓瘤复杂的生物学机制。
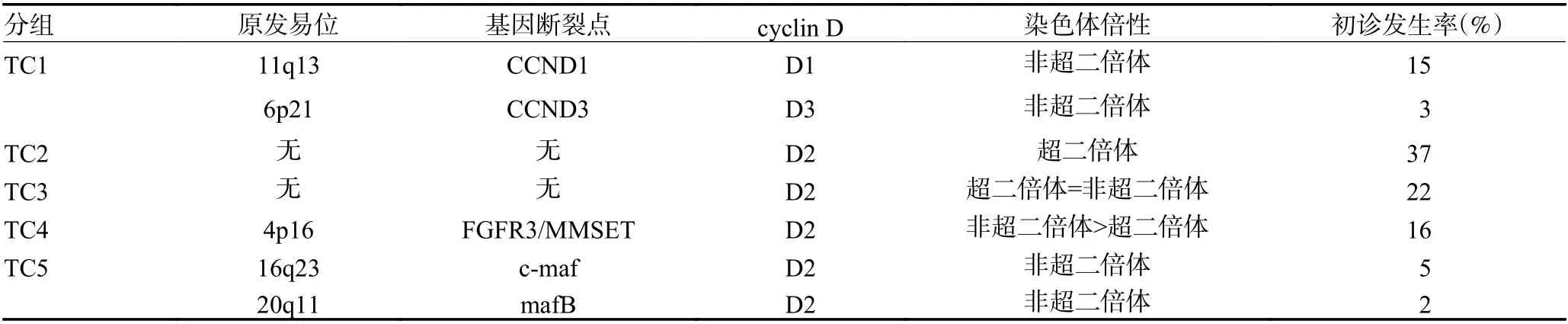
表1 多发性骨髓瘤TC 五组分型

表2 多发性骨髓瘤的TC8 组分型
2 阿肯色大学医学院分型
2006年在美国阿肯色大学医学院(UAMS),Zhan 等[13]通过非监督聚类的方法分析414 例新诊断MM(newly diagnosed MM,NDMM)患者的CD138阳性浆细胞mRNA 表达谱,定义了7 组骨髓瘤分子亚型,即:PR(proliferation)组、LB(low bone)组、MS(MMSET/FGFR3)组、HY(hyperdiploidy)组、CD-1(cyclin D1)组、CD-2(cyclin D2)组及MF(MAF/MAFB)组。其中MF 和PR 为最高风险组,MS 为中等风险组,而CD-1、CD-2、LB 和HY 则为低风险组[14]。根据蛋白质网络分析结果显示MF 亚组为NF-κB、RNA聚合酶Ⅱ、26s 蛋白酶体网络富集的唯一亚组,而NFκB 是沙利度胺发挥治疗作用的重要靶点[15],提示MF亚组可能对沙利度胺治疗敏感。虽然CD-1 和CD-2两组均表达CCND 但后者以CD20 阳性为特征,在治疗反应及疾病进展方面也略有区别,如CD-1 的发病速度最快,完全缓解(complete response,CR)率最高,约为90%。而CD-2 的发病速度最慢,CR 率最低,约为45%[16]。目前,尚未明确这些分子分型的内在生物学机制。
Shaughnessy 等[17]对532 例NDMM 患者的肿瘤细胞进行了微阵列分析,发现有70 个基因与骨髓瘤患者的早期死亡有关,同时将此命名为GEP-70 风险模型,而GEP-70 定义的高危患者中位总生存期(median overall survival,mOS)仅为24 个月。该模型中有30%的基因定位于1 号染色体,大多数上调基因位于1q,而下调基因位于1p。GEP-70 的重要发现是指出1 号染色体相关基因的转录调控可能与疾病进展及临床预后有关,随着近年来对1 号染色体尤其是1q21 扩增的深入研究,发现1q21 上存在多个与肿瘤增殖和耐药相关基因,其表达上调往往提示患者预后较差,如CKS1B、PSMD4 和MCL1 等[18]。梅奥更新的风险分层中更是将gain(1q)纳入高危遗传学因素[1]。近期,Mohan 等[19]对81 例复发难治性MM(relapsed/refractory MM,RRMM)患者进行GEP-70 评分,显示在dara 治疗后GEP-70 高危患者中位无进展生存期(median progression-free survival,mPFS)为0.5年,总生存期(overall survival,OS)为0.9年。提示GEP-70可以用于预测dara 治疗后RRMM 患者的预后。同时,Mohan 等[20]研究还发现,在接受TT5(total therapy 5)临床试验治疗的GEP-70 高危患者骨再矿化的概率显著升高,而骨再矿化则与患者骨骼相关事件(skeletal-related events,SRE)的发生率及生存质量相关。该发现提示在TT5 治疗模式下可以通过GEP-70 分型预知部分患者的骨矿化的发生率,提前采取干预,减少SRE 的发生率,改善患者生存质量。
随着研究深入,Shaughnessy 等[21]在2011年进一步提出了GEP-80 风险模型,选择TT3A、TT3B(total therapy 3A、3B)治疗模式,两种模式均包含硼替佐米在内。患者在给药前、后48 h 分别进行GEP 检测,在TT3A 队列中发现80 个与生存相关的差异表达基因,同样的结论在TT3B 队列中得到验证。但在TT2(total therapy 2)治疗模式下,GEP80 模型并不能在GEP70 高危队列中对患者做出区分。同时2 个模型重叠基因较少,仅3 个基因,其中较为有意义的基因为PSMD4,位于染色体1q21 上,对拷贝数高度敏感,其表达水平的增加与临床治疗效果较差有关。研究发现,PSMD4 能抑制内质网应激诱导的细胞凋亡,提示PSMD4 在肿瘤演变过程具有重要作用[22]。
3 IFM-15
2008年,法国骨髓瘤工作组(the Intergroupe Francophone du Mye'lome,IFM)通过单通道cDNA微阵列技术得到250 例新诊断患者的基因表达谱,使用监督聚类方法筛选出15 个与生存相关基因,建立IFM-15 风险评分[23]。其中高危组以细胞周期相关基因过表达为特点,低危组以超二倍体为特点。研究者认为由于高危组细胞周期检查点活性被干扰,使骨髓瘤细胞维持轻度的染色体不稳定性,进而促进了肿瘤的发生和耐药,为骨髓瘤耐药的研究提供新的思路。近期提出了骨髓瘤干细胞(MM stem-like cells,MMSCs)的概念,认为MMSCs 是一种罕见的骨髓瘤细胞,具有耐药性和自行更新能力,被认为可导致骨髓瘤复发[24]。有研究分析MMSCs 基因表达谱,选择5 个基因即ROCK1、GSK3B、BRAF、MAPK1 和MAPK14 构建骨髓瘤侧群细胞(MM side population 5,MMSP5)预后模型,同时发现在复发患者中这些基因表达水平显著升高[25]。对于IFM-15低危患者3年OS率为90.5%,而高危患者则为47.4%。但是,IFM-15 模型在UAMS 的TT2(P=0.26)、TT3(P=0.97)治疗模式下均不能识别出疾病早期死亡的患者。而UAMS-17 模型可以识别出注册在IFM 试验中的高危患者。由此可见,在预测预后方面IFM-15 稍逊色于UAMS 模型。
4 EMC-92
Kuiper 等[26]使用注册在HOVON65/GMMGHD4 试验中290 例NDMM 患者的GEP 作为训练集,通过监督聚类方法构建EMC-92 基因模型。并在在TT2、TT3、MRC-IX 和APEX 数据集中进行验证。结果显示,EMC-92 均可以识别出高危患者。其中MRC-IX、TT2 数据集中包括以沙利度胺为基础治疗的患者,APEX、TT3 数据集中包括以硼替佐米为基础治疗的患者,同时APEX 还纳入RRMM 患者。提示EMC-92 不受治疗方案干扰,在不同治疗模式和疾病不同状态下均显示出强大的独立预测能力。相比IFM-15 在独立数据集,如MRC-IX 和TT3,却并没有显示出独立预测的能力。随后研究者将GEP 分型与ISS 分期相结合,构成EMC-92+ISS 预后模型。最高危组预后最差,mOS 为24 个月。EMC-92 分型纳入多个独立数据集,建立了复杂全面的预后模型,使得其显著优于其他分子分型。最近有报道显示,GEP 比FISH 识别出更多高危患者,同时还能识别出早期复发的高危患者[27]。
5 其他分型
5.1 IMiD-14 评分
IMiDs 为治疗MM 的一线用药[28],然而不同个体对药物反应有所不同。对此,Bhutani 等[29]提出IMiD-14 评分模型,该模型通过采集使用IMiDs 前后患者的GEP,筛选出14 个与患者无进展生存期(progression-free survival,PFS)高度相关的基因,结合这14 个基因,建立IMiD-14 评分。评分高于截止值(cutoff 值)的亚组被认为对IMiDs 耐药。在训练集中IMiD-14 high 组的3年PFS 率为52%,而IMiD-14 low 组为85%。IMiD-14 模型在TT3a、TT3b、TT6 和HOVON65/GMMG-HD4 临床试验的VAD 组中进行验证,得到同样的结论。值得注意的是,在训练集中的患者还接受了除IMiDs 以外的其他抗骨髓瘤药物,如地塞米松、阿霉素和高剂量马法兰。因此,难以精准地区分出单个药物的作用。
5.2 MCL-1 共表达模型
Samo 等[30]根据MCL1-M 内基因集的表达水平分为MCL1-M 高危组和MCL1-M 低危组。将该分型用于不同治疗方案下的患者,发现MCL1-M 可以预测患者对硼替佐米治疗的反应。在GSE19784 数据集中分析两组患者预后,结果显示高危组OS 显著低于低危组。在高危组内进一步比较VAD(长春新碱、阿霉素和地塞米松)方案和 PAD(硼替佐米、阿霉素和地塞米松)方案,显示含硼替佐米的方案显著提高了高危组患者的PFS(mPFS 19 个月vs.27 个月;HR=1.58;P=0.02),而在低危组中,PAD 和VAD 治疗方案的PFS 与OS 并无显著性差异。上述研究结果均提示高危组患者虽然预后相对较差,但可以从PAD 治疗方案中获益,而低危组患者在保证治疗效果不变的情况下面临更多治疗方案的选择。目前,已有研究表明硼替佐米与MCL-1 抑制剂分别间接和直接地抑制了MCL-1 表达,发挥抗骨髓瘤效应[31]。但由于缺乏大量临床样本,MCL1-M 对硼替佐米治疗反应的预测是否可以用于其他治疗模式下患者的生存,还有待进一步验证。
6 结语与展望
MM 作为一种异质性较强的疾病,不应采用单一的治疗模式,个体化治疗已成为目前的研究热点。而这一过程依赖于对MM 患者进行精准分层,并提出具有治疗指导意义的分层管理。GEP 技术的发展为寻找MM 潜在的致病基因和预测耐药性提供了平台。但GEP 在临床实际应用方面仍然面临巨大挑战。虽然已有多个临床预后模型,但各个模型之间重叠基因较少,并且缺乏统一的共识,是否可以将其普遍用于所有患者还亟需验证。且多数GEP 数据是在特定治疗背景,以及疾病的某个进程中产生,缺乏含有完整风险指标及临床参数的GEP 数据,但多个数据库的整合以及交叉验证,可以在一定程度上弥补此项不足。随着计算机算法的逐步精进以及精准医疗的飞速发展,相信在未来骨髓瘤的分子分层领域,GEP 可以成为强有力的工具。

