氢气对AGEs诱导人视网膜微血管内皮细胞凋亡及AKT/eNOS/NO通路的影响
冯梅 张娟 佘春燕 张青松
人视网膜微血管病变是多种代谢性疾病和心血管疾病的并发症,如糖尿病、高血压、白血病等都可引起视网膜微血管发生病变。以机体内大分子物质为原料,通过非酶促反应生成的稳定共价键产物-糖基化终末产物(advanced glycation end products, AGEs)是损伤视网膜微血管的重要因素之一。AGEs能够刺激内皮细胞氧化应激反应,使细胞发生凋亡,进而导致内皮屏障功能发生障碍[1,2]。一氧化氮(nitric oxide, NO)是重要的舒血管因子,当视网膜微血管内皮细胞受到一系列损伤时,其NO释放量会减少,血管平衡稳态被打破[3]。蛋白激酶/内皮型一氧化氮合酶(protein kinase/endothelial nitric oxide synthase, AKT/eNOS)通路的活化可以促进NO的释放,从而降低血管内皮细胞的损伤和凋亡[4,5]研究报道,氢气(hydrogen,H2)在机体中具有一定的生理作用,可作为抗氧化剂降低机体氧化应激反应[6]。多个研究表明,大鼠脑缺血动物模型吸入氢气后通过抗氧化作用可以减轻再灌注损伤和炎性病变[7,8]。目前关于氢气对AGEs诱导人视网膜微血管内皮细胞凋亡及AKT/eNOS通路的影响并不十分清晰,我们围绕此课题展开研究,揭示了氢气在抗视网膜微血管内皮细胞凋亡中的部分机制。
资料与方法
一、主要试剂与仪器
实验研究。人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,hRMECs)购自上海泽叶生物科技有限公司;AGE-BSA购自美国Biovision公司;二甲基亚砜(Dimethyl sulfoxide, DMSO)、胎牛血清(fetal bovine serum, FBS)、DMEM培养基、链霉素和青霉素均购自美国Gibco公司;细胞培养板购自赛默飞世尔科技(中国)有限公司;0.2%胰蛋白酶溶液购自武汉普诺赛生命科技有限公司;噻唑蓝(MTT)、蛋白浓度测定试剂盒和蛋白提取试剂盒均购自北京索莱宝科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国BD公司;NO检测试剂盒购自上海碧云天生物技术有限公司;AKT抗体、eNOS抗体、p-AKT抗体和p-eNOS抗体均购自TaKaRa公司。
超净工作台购自江苏苏净集团安泰公司;CO2恒温细胞培养箱购自德国Heraeus公司;高速低温离心机购自SIGMA公司;Facscalibur流式细胞仪购自美国BD公司;电泳仪、凝胶成像仪、分光光度仪均购自Bio-Rad公司。
二、方法
1.HRM制备及实验分组:将H2在0.4 MPa高气压下溶解于细胞培养基中,现配现用并过滤消毒,富氢培养基的有效浓度为0.06 mmol[9]。
将hRMECs随机分为4组,每组各设置5个平行对照:(1)正常组:正常培养hRMECs 24 h,不加干预;(2)AGEs组:向hRMECs中加入200 μg/ml的AGE-BSA[10],37 ℃、5%CO2条件下培养24 h;(3)HRM组:用HRM培养基培养hRMECs 24 h,不另加干预;(4)HRM+AGEs组:向hRMECs中加入200 μg/ml的AGE-BSA和HRM培养基,37 ℃、5%CO2条件下培养24 h。
2.MTT法检测hRMECs活力:将hRMECs以1×104个/ml的密度接种于96孔板中,每孔200 μl,培养24 h使细胞融合度达到90%左右时进行后续实验。按照hRMECs的分组进行干预和培养后,每孔加入20 μl MTT(5 mg/ml)溶液,37 ℃孵育4 h,弃去培养基,每孔加入150 μl DMSO,避光并用振荡器混匀,酶标仪测定每孔细胞的570 nm吸光度(A)值。细胞活性(%)=(A1~4组-A空白组)/(A1组-A空白组)×100%,空白组为150 μl的细胞培养基,用以排除培养板和培养基本底吸光值对实验的影响。
3.流式细胞术检测hRMECs凋亡:配制密度为1×106个/ml的hRMECs单细胞悬液,2 ml/孔接种于6孔板中,细胞培养箱中培养24 h。按照hRMECs的分组对细胞进行干预和培养后,弃去上层培养基并加入胰蛋白酶对细胞进行消化,加入新的培养基终止消化后,4 ℃、1500 r/min离心10 min收集细胞,无菌磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤细胞2次,随后用Annexin V-FITC/PI细胞凋亡检测试剂盒中的缓冲液将细胞重悬,再次调整细胞密度为1×106个/ml。取各组100 μl重悬后的细胞分别加入流式管中,做好分组标记,再向流式管中加入5 μl Annexin V-FITC抗体和5μl Annexin V-PI抗体,快速混合均匀后避光孵育15 min,加入400 μl缓冲液混匀后上样流式细胞仪,分析细胞凋亡情况,全程冰上操作。
4.比色法hRMECs中Caspase-3和Caspase-9活性:将hRMECs以1×106个/ml的密度接种于细胞培养瓶中,按照hRMECs的分组进行处理和培养。加入胰蛋白酶对细胞进行消化,1500 r/min离心10 min,弃去培养基,用无菌PBS洗涤1次,收集细胞并加入细胞裂解液作用15 min,4 ℃低温10000 r/min离心10 min。按照试剂盒说明书,取离心后上清液进行Caspase-3和Caspase-9活性测定,通过酶标仪测定405 nm吸光度(A)值。
5.检测hRMECs的NO含量:将hRMECs以1×106个/ml的密度接种于6孔板中,每孔2 ml,培养箱中培养24 h使其形成单细胞层。按照hRMECs的分组对细胞进行干预和培养,弃去旧培养基并加入胰蛋白酶消化细胞,终止消化后离心,无菌PBS洗涤细胞2次,离心收集细胞再加入细胞裂解液,4 ℃低温10000 r/min离心10 min。按照试剂盒说明书,取离心后上清液进行检测,酶标仪测定各组540 nm吸光度,根据标准曲线计算出各组NO的含量。
6.蛋白质印迹法(Western-Blot, WB)检测hRMECs的AKT、eNOS、p-AKT及p-eNOS蛋白水平:hRMECs接种同比色法hRMECs中Caspase-3和Caspase-9活性测定,再按照hRMECs的分组对细胞进行干预和培养。弃去培养基,用胰蛋白酶消化细胞,培养基终止消化,1500 r/min离心10 min收集细胞,用无菌PBS洗涤细胞2次,1500 r/min、10 min再次离心并弃上清,加入细胞裂解液,低温10000 r/min离心10 min,按照试剂盒说明书提取细胞总蛋白。蛋白定量后进行SDS-PAGE电泳,小心取出凝胶并使用电转仪进行PVDF转膜,在室温下用5%脱脂奶封闭1h,加入稀释(1:1000)后的对应一抗,4 ℃摇床孵育过夜,弃去一抗溶液并洗涤PVDF膜,加入稀释(1:2000)后的二抗溶液,室温摇床1 h,洗膜3次,ECL显色并用凝胶成像系统拍照。
三、统计学分析方法
利用SPSS 19.0软件进行统计学分析,方差齐性采用one way ANOVA检验,组间两两比较采用SNK-q检验,方差不齐采用one way ANOVA中Welch修正值,组间两两比较采用tamhane's T2值,以P<0.05表示差异有统计学意义。
结 果
一、H2对AGEs诱导hRMECs活力的影响
从结果中可以看出,相较于正常组和HRM组,AGEs组和HRM+AGEs组的细胞活力显著降低(P<0.05);相较于AGEs组,HRM+AGEs组的细胞活力显著升高(P<0.05),各组细胞活性数据见表1。
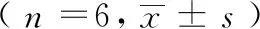
表1 H2对AGEs诱导hRMECs活力的影响
二、H2对AGEs诱导hRMECs凋亡的影响
结果显示,AGEs组和HRM+AGEs组的细胞凋亡率相比于正常组和HRM组显著升高(P<0.05);HRM+AGEs组的细胞凋亡率相比于AGEs组显著降低(P<0.05),结果见表2、图1。
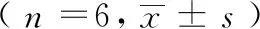
表2 H2对AGEs诱导hRMECs凋亡的影响
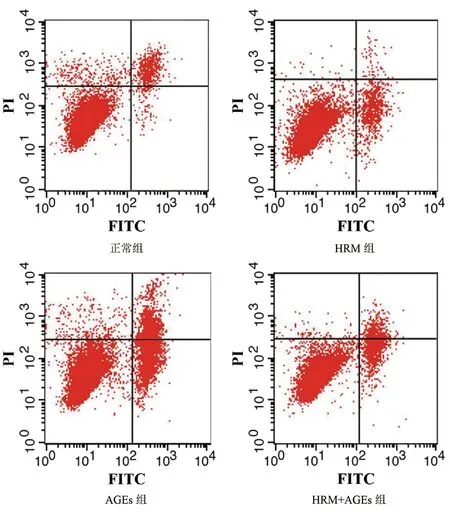
图1 各组hRMECs细胞凋亡情况
三、H2对AGEs诱导hRMECs凋亡相关蛋白水平的影响
由结果可知,与正常组和HRM组相比,AGEs组和HRM+AGEs组的Caspase-3和Caspase-9活性明显升高(P<0.05);与AGEs组相比,HRM+AGEs组的Caspase-3和Caspase-9活性明显降低(P<0.05),实验结果见表3。
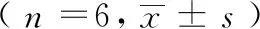
表3 H2对AGEs诱导hRMECs的Caspase-3和Caspase-9活性的影响
四、H2对AGEs诱导hRMECs的NO含量的影响
结果显示,AGEs组和HRM+AGEs组的细胞NO含量相比于正常组和HRM组明显降低(P<0.05);HRM+AGEs组的细胞NO含量相比于AGEs组明显升高(P<0.05),结果见表4。
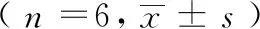
表4 H2对AGEs诱导hRMECs的NO含量的影响
五、H2对AGEs诱导hRMECs的AKT、p-AKT、eNOS及p-eNOS蛋白水平的影响
从结果中可以看出,与正常组相比,HRM组、AGEs组和HRM+AGEs组的细胞AKT和eNOS蛋白水平无明显差异(P>0.05);但各组磷酸化信号蛋白p-eNOS和p-AKT水平明显改变:与正常组和HRM组相比,AGEs组和HRM+AGEs组细胞的p-eNOS/eNOS和p-AKT/AKT比值显著降低(P<0.05);与AGEs组相比,HRM+AGEs组细胞的p-eNOS/eNOS和p-AKT/AKT比值显著升高(P<0.05),见表5、图2。

图2 H2对AGEs诱导hRMECs的AKT、p-AKT、eNOS及p-eNOS蛋白水平的影响
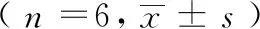
表5 各组hRMECs中p-AKT/AKT、p-eNOS/eNOS水平
讨 论
视网膜病变可由多种代谢性疾病引发,以糖尿病为例:患者体内的胰岛素代谢异常致使血液成分发生改变,高血糖的环境会使AGEs不断产生并积累,引起视网膜微血管内皮细胞的损伤和功能异常,随着病情的发展,表现为糖尿病性视网膜病变[11,12]。视网膜微血管发生病变会导致视力下降、眼底出血,甚至视网膜脱离造成失明[13]。因此,探究AGEs诱导视网膜微血管内皮细胞损伤的机制对于防治血管病变具有重要的临床意义。
目前,研究者们对氢气在多种疾病治疗中发挥的抗氧化能力、抗炎症能力和抗凋亡能力等方面进行了研究。Zhang等[14]发现,哮喘小鼠模型吸入氢气后,可通过抑制炎症介质和抗氧化失衡来减轻气道炎症和改善肺功能。除了氢气吸入治疗,富含氢的溶液也具有抗氧化应激保护细胞的作用[15]。王卫娜等[16]研究显示,富含氢的培养基能显著抵抗脂多糖导致的内皮细胞损伤。本研究构建人视网膜微血管内皮细胞AGEs损伤模型并设置富氢培养基干预组,结果显示相较于正常组和HRM组,AGEs组和HRM+AGEs组细胞活力降低,凋亡率升高,凋亡相关蛋白Caspase-3和Caspase-9活性升高;与AGEs组相比,HRM+AGEs组细胞活力升高,细胞凋亡率下降,凋亡相关蛋白Caspase-3和Caspase-9活性降低。表明H2在人视网膜微血管内皮细胞中对AGEs导致的凋亡具有抑制作用。
多个研究发现,不同药物在对AGEs诱导血管内皮细胞凋亡的抑制过程中涉及到AKT/eNOS信号通路的激活,细胞内活化的AKT与eNOS结合定位于细胞膜,并使eNOS磷酸化,活化的eNOS催化产生NO,用于保护细胞[17-19]。NO是维持血管正常张力所不可缺少的,它可与血管平滑肌细胞内的相应受体结合,引起血管平滑肌松弛,使血管扩张[20]。在糖尿病患者体内,血糖持续升高会使eNOS活性降低,NO的产生也随之减少,使得血管舒张功能紊乱,造成血液局部流速降低,导致内皮细胞凋亡。为探究H2在AGEs导致的人视网膜微血管内皮细胞的凋亡中发挥抑制作用是否与AKT/eNOS信号通路相关,本研究检测了各实验组细胞的NO含量以及AKT、eNOS、p-AKT和p-eNOS蛋白表达水平,结果显示AGEs组和HRM+AGEs组与正常组和HRM组相比,细胞的p-eNOS/eNOS和p-AKT/AKT水平显著降低,NO含量降低;HRM+AGEs组与AGEs组相比,细胞的p-eNOS/eNOS和p-AKT/AKT水平显著升高,NO含量升高。该结果表明,H2可激活AKT/eNOS信号通路,通过促进AKT和eNOS磷酸化,上调NO的释放量,从而抑制人视网膜微血管内皮细胞的凋亡。
综上所述,氢气对AGEs诱导的人视网膜微血管内皮细胞的凋亡具有抑制作用,该作用可能通过激活AKT/eNOS/NO通路得以发挥。本研究初步探讨了氢气对AGEs诱导人视网膜微血管内皮细胞损伤的作用及机制,为防治血管病变相关研究提供一定方向和实验基础,但其中涉及的具体机制以及应用氢气的临床安全性还有待于更深一步的研究和更多的临床实验来验证。

