基于重组酶介导扩增-侧流层析试纸条的褐飞虱快速鉴定方法
罗举 唐健 王爱英 杨保军 刘淑华
基于重组酶介导扩增-侧流层析试纸条的褐飞虱快速鉴定方法
罗举 唐健 王爱英 杨保军 刘淑华*
(中国水稻研究所水稻生物学国家重点实验室,杭州310006;*通信联系人,E-mail: liushuhua@caas.cn)
【】针对测报灯下褐飞虱鉴定费时费力这一问题,建立褐飞虱快速定性鉴定技术。以褐飞虱、伪褐飞虱及拟褐飞虱为材料,筛选褐飞虱特异性引物对,优化基于重组酶介导扩增和侧流层析试纸条检测方法的快速鉴定体系(RAA-LFD),并分析其温度及模板鲁棒性。本研究建立的RAA-LFD方法操作简单、速度快、不依赖于任何精密仪器、体温可触发扩增反应,且对粗组织液模板具有很好的鲁棒性。盲样检测结果表明,56个样本从样本获取到结果输出的整个过程可在45 min内完成,准确率可达100%。本研究建立的褐飞虱RAA-LFD鉴定技术可以用于褐飞虱及其近似种的快速区分,适用于基层植保站或田间地头对样本的现场即时检测。
褐飞虱;伪褐飞虱;拟褐飞虱;RAA-LFD;现场即时检测
褐飞虱[(Stål)]是亚洲稻区危害最严重的水稻害虫之一,不仅可以刺吸汁液为害,还可以传播病毒病[1-4]。准确的虫情预测预报是害虫防治的关键,褐飞虱测报主要依赖于人工下田调查和地面灯诱捕监测。人工下田调查存在劳动强度大、效率低、时效性差、主观性强等缺点。随着基层植保工作人员的流失,地面灯诱监测受到了植保站及种粮大户的青睐。测报灯下褐飞虱的始见日、迁入量、迁入峰是预测预报的关键依据,也是褐飞虱防治策略制定的关键信息依据。目前市场上的智慧型测报灯,可实现自动收集、烘干、传输、识别与计数,大大提高了测报的准确度和时效性,节省了人力物力。然而,所有的基于RGB图像识别原理的智慧型测报灯对昆虫同属近似种的分类鉴定无能为力,后期仍需大量人力介入。
伪褐飞虱[China]和拟褐飞虱[(Muir)]是褐飞虱的同属近似种,属于半翅目(Hemiptera)飞虱科(Delphacidae)褐飞虱属(Distant)。伪褐飞虱和拟褐飞虱并不取食水稻,而是以禾本科的游草()和秕谷草()为最适宜寄主[5]。在人为干预下,两者虽可在水稻上完成世代发育,但种群趋势指数分别为0.2和0.02,不能持续繁衍[5]。然而,伪褐飞虱、拟褐飞虱与褐飞虱具有广泛的共同分布区域,发生季节也有交叉(4月-10月),且都具有扑灯习性,对预测预报的准确性造成了严重影响[6, 7]。褐飞虱、伪褐飞虱和拟褐飞虱形态、体色和外部特征均非常相似,肉眼难以区分,需专业人员借助于显微镜才能鉴别[8]。显微镜下的分类特征主要有3个方面,分别为颜面、雌性外生殖器和雄性外生殖器[9]。人工进行褐飞虱属近似种鉴定耗时费力,对人员专业技能要求高,且不能鉴别残缺的飞虱个体。因此,亟需研发快速、简便、准确的分类鉴定方法。
基于聚合酶链式反应(Polymerase Chain Reaction, PCR)技术的核酸检测为物种的鉴定提供了新的手段,弥补了传统形态学鉴定的诸多不足,可以检测物种间及同种个体间的细微差别。崔亚丽[10]曾利用核糖体间隔区基因(Ribosomal intergenic spacer, ITS)设计引物,初步建立了褐飞虱、拟褐飞虱和伪褐飞虱的多重PCR检测技术(需PCR仪+电泳仪),由于是以纯基因组DNA为模板,具有耗时长、耗费大等缺点。Liu等[11]在此基础上,重新设计引物对,以加水研磨的粗组织液为模板建立了三种飞虱的直接多重PCR检测方法,该方法不需要提取DNA,将检测时间大大缩短。这两种方法虽然都能准确鉴定褐飞虱,但都依赖于昂贵的仪器设备(PCR仪、电泳仪、凝胶成像仪),不易推广应用。重组酶聚合酶扩增技术(Recombinase Polymerase Amplification, RPA)是Piepenburg等[12]于2006年提出的一种新型的恒温核酸扩增技术,无需昂贵精密的仪器,在37℃~42℃恒温下即可完成指数级扩增,与侧流层析试纸条(lateral flow dipstick, LFD)结合应用能实现裸眼可视化检测,非常适用于临床以及室外的检测与分析。重组酶介导的扩增(Recomninase Aided Amplification, RAA)技术与RPA扩增原理相似,是国内公司开发的一种技术,两者的区别在于重组酶的来源不同,RPA重组酶来源于T4噬菌体,RAA重组酶来源于细菌或真菌[13]。近几年,RAA技术也逐渐被大众所认知和应用[14-16]。
本研究通过筛选常见的条形码基因,建立了以线粒体细胞色素b基因(Mitochondrial cytochrome b,)为检测靶标的褐飞虱RAA+LFD快速鉴定方法,评价了其特异性与灵敏度,分析了其温度适用范围与模板质量鲁棒性,并对随机盲样进行了检测体系效果评估。该方法简单、快速、灵敏,将很大程度上减轻植保工作人员工作量,提高褐飞虱预测预报工作的准确度及时效性,为精准绿色防控提供技术支撑。
1 材料与方法
1.1 样本准备
本实验室收集保存的2017-2018年度广西昭平、湖南邵东、江西万安和浙江富阳的褐飞虱、拟褐飞虱和伪褐飞虱干虫样本。粗组织液制备方法:取单头待测飞虱放入1.5 mL离心管中,加入200 μL ddH2O,手动研磨或自动研磨机研磨,自动研磨机的参数为8 HZ×60 s。
1.2 仪器设备与试剂
研磨机(LC-TG-48,上海力辰邦西仪器科技有限公司);恒温金属浴;凝胶电泳仪(DYCP-31DN,中国六一公司);凝胶成像系统(V140130,美国Bio-Rad公司);酶试剂盒(KME-101,日本TOYOBO公司);电泳法RAA扩增试剂盒(RAA-basic)(B00000,江苏奇天基因公司);试纸条法RAA扩增试剂盒(RAA-nfo)(T00001,江苏奇天基因公司);试纸条法RPA扩增试剂盒(RPA-nfo) (TANFO02kit,英国TwistDx公司);LFD试纸条(MGHD 1,德国Milenia Biotec公司)。
1.3 引物探针设计与筛选
根据NCBI中登录的褐飞虱(JX880069.1)、伪褐飞虱(NC_024627.1)和拟褐飞虱(NC_033388.1)的线粒体基因组序列,参照文献寻找并提取COI及Cytb基因序列[17],使用Vector NTI 11.5.1软件进行序列比对,在种间变异区及种内保守区设计RPA/RAA引物及探针。参考Liu等[11]报道的ITS序列以同样的方法设计引物和探针。因为RPA技术还没有成熟的引物设计辅助软件,本研究中引物和探针主要是参照英国TwistDx公司网站(http://www.twistdx. co.uk)的注意事项进行人工设计。本研究所用的引物及探针序列见表1,均由生工生物工程(上海)股份有限公司合成。RPA引物设计原则为:引物长度30~35 bp;避免5'端长的G序列,否则会影响重组酶与引物结合;推荐3'端用G、C序列;自由能应<4 kcal /mol。以褐飞虱基因组DNA(10 ng /μL)为模板,参照电泳法RAA试剂盒(RAA-basic)说明书的体系及方法进行检测。具体如下:ddH2O 17.5 μL、正向引物(10 μmol/L)2.0 μL、反向引物(10 μmol/L)2.0 μL、不含引物的水化缓冲液(Primer Free Rehydration buffer )25.0 μL、DNA 1 μL,最后加入乙酸镁2.5 μL触发扩增反应。反应条件:37℃下恒温扩增30 min。反应结束后,加入等体积的苯酚/氯仿混合液(1∶1),剧烈涡旋混匀后12000 r/min下离心3 min,取上清液进行电泳检测。
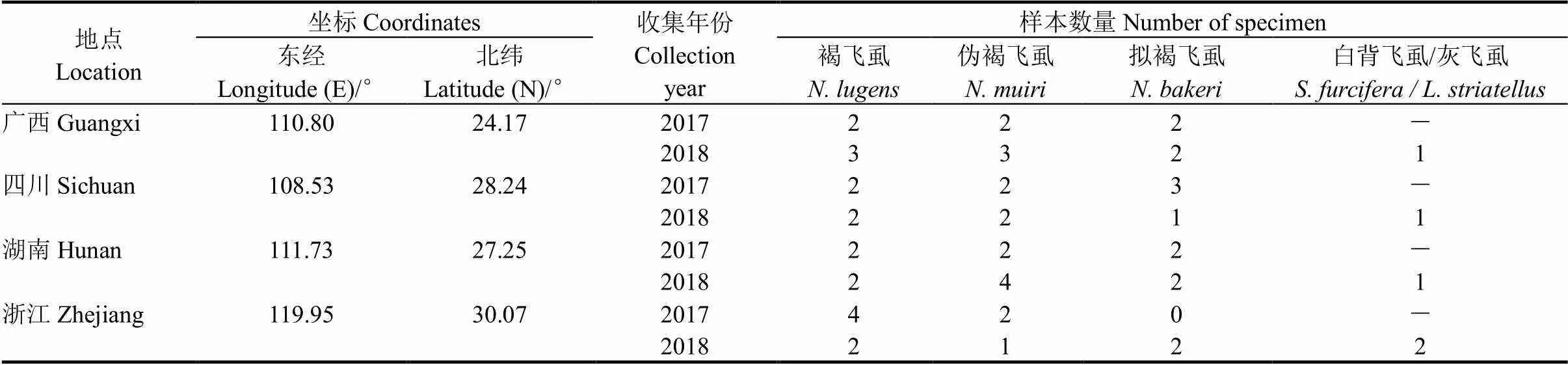
表2 样本收集地点
筛选出引物对后,设计RAA探针,设计原则为:长46~52 bp;在距5'端最短30 bp,距3'端最短15 bp处碱基由四氢呋喃(THF)替代;5'端标记FAM荧光基团。另外,需重新合成有生物素标记的下游引物,以用于后续基于三明治法原理的侧向流试纸条检测[18]。以褐飞虱基因组DNA(10 ng /μL)为模板,参照RAA-nfo试剂盒说明书的体系及方法进行检测。具体如下:ddH2O 16.7 μL、正向引物(10 μmol/L)2.1 μL、反向引物(10 μmol/L)2.1 μL、探针(10 μmol/L)0.6μL、不含引物的水化缓冲液(Primer Free Rehydration buffer )25.0 μL、DNA 1 μL,最后加入乙酸镁2.5 μL触发扩增反应。反应条件:39℃恒温扩增20 min。反应结束后,取2.5 μL反应液与97.5 μL试纸条扩展缓冲液(Milenia GenLine Dipstick Aassay Buffer)混合,再将试纸条垂直放置于此混合液中,室温放置2 min后观察结果。剩余的反应液亦可参照上述方法进行电泳检测。RPA-nfo试剂盒加样体系及反应条件与RAA-nfo试剂盒大致相同。
1.4 特异性检测
分别以褐飞虱、伪褐飞虱、拟褐飞虱的基因组DNA(10 ng /μL)为模板,参照1.3的体系及方法进行RAA扩增,并用电泳法和试纸条法检测以评价反应体系的特异性。
1.5 灵敏度测定
将褐飞虱基因组DNA 10×梯度稀释为100 fg/μL、1 pg/μL、10 pg/μL、100 pg/μL、1 ng/μL,在39℃×20 min扩增条件下评价所建立RAA-LFD反应体系的灵敏度。
1.6 检测条件适用范围分析
分别以33℃、35℃、37℃、39℃和41℃为反应条件,以褐飞虱基因组DNA(50 ng/µL)和粗组织液为模板,评价所建立RAA-LFD方法的适用温度范围及模板鲁棒性,并分析了体温触发扩增的可行性。在39℃下,以褐飞虱粗组织研磨液为模板,分别扩增4 min、8 min、12 min及16 min,在保证检出率的情况下评价所建立RAA-LFD方法的最短扩增时长。
1.7 盲样测试评价
使用优化的RAA-LFD方法对取自2017与2018年度不同地区的褐飞虱及其他飞虱共56个样本(表2)进行测试,并与专家形态学鉴定结果比较,验证方法的准确度及实用价值。另外,粗略对比评估了RPA-nfo与RAA-nfo试剂的扩增活性。

A-RAA-LFD扩增引物筛选;B-RAA-LFD检测探针验证。+代表褐飞虱基因组DNA;-代表ddH2O。
Fig. 1. Primer and probe selection for RAA-LFD method.

Nl-褐飞虱;Nm-伪褐飞虱;Nb-拟褐飞虱。粗字体序列代表P4引物位置,下划线序列代表探针位置。
Fig. 2. Multiple alignment ofgenes fromand its two sibling species.
2 结果与分析
2.1 引物与探针的确定
根据RAA引物设计原则,针对褐飞虱ITS1、COI及Cytb条形码基因保守区段共设计了4组引物(表1),分别为P1~P4。以RAA-basic试剂盒进行引物筛选,结果表明(图1-A),4组引物都能扩增出单一特异条带,但P1/P2/P3的空白对照杂带较亮,因此选定P4引物对进行后续验证。参照探针设计原则,人工设计了试纸条法检测用探针,同时重新合成带有生物素标记的P4下游引物Cytb-326-R30-Bio(表1)。在39℃×20 min扩增条件下,基于P4引物对的RAA-LFD法可以出现明显的检测线(图1-B),说明探针设计正确。P4引物对与三种飞虱的基因序列多序列比对结果及引物探针位置如图2。

Nl-褐飞虱;Nm-伪褐飞虱;Nb-拟褐飞虱;F-雌成虫;M-雄成虫。
Nl,; Nm,; Nb,; F, Female adult; M, Male adult.
图3 基于P4引物对的RAA-LFD方法特异性分析结果
Fig. 3. Specificity analysis of the RAA-LFD method based on P4 primer.
2.2 RAA-LFD法检测特异性的确定
因为本研究目的是筛选近似种快速鉴定定性引物,所以首先验证了P4引物对的特异性。以褐飞虱、伪褐飞虱及拟褐飞虱的基因组DNA为模板(10 ng/µL),RAA-LFD试剂在39℃×20 min扩增条件下,褐飞虱雌、雄虫都有明显检测线与质控线,伪褐飞虱和拟褐飞虱都只有质控线(图3)。以上结果表明,P4引物对具有物种特异性,可以很好地区分褐飞虱及其近似种。
2.3 RAA-LFD法检测灵敏度的分析
在39℃×20 min扩增条件下,以10×稀释的褐飞虱基因组DNA为模板测定P4引物对的灵敏度。结果表明,当模板浓度为10 pg/µL时试纸条上可见明显的检测线,且模板浓度越高,检测带颜色越深(图4),说明所建立的RAA-LFD法最低检测线为10 pg/µL。因为本研究的目的是筛选快速简便的定性鉴定引物,所以对其灵敏度要求不高,10 pg/µL的检测灵敏度足可满足物种鉴定要求。
2.4 RAA-LFD法检测条件范围的确定
本研究目的是建立可用于实验室外的、简单快速的定性鉴定技术,因此评估了所建立RAA-LFD方法的适用范围,包括扩增温度、模板质量和扩增时长。以基因组DNA(50 ng/µL)为模板,测定了RAA-LFD法在不同温度下的检测能力,包括33℃、35℃、37℃、39℃和41℃。温度范围筛选结果表明,基于P4引物对建立的RAA -LFD法在33~41℃都具有较好的检测效果(图5-A)。不借助任何加热模块,本实验室两名工作人员通过将PCR管握在手心20 min,亦可高效完成扩增与准确检测。为了提高检测效率,以褐飞虱粗组织液(2017年雄成虫样本)为模板测定了RAA-LFD法在39℃下扩增4 min、8 min、12 min及16 min后的检测效果。扩增时长实验表明,RAA -LFD试剂在扩增4 min时有模糊检测线,8 min时检测线即清晰可见(图5-B)。

图4 基于P4引物对的RAA-LFD方法灵敏度实验结果
Fig. 4. Sensitivity analysis of the RAA-LFD method based on P4 primer.
2.5 盲样测试评价结果
为评估该RAA-LFD检测体系的实际应用效果,对取自2017、2018年度4个不同省份的共56个飞虱盲样进行检测(表2)。结果表明,其中19个样本检测为褐飞虱,37个样本为非褐飞虱,与人工鉴定结果完全一致,检出率与准确率均达到100%。本研究中,利用高通量组织研磨仪制备样本粗组织液1~2 min,39℃下恒温扩增8 min,试纸条检测2 min,单样本从样本获取到结果输出的整个过程可在20 min内完成,56个样本可在45 min内完成。为了筛选更优的试剂,本研究粗略对比了国产RAA-nfo试剂与进口RPA-nfo试剂的扩增活性。结果表明,在相同的扩增温度与时长下,RAA-nfo试剂扩增活性略低于RPA-nfo试剂。采用RPA-LFD法,单样本检测时间可在15 min内完成,56个样本可在40 min内完成,部分对比结果见图6。
3 讨论
本研究以条形码基因为遗传标记,建立了基于恒低温核酸扩增及可视化检测的褐飞虱快速鉴定方法,即RAA-LFD法(重组酶聚合酶扩增-侧流层析试纸条法)。该方法在33~41℃温度范围内对褐飞虱都有很好的检测效果,且可以脱离加热模块由体温触发扩增;具有较好的模板鲁棒性,可高效扩增样本粗组织液;检测迅速,56个样本可在45 min内完成;大样本盲样检测结果表明,该方法对褐飞虱的检出率及准确率均为100%;最低检测限为10 pg/µL。该检测方法特异性强、灵敏度高、易操作、反应快速,能摆脱对大型专业仪器、专业操作人员及实验室的依赖,在基层植保站或种粮大户,尤其在野外及现场检测中具有应用潜力。

A-扩增温度分析;B-扩增时长分析。Nl-褐飞虱,Nm-伪褐飞虱,Nb-拟褐飞虱。
Fig. 5. Applicability analysis of the RAA-LFD method based on P4 primer.

Nl-褐飞虱;Nm-伪褐飞虱;Nb-拟褐飞虱。
Fig. 6. Amplification ability analysis between RPA-nfo and RAA-nfo reagents.
近年来,恒温PCR法在现场即时检测(Point of Care Testing, POCT)领域得到了广泛应用,主要包括医疗卫生、食品安全及环境检测领域[19-24]。目前,恒温PCR技术也逐渐应用于农业领域,如环介导等温扩增(Loop-mediated isothermal amplification method,LAMP)和RPA/RAA技术。RPA/RAA扩增后一般有3种检测方法,有琼脂糖凝胶电泳法、荧光定量法和试纸条法[18]。冯黎霞等[25]建立了基于RPA-电泳检测技术的玉米褪绿斑驳病毒速测方法;谢实龙等[26]建立了转基因大豆MON89788品系的实时荧光检测方法;王燕等[27]建立了基于RPA-LFD技术的樱桃病毒A(CVA)的速测方法。一般情况下,实时荧光定量与试纸条法检测灵敏度高于电泳法。本研究目标是建立简单快速、适用于田间地头的褐飞虱现场鉴定技术,因此选择了可裸眼观察的试纸条法。RPA/RAA结合LFD或荧光实时检测系统,最低检测线可达到8~10拷贝/反应[21, 28]或20 fg/µL[29]。近年来,科学家们创新性地引入了CRISPR检测技术,将基因检测灵敏度提高到了单分子水平。张锋实验室建立了检测登革热和寨卡病毒的SHERLOCK系统[30];Jennifer Doudna实验室建立了检测人乳头瘤病毒的DETECTR系统[31]。SHERLOCK和DETECTR分别利用Cas13和Cas12a对邻近ssRNA和ssDNA的切割降解来激活报告基团。随后通过对报告基团产生的信号进行测定,即可确定感兴趣的DNA、RNA或突变是否存在[30, 31]。王永明团队在此基础上,进一步将RPA扩增与结果检测环节整合,建立了一步法支原体的可视化检测Cas12aVDet系统,降低了操作复杂度及交叉污染风险[32]。本研究目标是建立褐飞虱的快速定性检测方法,即使是残缺虫体也含有足够的模板DNA。本研究所建立方法的最低检测限为10 pg/µL,虽然低于SHERLOCK、DETECTR及Cas12aVDet系统,但亦能保证检出率及准确率均达100%。
RPA/RAA引物长度一般要求30~35 bp,但有多项研究表明19~29 bp长度的引物也有较好的扩增效果。赵巧雅等[33]建立了兔源肺炎克雷伯氏菌的RPA检测方法,其上下游引物分别为21 bp、19 bp,检测灵敏度为8.3×101CFU/mL,是传统PCR的100倍;王秋平等[34]应用RPA建立了烟曲霉菌速测方法,其上下游引物分别为25 bp、26 bp。由此可见,某些情况下可用普通PCR引物进行RPA/RAA扩增。本研究所筛选的引物长度分别为29 bp和30 bp,具有较高的扩增活性及特异性,未进行其他长度引物特性的比较分析。相对于LAMP方法需要4~6条引物不同,RPA/RAA方法只需要2条引物,因此更容易进行多重检测体系的建立。Crannell等[35]建立了基于多重LFD试纸条的粪便病原体的多重RPA核酸扩增体系,可同时检测鞭毛虫、隐孢子虫和内阿米巴原虫;Lau等[36]基于表面增强拉曼散射检测技术,建立了植物病原体的多重RPA核酸扩增体系,可同时检测灰霉病菌、丁香假单胞菌和尖孢镰刀菌。本研究所建立的褐飞虱单重检测方法为基于RPA/RAA技术的褐飞虱、伪褐飞虱、拟褐飞虱三重检测系统的开发奠定了基础。
综上所述,本研究建立的RAA-LFD法检测体系,提高了褐飞虱鉴定准确性、缩短了鉴定时间、脱离了对精密仪器的依赖,摆脱了对分类专业技能的要求,突破了核酸检测在植保领域大范围推广的技术瓶颈,可为褐飞虱的精准绿色防控提供技术支撑。唯一不足是RAA试剂及LFD试纸条价格昂贵,不利于大范围推广,且存在气溶胶污染风险。目前,本团队正在开发基于RAA+微流控纸基芯片的褐飞虱速测技术及配套产品,有望解决成本高及交叉污染问题。
[1] Bottrell D G, Schoenly K G. Resurrecting the ghost of green revolutions past: The brown planthopper as a recurring threat to high-yielding rice production in tropical Asia[J]., 2012, 15: 122-140.
[2] Hu G, Lu F, Zhai B P, Lu M H, Liu WC, Zhu F, Wu XW, Chen G H, Zhang X X. Outbreaks of the Brown Planthopper(Stal) in the Yangtze River Delta: Immigration or local reproduction? [J]., 2014, 9.
[3] Xue J, Zhou X, Zhang C X, Yu L L, Fan H W, Wang Z, Xu H J, Xi Y, Zhu Z R, Zhou W W, Pan P L, Li B L, Colbourne J K, Noda H, Suetsugu Y, Kobayashi T, Zheng Y, Liu S, Zhang R, Liu Y, Luo Y D, Fang D M, Chen Y, Zhan D L, Lv X D, Cai Y, Wang Z B, Huang H J, Cheng R L, Zhang X C, Lou Y H, Yu B, Zhuo J C, Ye Y X, Zhang W Q, Shen Z C, Yang H M, Wang J, Wang J, Bao Y Y, Cheng J A. Genomes of the rice pest brown planthopper and its endosymbionts reveal complex complementary contributions for host adaptation[J]., 2014, 15(12): 521.
[4] Wen Y C, Liu Z W, Bao H B, Han Z J. Imidacloprid resistance and its mechanisms in field populations of brown planthopper,Stål in China[J]., 2009, 94(1): 36-42.
[5] 崔亚丽, 何佳春, 罗举, 赖凤香, 傅强. 褐飞虱近似种伪褐飞虱和拟褐飞虱的寄主植物[J]. 中国水稻科学, 2013, 27(1): 105-110.
Cui Y L, He J C, Luo J, Lai F X, Fu Q.Host plants ofChina and(Muir), two sibling species of(Stål) [J]., 2013, 27(1): 105-110. (in Chinese with English abstract)
[6] 罗举, 傅强, 陆志坚, 吴彩谦, 李一波, 段德康, 刘玉坤, 张志涛. 测报灯下褐飞虱及其两种近似种的数量动态[J]. 中国水稻科学, 2010, 24(3): 315-319.
Luo J, Fu Q, Lu Z J , Wu C Q, Li Y B, Duan D K, Liu Y K, Zhang Z T. Population dynamics ofand its two sibling species under black light trap [J]., 2010, 24(3): 315-319. (in Chinese with English abstract)
[7] 蒋天梅, 虞根聪, 赖朝晖, 蒋晔. 象山县测报灯下褐飞虱及其近似种的数量动态[J]. 中国植保导刊, 2018, 38(7): 43-45.
Jiang T M, Yu G C, Lai C H, Jiang Y. Population dynamics ofand its two sibling species under light trap in Xiangshan, Zhejiang Province [J]., 2018, 38(7): 43-45. (in Chinese)
[8] 丁锦华. 褐飞虱属分类及其种类的研究[J].南京农业大学学报, 1981, 1: 78-85.
Ding J H. A review of studies on classification and species of the GenusDistant (Homoptera:Delphacidae)[J]., 1981, 1: 78-85. (in Chinese with English abstract)
[9] 芮金富, 周建平, 石磊. 褐飞虱与拟褐飞虱和伪褐飞虱的识别[J]. 现代农业科技, 2011, 5: 191.
Rui J F, Zhou J P, Shi L. Morphological identification offrom its two sibling species,and[J]., 2011, 5: 191. (in Chinese)
[10] 崔亚丽. 褐飞虱及其两近似种的生物学及分子标记的研究 [D]. 北京:中国农业科学院, 2012: 26-39.
Cui Y L. Studies on the biological characteristics and molecular markers for(Stål) and its two sibling speciesChina and(Muir) [D]. Beijing:, 2012: 26-39. (in Chinese with English abstract)
[11] Liu S H, Luo J, Liu R, Zhang C G, Duan D K, Chen H M, Bei W Y, Tang J. Identification ofand its two sibling species (and) by direct multiplex PCR[J]., 2018, 111(6): 2869-2875.
[12] Piepenburg O, Williams C H, Stemple D L, Armes N A. DNA detection using recombination proteins[J]., 2006, 4(7): 1115-1121.
[13] 吕蓓, 程海荣, 严庆丰, 黄震巨, 沈桂芳, 张志芳, 李轶女, 邓子新, 林敏, 程奇. 用重组酶介导扩增技术快速扩增核酸 [J]. 中国科学: 生命科学, 2010, 40(17): 983-988.
Lv B, Cheng H R, Yan Q F, Huang Z J, Shen G F, Zhang Z F, Li Y N, Deng Z X, Lin M, Cheng Q. Rapid neclic acid amplification with recombinase aided amplification technology[J]., 2010, 40(17): 983-988. (in Chinese)
[14] 孙魁, 邢微微, 徐东刚, 宋伦. 基于重组酶聚合酶扩增结合侧流层析技术的B、E型腺病毒快速可视化检测方法的研究与评价[J]. 军事医学, 2017, 41(7): 547-551.
Sun K,Xing W W,Xu D G,Song L. Recombinase polymerase amplification combined with a lateral flow dipstick for rapid and visual detection of adenovirus[J]., 2017, 41(7): 547-551. (in Chinese with English abstract)
[15] 赵松, 刘燕红, 李婷, 李伟, 张键锋, 郭利川, 应清界, 羊海涛, 杨坤. 结合重组酶介导的核酸等温扩增和荧光探针快速检测日本血吸虫基因片段[J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(1): 23-27.
Zhao S, Liu Y H, Li T, Li W, Zhang J F, Guo L C, Ying Q J, Yang H T, Yang K. Rapid detection ofspecific gene fragment by recombinase aided isothermal amplification combined with fluorescent probe [J]., 2019, 37(1): 23-27. (in Chinese with English abstract)
[16] 李樊, 郭晓芳, 殷启凯, 申辛欣, 付士红, 许松涛, 雷雯雯, 周红宁, 马学军, 王环宇. 塔希纳病毒的重组酶介导扩增快速检测方法[J]. 疾病监测, 2020, 35(3): 192-196.
Li F, Guo X F, Yin Q K, Shen X X, Fu S H, Xu S T, Lei W W, Zhou H N, Ma X J, Wang H Y. Establishment of a reverse transcription recombinase-mediated amplification assay for rapid detection of[J]., 2020, 35(3): 192-196. (in Chinese with English abstract)
[17] Lv L, Peng X X, Jing S L, Liu B F, Zhu L L, He G C. Intraspecific and interspecific variations in the mitochondrial genomes of(Hemiptera: Delphacidae) [J]., 2015, 108 (4): 2021-2029.
[18] Li J, Macdonald J, von Stetten F. Review: A comprehensive summary of a decade development of the recombinase polymerase amplification., 2019, 144(1): 31-67.
[19] Wee E J H, Lau H Y, Botella J R, Trau M. Re-purposing bridging flocculation for on-site, rapid, qualitative DNA detection in resource-poor settings [J]., 2015, 51(27): 5828-5831.
[20] 樊晓旭, 宋翥远, 赵永刚, 赵明, 董雅琴, 张永强, 李园丽, 迟田英, 刘春菊, 戈胜强, 张志诚, 吴晓东, 王树双, 王志亮. 塞尼卡谷病毒重组酶聚合酶扩增-侧流层析试纸条检测方法的建立[J]. 中国预防兽医学报, 2018, 40(5): 406-410.
Fan X X, Song Z Y , Zhao Y G, Zhao M, Dong Y Q, Zhang Y Q. Li Y L, Chi T Y, Liu C J, Ge S Q, Zhang Z C, Wu X D, Wang S S, Wang Z L. Establishment of recombinase polymerase amplification-lateral flow dipstick for the detection of Seneca valley virus [J]., 2018, 40(5): 406-410. (in Chinese with English abstract)
[21] 葛志毅, 周建华, 尚佑军, 李学瑞, 刘永生, 赵鹭, 孙晶晶, 曹小安. 一种侧流试纸结合FAM重组酶聚合酶扩增(RPA)诊断布鲁氏菌感染的方法[J]. 中国人兽共患病学报, 2019, 35(10): 905-908.
Ge Z Y, Zhou J H , Shang Y J, Li X R , Liu Y S, Zhao L, Sun J J, Cao X A. Lateral flow test strips combined with FAM recombinase polymerase amplification ( RPA) for the diagnosis ofinfection [J]., 2019, 35(10): 905-908. (in Chinese with English abstract)
[22] 兰全学, 陈佳平, 杨慧, 杜文旗, 金玉娟, 甘莉萍, 刘渠, 刘小青. 食品中空肠弯曲菌荧光重组酶聚合酶扩增检测方法的建立[J]. 现代食品科技, 2020, 36 (5) : 1-6.
Lan Q X, Chen J P, Yang H, Du W Q, Jin Y J, Gan L P, Liu Q, Liu X Q. Development of a detection method for food-bornebased on fluorescence probe-based recombinase polymerase amplification [J]., 2020, 36 (5): 1-6. (in Chinese with English abstract)
[23] 柳海宾, 张海鑫, 宋腾飞, 刘聪, 聂付磊. 环介导等温扩增结合免疫层析试纸条快速检测羊肉及其制品中的鸭源成分[J]. 食品工业科技, 2020, 41(16): 238-241+251.
Liu H B, Zhang H X, Song T F, Liu C, Nie F L. Rapid detection of duck derived components in mutton and mutton products by loop mediated isothermal amplification combined with immune chromatographic test strip [J]., 2020, 41(16): 238-241+251. (in Chinese with English abstract)
[24] 袁伟, 廖凌, 童淑梅, 康晓平. 国境口岸病原体检测新方向-重组酶聚合酶扩增技术 [J]. 中国国境卫生检疫杂志, 2019, 42(4): 295-300.
Yuan W, Liao L, Tong S M, Kang X P. New direction for pathogens detection at national frontier ports: Recombinase polymerase amplification technology [J]., 2019, 42(4): 295-300. (in Chinese with English abstract)
[25] 冯黎霞, 魏霜, 余辛, 张永江, 武目涛, 胡学难. 重组酶聚合酶扩增技术(RPA)快速检测玉米褪绿斑驳病毒[J]. 植物保护学报, 2020, 47(1): 217-218.
Feng L X, Wei S, Yu X, Zhang Y J, Wu M T, Hu X N. Detection of maize chlorotic mottle virus by recombinase polymerase amplification [J]., 2020, 47(1): 217-218. (in Chinese)
[26] 谢实龙, 汪小福, 丁晨露, 祝旋, 汤婷, 马同富, 蔡健, 徐俊锋. 转基因大豆MON89788实时荧光重组酶聚合酶扩增检测方法的建立[J]. 农业生物技术学报, 2019, 27(7): 1301-1310.
Xie S L, Wang X F, Ding C L, Zhu X, Tang T, Ma T F, Cai J, Xu J F. Establishment of a real-time fluorescence recombinase polymerase amplification for detection of transgenic soybean () MON89788 [J]., 2019, 27(7): 1301-1310. (in Chinese with English abstract)
[27] 王燕, 王春伟, 王琳, 荆琦, 高海馨, 余廷濠, 王美琴, 张作刚, 王建明. 樱桃灰霉病菌LFD-RPA快速检测方法的建立[J]. 植物病理学报, 2020, 50(2): 238-245.
Wang Y, Wang C W, Wang L, Jing Q, Gao H X, Yu T H, Wang M Q, Zhang Z G, Wang J M. Development of LFD-RPA assay for rapid detection ofin cherry [J]., 2020, 50(2): 238-245. (in Chinese with English abstract)
[28] 许笑, 王艳华, Khan M Z, 王恒, 蔡建平. 鸡源产气荚膜梭菌重组酶聚合酶扩增检测方法的建立[J]. 中国兽医科学, 2019, 49(12): 1475-1483.
Xu X, Wang Y H, Khan M Z, Wang H, Cai J P. Recombinase polymerase amplification: A detection method for the detection offrom chicken [J]., 2019, 49(12): 1475-1483. (in Chinese with English abstract)
[29] 彭遥, 阚飙, 夏连续, 李伟, 张雯, 秦爱平, 卢金星. 侧流层析-重组酶聚合酶扩增技术快速检测土拉弗朗西斯菌[J]. 疾病监测, 2019, 34(5): 455-459.
Peng Y, Kan B, Xia LX, Li W, Zhang W, Qin AP, Lu JX. Establishment of a recombinase polymerase amplification combining with lateral flow strip assay for rapid visual detection of[J]., 2019, 34(5): 455-459. (in Chinese with English abstract)
[30] Gootenberg J S, Abudayyeh O O, Kellner M J, Joung J, Collins J J, Zhang F. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6 [J]., 2018, 360: 439-444.
[31] Chen J S, Ma E B, Harrington L B, Da Costa M, Tian X R, Palefsky J M, Doudna J A. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity [J]., 2018, 360(6387): eaar6245.
[32] Wang B, Wang R, Wang D Q, Wu J, Li J X, Wang J, Liu H H, Wang Y M. Cas12aVDet: A CRISPR/Cas12a-based platform for rapid and visual nucleic acid detection [J]., 2019, 91(19): 12156-12161.
[33] 赵巧雅, 马秀丽, 刘存霞, 史玉颖, 胡峰, 王贵升, 兰邹然, 黄兵. 兔源肺炎克雷伯氏菌重组酶聚合酶扩增检测方法的建立[J]. 中国动物检疫, 2019, 36(7): 82-85.
Zhao Q Y, Ma X L, Liu C X, Shi Y Y, Hu F, Wang G S, Lan Z R, Huang B. Establishment of a RPA assay for detecting klebsiella pneumoniae of rabbit origin [J]., 2019, 36(7): 82-85. (in Chinese with English abstract)
[34] 王秋平, 黄恩奇, 杨银梅, 钟志敏, 陈斌. 应用直接重组酶聚合酶扩增技术快速检测烟曲霉菌[J]. 中华医院感染学杂志, 2018, 28(24): 3734-3737.
Wang Q P, Huang E Q, Yang Y M, Zhong Z M, Chen B. Rapid detection ofby direct recombinant polymerase amplification [J]., 2018, 28(24): 3734-3737. (in Chinese with English abstract)
[35] Crannell Z, Castellanos-Gonzalez A, Nair G, Mejia R, White A C, Richards-Kortum R. Multiplexed recombinase polymerase amplification assay to detect intestinal protozoa [J]., 2016, 88(3): 1610-1616.
[36] Lau H Y, Wang Y, Wee E J, Botella J R, Trau M. Field demonstration of a multiplexed point-of-care diagnostic platform for plant pathogens [J]., 2016, 88(16): 8074-8081.
A Rapid Detection Assay ofBased on Recombinase Aided Amplification-lateral Flow Dipstick Technology
LUO Ju, TANG Jian, WANG Aiying, YANG Baojun, LIU Shuhua*
(,,,;Corresponding author, E-mail: tangjian@caas.cn)
【】To solve the time- and labor-costing problem for accurate identification oftrapped by light, we aim to establish a fast and convenient qualitative identification method.】At first, we selected a couple of primers which are species specific for. Then, we established an identification method based on Rapid Aided Amplification-Lateral Flow Dipstick (RAA-LFD) technology. Finally, we analyzed the temperature and template robustness of this method. 【】The RAA-LFD method developed in the present study is convenient and fast, and it does not depend on any sophisticated instrument. Furthermore, this method can amplify effectively with crude tissue fluid as template, and it can be triggered by body temperature. The entire process for 56 specimens, including the crude tissue liquid preparation, isothermal amplification, and LFD detection, can be completed in 45 min with an accuracy of 100%. 【】This RAA-LFD method is a time-saving and easy-to-apply molecular diagnostic method forugens identification from its two sibling species. It is really suitable for Point of Care Test (POCT) in plant protection station or in field.
;China;(Muir); RAA-LFD; Point of Care Test
10.16819/j.1001-7216.2022.210314
2021-03-29;
2021-05-18。
浙江省自然科学基金资助项目(LGN21C140002);中国水稻研究所重点研发项目(CNRRI-2020-03);中央级公益性科研院所基本科研业务费专项(CPSIBRF-CNRRI-202123);中国农业科学院科技创新工程资助项目。

