脂肪间充质干细胞治疗犬急性肾损伤模型的效果评估
徐 麟, 姚兵华,林嘉颖, 陈淑仪, 李 暄, 王丙云, 陈志胜, 刘璨颖,陈胜锋
(1.佛山科学技术学院生命科学与工程学院,广东 佛山 528200 ; 2. 华南农业大学,广东 广州 510000)
犬急性肾损伤(Acute kidney injury,AKI)是临床常见且死亡率较高的一种综合征,主要表现为肾功能急剧衰竭、电解质失衡,临床症状主要有少尿甚至无尿、精神沉郁、食欲下降,并可能伴随不同程度呕吐、腹泻、氮血症和脓毒血症等[1]。目前常规治疗手段如补液、纠正电解质平衡、加快代谢物排泄,甚至透析、换肾等,均以缓解症状为主[2]。
间充质干细胞(Mesenchymal stem cells,MSCs)疗法是近年来新兴的一种疗法,在皮肤、肝、肺、软骨、脊髓、神经等多种组织的损伤修复方面展现良好的效果[3]。
众多动物试验显示,脂肪间充质干细胞(AD-MSCs)移植后能够向损伤的肾脏聚集,促进损伤肾脏结构和功能的恢复。肾组织特殊的结构,MSCs并不能直接通过肾小球滤过膜进入肾小管[4],但是有相关试验应用培养近端小管上皮细胞对AD-MSCs进行诱导分化,结果表明它的表面标志CD90、CD49a的表达下调,证实了它可以分化为肾小管上皮细胞。MSCs对肾损伤的修复作用还存在一定争议,大量研究表明[5],MSCs修复损伤组织的途径有细胞分化[6]以及旁分泌途径等[7],研究表明,腹腔灌注AD-MSCs可以下调血清中炎性因子以及免疫相关的细胞因子的表达水平。本实验室前期研究也表明,MSCs分泌的外泌体对庆大霉素致损的肾小管上皮细胞有促增殖[8]及抑凋亡[9]的作用,提示MSCs可通过其分泌的外泌体来促进受损肾小管的修复。为此,本试验采用庆大霉素制备犬AKI动物模型,再利用犬AD-MSCs进行治疗,通过临床症状、血清肌酐、尿素氮、肿瘤坏死因子以及尿常规和病理切片等指标评估治疗效果,为犬AD-MSCs应用于临床AKI治疗提供试验依据。
1 材料与方法
1.1 主要试剂 硫酸庆大霉素注射液,购自山西芮城科龙兽药有限公司;氯化钠注射液,购自江西创欣药业集团有限公司;血清肌肝(SCr)、尿素氮(BUN)试剂盒,均购自南京建成科技有限公司; 肿瘤坏死因子-α(TNF-α)、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)和肾损伤分子-1(KIM-1)ELISA试剂盒,均购自上海酶联生物科技有限公司;尿常规试纸,购自桂林优利特公司。
1.2 主要仪器 小型高速冷冻离心机(5418R型)、核酸蛋白测定仪(BioPhotometerPlus型),均购自Eppendorf公司;生物组织包埋机(KD-BM型),购自浙江科迪仪器设备有限公司;切片机(RM2016型),购自德国Leica公司;普通光学显微镜,购自日本尼康公司;兽用犬猫尿比重仪,购自山东田园信科光学仪器公司。
1.3 试验动物 5~6月龄健康中华田园犬6只(体重5~7 kg)。
1.4 试验方法
1.4.1 试验设计 将6只犬随机分为模型组和治疗组,每组3只,皮下注射80 000 IU/(kg·bw·d)硫酸庆大霉素。试验分为造模(0~6 d)与治疗(7~15 d)2个阶段,给药后,每2 d采血,检测SCr值,以比基线值≥1.5倍为标准判定为造模成功。治疗阶段:治疗组分别在试验第7、10天和第13天静脉注射2×106个AD-MSCs,模型组静脉输注等量生理盐水,试验期共15 d。
1.4.2 ELISA检测SCr、BUN、TNF-α、NGAL、KIM-1含量 分别在每次注射AD-MSCs的第3天(即试验第9、12天和第15天)采集血液,3 000 r/min 离心10 min后收集血清,按试剂盒说明书操作。尿常规检测:分别于造模前(第0天)、造模后(第7天)以及治疗结束时(第15天)收集尿液样本,进行尿常规检测。组织病理学检查:各组动物在麻醉、采血及安乐死后,取肾脏组织,固定于 10%中性福尔马林缓冲液,经常规组织脱水、透明、包埋、切片,然后进行苏木素-伊红(H.E.)染色,显微镜下观察并记录病理变化。临床症状:每天观察犬的精神状态、食欲、尿量、是否呕吐、是否腹泻等症状。
2 结果
2.1 SCr、BUN、TNF-α、NGAL、KIM-1检测 如表图1所示,试验前6天,两组犬SCr小幅升高,至第6天时SCr值均>基线值1.5倍并开始大幅上升,均在第12天到达峰值,但治疗组峰值明显小于模型组,第15天时,治疗组SCr已降至正常水平。两组犬BUN水平均在前9天缓慢上升,治疗组犬在9 d后逐渐下降,而模型组在12 d后大幅上升;TNF-α、NGAL及KIM-1水平在进行AD-MSCs治疗后也逐步下降。
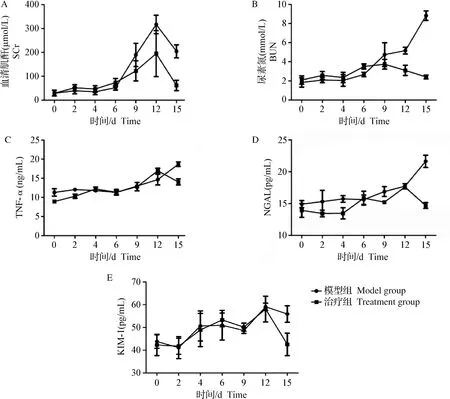
图1 犬SCr、BUN、TNF-α、NGAL、KIM-1 检测结果Fig.1 Test results of canine serum SCr,BUN,TNF-α,NGAL and KIM-1A:SCr 水平; B:BUN 水平; C:TNF-α水平; D:NGAL 水平; E:KIM-1 水平A:SCr level; B:BUN level; C:TNF-α level; D:NGAL level; E:KIM-1 level
2.2 临床症状 造模阶段:造模前,所有犬只精神状态及食欲均良好,尿量正常,无呕吐、腹泻等症状;第1~2天出现尿频及尿量增多,第3~5天尿量减少,精神沉郁,食欲减退。治疗阶段:第7~8天,模型组部分犬食欲完全废绝,饮水量增加,尿量较少,偶有呕吐症状;而治疗组犬恢复部分食欲,尿量增多;第10~11天,模型组犬开始少量进食,但尿量少,精神沉郁;第12~15天,治疗组犬的临床表现基本恢复正常,而模型组犬仍然进食较少,精神状态一般。
2.3 犬尿常规检查 造模后,如表1所示,犬尿常规多项指标出现异常,部分犬出现尿潜血及蛋白尿、尿pH及比重下降等。经AD-MSCs治疗后,治疗组犬大部分指标恢复正常。

表1 尿常规检查结果Table 1 Results of routine urine tests
2.4 犬肾脏切片 如图2所示,模型组犬肾脏中肾小管阻塞较多(图2A),肾小管上皮细胞广泛变性、坏死,甚至脱落充满管腔(图2B);而治疗组肾小管结构较完整,阻塞较少(图2C),肾小管上皮细胞变性较少,管腔中异物较少(图2D)。
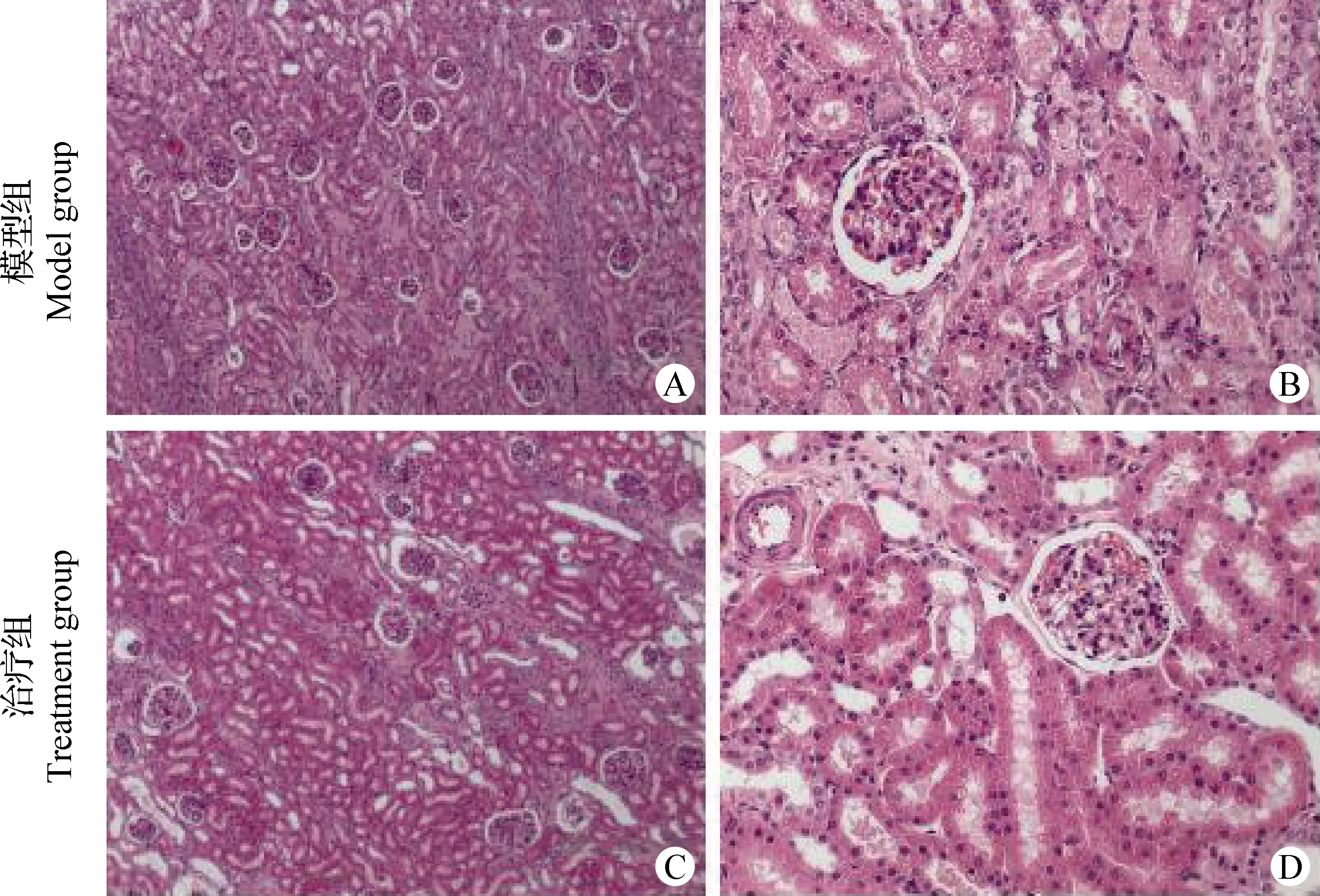
图2 犬肾脏切片结果(H.E.染色; A、C:100×; B、D:400×)Fig.2 Results of canine kidney slices(H.E. staining; A,C:100×; B,D:400×)
3 讨论
制作AKI动物模型的方法主要有:甘油、缺血再灌注[10]、肾毒性药物(如庆大霉素)、脓毒症模拟感染顺铂等[11],其中庆大霉素诱导的AKI模型常用于研究肾小管上皮细胞损伤的相关机制,但造模时间相对较长,用药剂量需要多次预试验进行把控,造模程度也较难把握。本试验采用每天皮下注射80 000 IU/(kg·bw)庆大霉素的方式,可在6 d后成功制备犬AKI模型。
SCr、BUN是临床上诊断AKI最常用的指标[12]。SCr是肌肉代谢的产物,正常情况下SCr经肾小球滤过进入肾小管后,很少被肾小管上皮细胞重吸收。当肾脏出现损伤时,SCr可从受损肾小管上皮细胞进入血液,导致SCr上升。在制作AKI模型时,SCr的数值≥正常值的1.5倍是判定AKI造模成功的通用标准[13]。BUN是蛋白质代谢的终末产物,通过尿素形成与排泄之间的平衡来维持正常的生理浓度,肾血流量减少时,尿素在体内滞留增大,使BUN水平上升。因此,检测BUN能在一定程度上反映肾血流量以及肾小球的滤过功能。经过AD-MSCs治疗后,SCr及BUN水平均下降,其中BUN甚至可恢复至正常水平,结合尿常规检测结果提示,AD-MSCs可一定程度上改善受损的肾功能。
NGAL和KIM-1均是脂环蛋白家族的一员,在肾小管上皮细胞受损时表达升高,可作为肾损伤早期的生物标记物[14]。本试验结果显示,治疗组血清NGAL和KIM-1水平在第12天开始下降并在第15天恢复至基线水平,而模型组则处于较高水平。TNF-α是一种炎性因子,其水平与肾小管坏死程度密切相关[15],造模期间TNF-α水平持续上升,而经AD-MSCs治疗后,治疗组TNF-α水平在第12~15天呈下降趋势。综合这3个指标的变化规律,说明经过AD-MSCs的治疗,AKI犬的肾损伤程度得到了一定的修复。
通过病理组织切片观察发现,模型组肾小管上皮组织发生广泛性的变性坏死,小管内细胞组织崩解,轮廓模糊不清,血流量的减少也可能导致肾小管坏死,红细胞破裂,近曲小管腔内有许多杂质和坏死物填充,阻碍肾脏的滤过作用,大量有毒物质积聚在体内,远曲小管结构的破坏,导致肾脏重吸收作用受阻碍。而治疗组肾小管、肾小球、肾间质之间结构清晰可辨,且管腔内异物较少,肾血流量充盈。综上,经AD-MSCs的治疗,受损的肾组织结构可在一定程度上得到修复,肾脏的功能也随之得到改善,从而使SCr、BUN、TNF-α、NGAL、KIM-1等血清指标以及尿常规等逐渐改善甚至恢复正常。

