基于网络药理学方法探讨“白术-茯苓”药对抗胃癌的作用机制
李国秋 张嘉雪 陈子铮 陈林耿 吴晓怡 张 韧
1.广州中医药大学第一临床医学院,广东 广州 510405;2.广州中医药大学基础医学院,广东 广州 510006
胃癌(Gastric cancer, GC)是中国常见的恶性肿瘤之一,根据2018年2月国家癌症中心发布的最新一期全国癌症统计数据显示,GC的发病率和死亡率分列所有肿瘤类型的第2位与第3位[1]。近年来,GC的发病率呈下降趋势,新型生物制剂的研发和综合治疗策略的不断发展,降低了GC的致死率,但GC的预后仍然不甚乐观。中医在控制癌症病灶发展,延长患者生存期和改善生存质量等方面表现出独特的优势,尤其是中药可提高人体免疫,调节肿瘤微环境的各组分,在肿瘤防治方面具有重要作用[2]。
白术,味苦、甘、微辛,性温,其用在中,主呕逆泄利、去湿强脾、开胃进食、和中益气。《本草通玄》曰:“白术,补脾胃之药,得中宫冲和之气,更无出其右者。土旺则能健运,故不能食者,食停滞者,有痞积者,皆用之也。”现代药理研究[3]发现,白术挥发油具有抗肿瘤、促进胃肠运动、调节胃肠功能、促进营养质吸收的功能。茯苓,味甘,性平,主利水实脾,《神农本草经疏》记载:“中焦者,脾土之所治也。中焦不治故见膈中瘀水,腹胀大也,利水实脾,则其证自退矣。”现代药理研究[4-5]发现,茯苓中的多糖和三萜类成分可保护机体的免疫器官,增强机体免疫功能,诱导肿瘤细胞凋亡,抑制胃癌细胞生长,抑制癌细胞转移,清除氧自由基。据目前相关文献报道[6],“白术-茯苓”药对抗GC的临床疗效显著,但其具体作用机制尚未见系统阐明。
网络药理学是基于系统生物学理论,采用复杂的生物网络模型,从药物、化学成分、靶点、疾病间相互作用的整体性与系统性出发,预测药物治疗疾病的药理学机制的一种方法,其与中医治病的“整体观”理论及中药多成分、多靶点、多途径、多作用的特点具有一致性[7- 8]。故本研究将运用网络药理学方法探讨“白术-茯苓”药对抗GC的作用机制。
1 材料与方法
1.1 “茯苓-白术”药对药物成分获取 中医药百科全书(The Encyclopedia of Traditional Chinese Medicine,ETCM)是由中国中医科学院中药研究所、中药资源中心、北京大学中药学院等大型单位打造的中医药数据平台,该平台收录了403味中药,7274个中药成分等数据信息,为中医药现代化研究提供了强有力的数据基础和分析平台[9]。
运用ETCM(ETCM, http://www.tcmip.cn/ETCM/index.php/Home/Index/)检索“白术”和“茯苓”两者的药物成分,同时记录各成分对应的“Pubchem ID”和“Canonical SMILES”。
1.2 “茯苓-白术”药对药物成分对应靶点获取 通过Swiss Target Prediction平台(http: //www.swisstargetprediction.ch /) 输入1.1获得化合物成分的的“Canonical SMILES”格式,预测“茯苓-白术”药对药物成分对应的作用靶点。
1.3 “茯苓-白术”药对抗GC的相关靶点收集 在Genecard数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、Pharmgkb数据库(https://www.pharmgkb.org/)、TTD数据库(http://db.idrblab.net/ttd/)、Drug bank数据库(https://www.drugbank.ca/)输入“gastric carcinoma”检索GC相关的靶点,删除其中重复的基因。将获得的疾病靶点与1.2获得的成分作用靶点进行比对,最后获得“茯苓-白术”药对抗GC的潜在作用靶点。
1.4 “茯苓-白术”药对抗GC的潜在作用靶点相互作用网络(Protein Protein interaction,PPI)构建 在string数据库(https://string-db.org/),输入“茯苓-白术”药对抗GC的潜在作用靶点,设置物种为“Homo sapiens”,最低相互作用阈值为“medium confidence”,其余参数保持默认,获取靶蛋白相互作用数据,通过Cytoscape 3.2.1软件构建PPI网络,筛选degree值排名前10的靶点。
1.5 KEGG通路富集分析 利用Metascape数据库(http://metascape.org/gp/index.html#/main/step1) 对“茯苓-白术”药对抗GC相关靶点进行KEGG通路富集分析,结合P值,从小到大排序,筛选出前10条通路,导出csv文件,对数据进行可视化处理。
2 结果
2.1 “茯苓-白术”药对药物成分收集 通过ETCM数据库,一共获得38个化学成分,其中白术14个、茯苓24个,见表1。

表1 “茯苓-白术”药对药物成分信息
2.2 “茯苓-白术”药对抗GC相关靶点 通过Swiss Target Prediction平台,删除重复靶点后得到69个“茯苓-白术”药对药物成分的作用靶点,接着将这 69个靶点与Genecard、OMIM、Pharmgkb、TTD,和Drug Bank 5个疾病数据库收集到的GC相关基因靶点进行比对,最终得到62个“茯苓-白术”药对抗GC的相关靶蛋白,见表2。
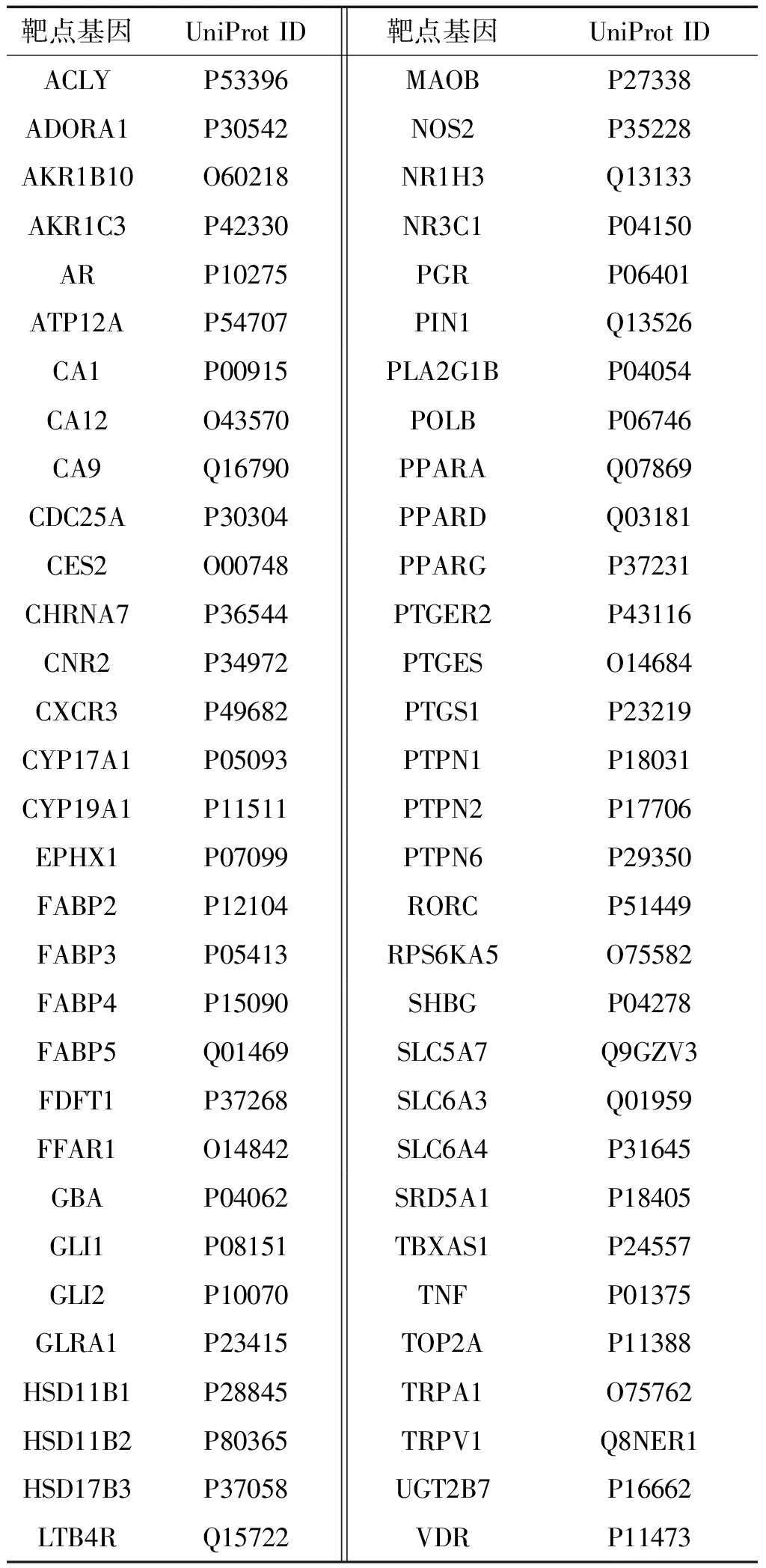
表2 茯苓-白术”药对抗GC的62个靶蛋白
2.3 “茯苓-白术”药对抗GC的潜在作用靶点PPI分析 基于Sring数据库的62个靶蛋白的蛋白质相互作用关系数据,采用Cytoscape 3.2.1软件绘制靶蛋白PPI网络图,如图1所示。此网络共包括57个节点,143条边(若两个靶蛋白之间存在相互作用关系,则用边连接两个靶蛋白),靶蛋白degree值越大则节点越大。

图1 “茯苓-白术”药对抗GC靶蛋白PPI网络
同时利用Cytoscape 3.2.1软件的筛选工具,筛选出该网络中degree值排名前10 的靶蛋白,分别为TNF、CYP19A1、AR、PPARG、AKR1C3、NR3C1、CYP17A1、HSD17B3、PTGS1、SRD5A1。
2.4 KEGG通路富集分析 采用Metascape平台对“茯苓-白术”药对抗GC的62 个作用靶点进行KEGG通路富集分析,筛选前10条目(P值从小到大进行排序),并且通过Excel对结果进行可视化处理。结果如图2所示。主要通路有Steroid hormone biosynthesis、PPAR signaling pathway、Neuroactive ligand-receptor interaction、Arachidonic acid metabolism、Nitrogen metabolism、Chemical carcinogenesis、Pathways in cancer insulin resistance、Regulation of lipolysis in adipocytes、Leishmaniasis。

图2 “茯苓-白术”药对抗GC的KEGG通路富集分析
3 讨论
3.1 “白术-茯苓”药对抗GC相关的重要药物成分 本研究最终预测得到“白术-茯苓”药对抗GC的38个活性化合物、62个潜在作用靶点及10条通路,其化合物多样性、作用靶点多样性及通路多样性,从药理层面及分子层面论证了中药“同病异治,异病同治”原则。
现代药理研究[10]证实,白术化学成分主要为挥发油、白术多糖、氨基酸等成分,这些化学成分有抗炎、抗肿瘤、提高机体免疫力、抗衰老、调节胃肠等药理作用,茯苓中具有生物活性的化合物主要为三萜类和多糖类化合物,具有抗肿瘤、免疫调节、抗炎、抗氧化、抗衰老、增强记忆力、调节泌尿系统、降血糖等[11]。本研究中,白术-茯苓药对筛选出的化合物含多种抗癌成分,如白术内脂I、白术内脂III、茯苓酸等,白术内酯Ⅰ能够抑制MGC-803细胞的生长及繁殖,下调GC细胞表面标志物Hey1、CD44的表达,同时也包括抑制Notch信号通路,及降低Notch1、Hes1、Hey1和Jagged1蛋白的活性,从而有效地抑制GCMGC-803细胞的增殖[12]。茯苓酸能抑制GC细胞的生长和克隆形成能力,显著诱导细胞G2/M期停滞及细胞凋亡,同时调节一些凋亡相关蛋白如caspase-3,PARP, Bcl-2和Bax的蛋白表达,还能扰乱体外GC线粒体能力和抑制体内GC移植瘤生长。
3.2 “白术-茯苓”药对抗GC相关的重要作用靶点 在“白术-茯苓”药对抗GC的PPI网络中,TNF、CYP19A1、AR、PPARG、AKR1C3、NR3C1、CYP17A1、HSD17B3、PTGS1、SRD5A1在网络中处于degree值前10名,是“白术-茯苓”药对抗GC的重要潜在靶点。肿瘤坏死因子(TNF)分为两种,分别为TNF-α和TNF-β,国外研究报道,GC患者血清中TNF-α水平明显高于正常人群,手术切除GC组织后患者体内血清中TNF-α水平明显下降,但转移或复发者血清TNF-α水平再度显著升高,该现象提示TNF-α与GC的发生发展密切相关且起到促进作用[13]。毛跃锋等[14]的研究表明参芪扶正汤能明显降低Ⅲ~Ⅳ期GC患者血清中TNF-α、IL-6以及SIL-2R水平,与此同时亦能明显提高患者的免疫功能,提高其生活质量。有研究表明,雄激素受体(AR)在GC组织中高表达,且AR与年龄、性别、肿瘤大小、组织类型等均无明显相关性。调节细胞周期诸多因素的关键角色是cyclinD1,而性激素可通过与其受体结合,介导某些直接或间接机制促进cyclinD1过度表达,从而促进肿瘤细胞增殖,此外性激素经过胃肠道分解和肝内代谢可转变成低浓度的致癌物,与受体结合时可增强其与细胞核内DNA的亲和力,解除对DNA合成的抑制,恢复DNA聚合酶活性,促进细胞增殖,导致细胞恶性增殖的发生。
3.3 “白术-茯苓”药对抗GC相关的重要生物通路 根据KEGG分析结果可知,“白术-茯苓”药对抗GC的信号通路与“癌症途径(pathway in cancer)”最为相关,此外还涉及通路有“类固醇激素合成(Steroid hormone biosynthesis)”“过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)”“神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)”“花生四烯酸代谢(Arachidonic acid metabolism)”“氮代谢(Nitrogen metabolism)”“化学致癌作用(Chemical carcinogenesis)”“胰岛素抵抗(Insulin resistance)”“脂肪细胞中脂肪分解的调节(Regulation of lipolysis in adipocytes)”。过氧化物酶体增殖物激活受体γ(PPARγ)是一类由配体激活的核转录因子,在激活状态下参与调节许多与消化道肿瘤形成有关的基因,具有抑制增殖、促进凋亡、抑制细胞周期的进程等抗肿瘤作用,被认为是开发预防治疗GC的重要靶点[15]。张顺荣等[16]研究发现,胃复方含药血浆可通过上调PPARγ基因表达的途径来抑制 SGC-7901 细胞的增殖,促进其凋亡。有研究[17]发现,胰岛素抵抗与GC的患病相关,而GC患者普遍存在糖耐量异常和胰岛素抵抗,这有可能是由于GC本身癌组织通过自分泌和旁分泌途径产生一些生长因子,从而产生和加重一胰岛素抵抗。另有研究[18]认为,高胰岛素血症可加强胰岛素样生长因子(IGF-1)的合成,而IGF-1能够促进细胞有丝分裂,抑制细胞凋亡,促进上皮细胞转化,此外还可促进血管内皮生长,因此增加了细胞恶性增殖的概率,减少肿瘤细胞的凋亡。
4 结论与展望
60%的GC患者手术或化疗后会在2~3年内复发转移,原因在于脱落和逃逸的肿瘤细胞会再次增殖并转移,而化疗药物药物对大多数腺癌缺乏敏感性,常因多药耐药导致治疗失败,或患者因无法耐受化疗药物的毒副反应而中断治疗[19-20]。研究[21]证实,中药治疗GC具有多成分、多靶点、毒副作用小、防止术后复发转移等优点。本研究运用网络药理学方法,筛选出“白术-茯苓”药对潜在活性化合物,获取其治疗GC的潜在作用靶点, 从“成分-靶点-通路”研究药物与疾病之间的相互作用规律,推测“白术-茯苓”药对的药效机理,初步阐释了其治疗GC的作用机制。但由于数据库信息的不全面、化合物的浓度及化合物间的相互作用不明确等因素,使得预测结果有一定的局限性和片面性,需要更多的临床试验与动物实验进一步去验证。

