Ankura主动脉覆膜支架行原位开窗重建弓上分支的应用
余钻标,尹孝亮,林作栋,郎德海
(中国科学院大学宁波华美医院血管外科/中国科学院大学宁波生命与健康产业研究院,浙江宁波315000)
胸主动脉腔内修复术(thoracic endovascular repair,TEVAR)由于其创伤小、恢复快、效果明显等优势,现已成为治疗主动脉弓部病变的首选术式[1-3]。TEVAR 手术的关键不仅仅是有效隔绝血管病变区域、减少内漏,更重要的是对于近端锚定区不足或累及弓部分支的病变,如何有效重建分支血供是确保手术安全的重要保障。有研究[4-6]表明,对于累及左锁骨下动脉(left subclavian artery,LSA)病变的患者,如果不重建LSA 会增加这部分患者的病死率和术后脑梗死的发生率。近年来原位开窗技术因其最大程度地保留分支血管,且具有更低的内漏风险及分支支架受压风险而广受好评[7-9]。本研究笔者回顾我科自2017年3月—2020年12月采用穿刺破膜技术对Ankura 主动脉覆膜支架进行原位开窗,并对其进行术后随访观察,探讨Ankura 主动脉覆膜支架进行原位开窗重建弓上分支的可行性及效果,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2017年3月—2020年12月中国科学院大学宁波华美医院血管外科收治的近端锚定区不足的主动脉弓部病变性47 例,其中男41 例,女6 例;年龄34~84 岁,平均(60.4±8.7)岁。胸主动脉夹层38 例,胸主动脉瘤6 例,胸主动脉溃疡3 例。患有5年以上高血压病史40 例,合并心脏疾患5 例,合并糖尿病6 例,合并慢性阻塞性肺疾病4 例。所有患者在症状出现1~12 d,平均(4.4±2.1)d 入住我院,患者术前均行主动脉血管造影(computer tomography angiography,CTA) 检查并确诊为主动脉弓部病变。纳入标准:⑴累及弓上分支的主动脉疾病;⑵Standford B 型夹层或动脉瘤近端锚定区<1.5 cm;⑶术中予以穿刺针对Ankura 胸主动脉覆膜支架进行开窗破膜操作。
1.2 手术方法
术前根据CTA 检查及病变特点确定开窗数目及支架规格。麻醉满意后,术区消毒铺巾,切开暴露目标血管后备用。选择合适的股总动脉穿刺点(通常以右侧为主,若右侧髂股动脉入路偏细或夹层累及则取左侧入路),常规穿刺并预置两把Proglide 缝合器(雅培公司,美国)后,置入10 F鞘及标记导管至升主动脉造影,明确主动脉弓部病变特点、双椎动脉优势情况后,控制性降压至90/60 mmHg(1 mmHg=0.133 kPa) 左右,并将Ankura 主动脉支架予以精确定位并释放后,再次造影评估,并进行原位开窗操作。
LSA 原位开窗:常规沿左肱动脉入路,切开暴露左肱动脉后,穿刺置入6 F 短鞘及造影导管至升主动脉(如肱动脉偏细,必要时可予以腋动脉切开暴露)。当Ankura 主体覆膜支架顺利释放后,沿左肱动脉入路交换置入6 F Fustar 可调弯鞘(深圳先健公司)及穿刺针,并使其两者器械近端垂直抵住Ankura 主体支架覆膜面,多角度透视并调整至最佳位置后予以穿刺破膜操作,并将0.018 英寸导丝引入主体支架内,继续予以交换直径为4 mm/6 mm 球囊扩张破膜处,同时多方位透视并确认破膜成功,接着交换0.035 英寸Amplaz 超硬导丝及对应的长鞘,并继续予以直径为8 mm/10 mm 球囊扩张开窗处,满意后予以Roadmap 路径图引导下置入合适的开窗分支支架,支架近端进入1 cm 左右,支架远端不超过左椎动脉(left vertebral artery,LVA),并再次造影评估开窗效果,对于开窗分支支架形态欠佳,必要时可予以后扩操作或内嵌裸支架以加固开窗分支支架。
左颈总动脉(left common carotid artery,LCCA)原位开窗:术中同法切开暴露LCCA 后,予以穿刺置入6 F 短鞘及造影导管至升主动脉备用。接着沿股动脉入路将Ankura 主体支架精准释放后,沿LCCA 入路交换置入穿刺针及对应的短鞘,透视下垂直抵住Ankura 主体支架并行穿刺破膜,后续操作与LSA 原位开窗同法。
1.3 观察指标与随访
技术成功定义:最后造影确认支架位置及形态良好,病变完全隔绝,无需再次干预的内漏,弓部开窗分支支架显影通畅。统计治疗期间相关并发症情况,术后随访行主动脉CTA 评估开窗支架通畅情况、有无内漏、支架变形移位等。
2 结果
2.1 治疗结果
所有患者均获手术成功,共植入Ankura 胸主动脉覆膜支架47 枚,Gore Viabahn 覆膜支架51 枚,Cordis Smart 裸支架20 枚。4 例术中转烟囱支架植入,原位开窗成功率91.5%(43/47),其中LSA 开窗29 例,LCCA 开窗+LSA 栓塞1 例,LSA 开窗+LVA烟囱1 例,LSA 开窗+LCCA 烟囱9 例,LCCA+LSA 开窗+IA 烟囱1 例,LCCA 开窗+IA 烟囱+LSA 栓塞2 例。全组患者手术时间160~300 min,平均(200±20)min,术中开窗时间18~45 min,平均(30±8)min;术后内漏(I 型)3 例,逆撕2 例(1 例行升主动脉置换后好转,1 例死亡),脑梗死2 例,其中1 例为胸主动脉溃疡患者行左颈总及LSA 双开窗,术后6 h 出现右上肢肌力3 级,言语障碍,颅脑CT 提示左颞叶局部脑梗死;另1 例为主动脉夹层行LSA 单开窗,术后4 h 右侧肢体肌力降低,患者拔管后反应较差,颅脑CT 示左侧额叶脑梗死。该2 例患者经营养神经对症治疗后病情好转。本组术后截瘫0 例。部分患者影像学资料见图1-2,全组患者开窗结果见表1。
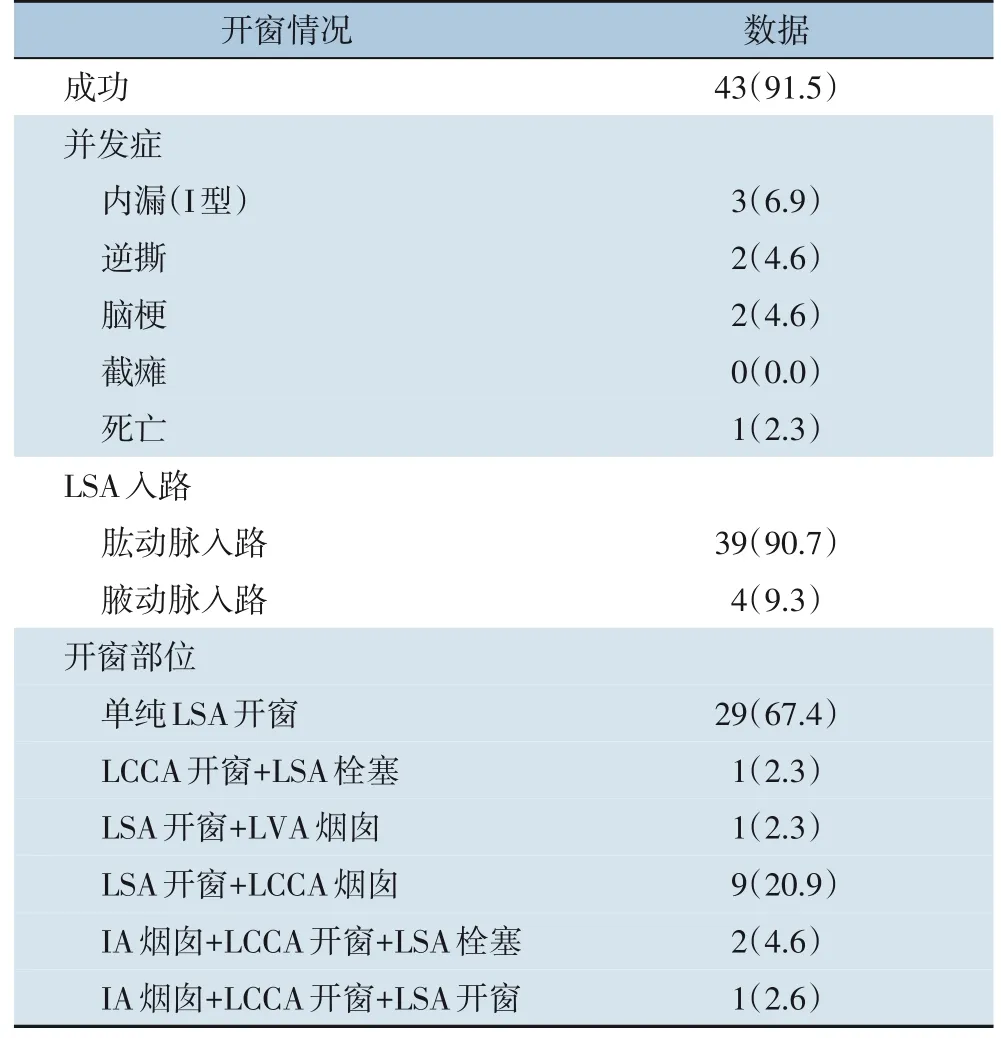
表1 本组患者开窗结果[n(%)]Table 1 The results of fenestration in this group of patients[n(%)]
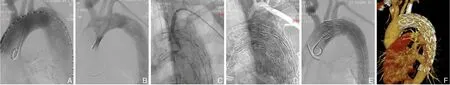
图1 术中与术后影像学资料1A:第一次术中造影;B:植入Ankura支架后造影;C:LSA原位穿刺破膜成功后小球囊扩展破膜处;D:LSA 置入开窗支架;E:最后造影见LSA 开窗重建良好;F:术后1年复查主动脉CTA 见支架形态良好,血管通畅Figure 1 The pre-and postoperative imaging data 1A:The first intraoperative angiography;B:Angiography after implantation of Ankura stent; C: The small balloon expansion of the opening after successful fenestration in the LSA; D: Placement of fenestration stent in the LSA; E:The well fenestrated and reconstructed LSA showed by final angiography; F:Aortic CTA at 1 year after operation showing the stent in good shape and the patent vessels
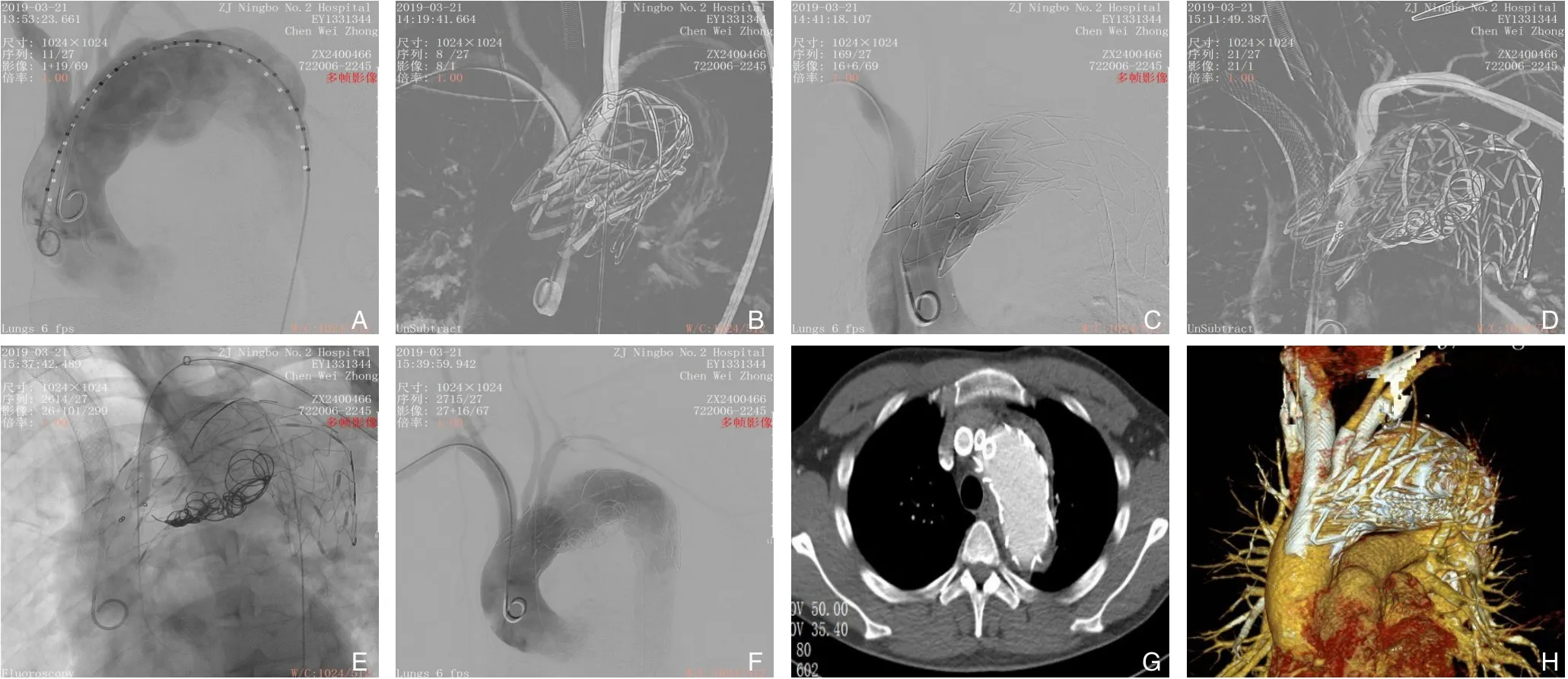
图2 术中与术后影像学资料2A:术中造影见主动脉瘤累及弓部且锚定区短;B:Ankura 支架植入后行LCCA 穿刺开窗;C:LCCA 完成开窗后造影;D:烟囱技术重建无名动脉(innominate artery,IA)后同期行LSA 开窗操作;E:LSA 穿刺成功予以小球囊进一步扩张破膜;F:最后造影,弓部三分支显影良好,未见明显内漏,其中LCCA及LSA原位开窗重建,IA烟囱重建,瘤腔部分弹簧圈栓塞;G-H:术后半年复查CTA的横断面及血管重建显示开窗分支支架通畅,瘤腔已隔绝满意Figure 2 The pre-and postoperative imaging data 2A:The intraoperative angiography showing the aortic aneurysm involving the arch and short landing zone; B: Fenestration of the LCCA after Ankura stent implantation; C: Ⅰntraoperative angiography after the LCCA fenestration; D: Simultaneous LSA fenestration after the reconstruction of the innominate artery(ⅠA)by chimney technique;E:Using a small balloon to further dilate the opening after successful puncture of the LSA;F:Final angiography showing clear display of the three branches of the aortic arch with no evident endoleak after reconstruction of the LCCA and LSA by in situ fenestration,reconstruction of the ⅠA by chimney,and partial embolization of the aneurysmal lumen by coil;G-H:The CTA cross section and reconstruction images showing patent branch grafts and satisfactory occlusion of the aneurysmal lumen
2.2 随访结果
所有病例术后3、6、12 个月及每年1 次复查主动脉CTA,本组患者术后均获得随访,平均随访时间(28.4±14.7)个月。其中2 例内漏在随访中消失,1 例内漏未进一步增大予以观察随访中,本组未见开窗分支血管闭塞。
3 讨论
早期,对于近端锚定区不足者行TEVAR 手术时,为延长支架锚定区,往往直接封盖LSA,但长期随访显示,其易引起椎动脉盗血综合征、上肢缺血、术后截瘫等风险[10-11],特别是LVA 优势者。为此,国内外学者[12-13]进行了多种术式的尝试,包括颈动脉-LSA 搭桥、烟囱支架、预开窗、分支支架等术式来重建LSA,虽说取得了一定的进展,但这些术式仍存在诸多不足,如存在创伤、术后支架堵塞率高、I 型内漏发生率高等问题。近些年,原位开窗技术的应用克服了上述不足,使得弓部分支的重建变得更加安全有效。
目前,临床上常用的原位开窗破膜工具包括各种穿刺针、激光探针和射频系统等[14-16]。然而,近些年的研究[17-19]发现,在行原位开窗时,对主体支架覆膜织物的损伤仍然是影响开窗效果及安全性方面的重要因素,特别是预扩张球囊在递增扩张的同时,较易引起主体支架覆膜织物的磨损及撕裂,而严重的织物撕裂很可能会降低主体覆膜支架材料的长期稳定性,造成支架内漏的风险加剧。Riga 等[20]提出,最高质量的开窗应该是圆形的,以更好地适应开窗分支支架的衔接,并且边缘没有撕裂。结合近些年的体外实验,研究[17-18]发现PTFE 膜材料制成的主体支架,开窗效果最为合适。PTFE 膜在开窗时易于穿刺、扩张,且扩张后的开窗部位形状更好,整体质量优于涤纶材料的覆膜大支架。但目前商品化的主动脉支架大多以后者材料为主,Ankura 支架的出现弥补了这一短板。Ankura 支架覆膜部分即为PTFE 材料组成,在开窗过程中穿刺破膜效果良好,而且结合先健公司自主研发的Fustar 长鞘辅助穿刺针进行穿刺破膜成功效率更高。本组开窗成功率高达91.5%,与其他国内外中心的其他主动脉支架相比未见明显降低[15,21-23]。
当然,在使用Ankura 支架进行原位开窗时,仍需把握以下几个关键要点。第一,术前结合影像资料重点评估弓部病变特征,严格掌握开窗适应证。术前需确认弓部分支受累情况及确定开窗数目,对于目标分支血管扭曲严重不适合开窗重建或开窗困难的患者需做好其他预案,本组4 例患者在行LSA 开窗时,由于血管扭曲严重,同期行烟囱支架植入。第二,术中寻找最佳穿刺位置,提高破膜成功率。笔者中心常规采用Fustar 长鞘配合单弯导管行多角度透视寻找最佳点位。同时,对于Ankura 支架在穿刺破膜时尽量避开支架加强筋位置及近端双层覆膜结构,以降低分支支架展开不佳或穿刺失败等弊端。破膜时,术者需尽可能抵住长鞘及穿刺设备,保持穿刺力量的有效传导,不至于穿刺针打偏、滑脱而降低破膜效率。第三,分支支架的释放定位及选择。对于开窗分支支架的选择笔者中心常采用覆膜支架进行分支重建,而对于分支支架释放后形态欠佳则予球囊后扩或内嵌裸支架以加固分支支架。此外,分支支架定位也尤为重要,特别是多个开窗重建时,分支支架近端勿深入主体支架内过长,减少对邻近分支血管的干扰而影响远期通畅率。
关于并发症方面,TEVAR 术后脑梗死的发生率约在5%以内[24-26]。本组术后2 例(4.6%) 患者出现脑梗死,与目前国内外报道一致。笔者分析对于第1 例胸主动脉溃疡患者,由于其本身弓部溃疡斑块较明显,术中操作时导丝及相关器械的剐蹭很可能导致部分斑块脱落诱发脑梗死;而第2 例患者,TEVAR 期间曾出现较长时间的低血压状态,很可能诱发术后脑梗死。因此,在运用Anukra 支架行原位开窗期间,如何有效降低脑梗死方面,笔者认为术前需仔细评估开窗血管病变情况,尤其是主动脉溃疡病变进行开窗重建时,注意斑块脱落造成缺血性脑卒中发生,当Ankura 支架置入后建议血压维持在至少140/80 mmHg 左右,以增强中枢神经系统的灌注压水平。同时术中需加强对颈动脉、椎动脉血供的保护,本组1 例患者术中椎动脉起自主动脉弓部,考虑椎动脉粗大,为预防术后脑卒中发生,同期行椎动脉重建,术后及随访效果良好[27]。在术后近端逆撕方面,报道显示其发生率约在4%以内[28-29]。目前来看,原位开窗并不能明显减少近端逆撕风险。本组2 例出现逆撕,笔者分析主要原因为该两例患者近端支架锚定区域不足且弓部角度过大,造成转角区血流剪切力增大明显,对支架的冲击也更大产生逆撕现象。
综上所述,利用穿刺破膜技术对Anukra 支架行原位开窗重建弓部分支血管是一种较为安全有效治疗方式。从现阶段看,对于累及弓部三分支动脉的主动脉病变其近期效果良好。当然,由于样本量有限,且其部分患者的中远期安全性方面仍有待更进一步的研究统计,这也是我们下一步的研究工作。

