53例银杏内酯注射液不良反应报告分析
黄 芳
(宁德市药品不良反应监测中心,宁德 352100)
银杏内酯注射液的主要成份为白果内酯、银杏内酯A、银杏内酯B和银杏内酯C等,临床可用于治疗中风病中经络(轻中度脑梗死)恢复期瘀血阻络证[1]。现代研究证实,银杏内酯具有抑制血小板聚集[2]、促进神经功能修复和重构以及抑制胶质细胞异常增殖和活化[3]等作用。通过检索宁德市上报国家药品不良反应监测系统数据发现,截至2019年11月31日尚无涉及银杏内酯注射液的药品不良反应(adverse drug reactions,ADR)报告,自2019年12月开始有所增加。这可能与银杏内酯注射液的临床应用范围扩大、医护人员主动报告意识增强等因素有关,但也提示其可能存在一定的安全性风险。本文通过对2019年12月~2021年6月期间宁德市上报国家药品不良反应监测系统的53例疑似涉及银杏内酯注射液的ADR报告进行统计与分析,研究其发生规律及特点,以期为临床合理用药提供依据。
1 资料与方法
1.1 资料来源
按照《药品不良反应术语使用指南》(2016版)中规定的药品不良反应技术规范及关联性评价标准,对2019年12月~2021年6月期间宁德市上报国家药品不良反应监测系统的银杏内酯注射液ADR报告内容进行逐项审核、评价,排除无效和重复报告后,共筛选出银杏内酯注射液致ADR报告53例,其关联性评价结果为“很可能”或“可能”。
1.2 方法
采用回顾性研究分析方法,应用Excel 2016软件,对53例ADR报告中的信息从性别与年龄、原患疾病、用法用量、联合用药情况、ADR发生时间、ADR累及系统/器官及主要临床表现、ADR报告类型及转归、严重ADR等方面进行分类整理与统计分析。
2 结果
2.1 性别与年龄分布情况
53例ADR报告中,男性20例(37.74%),女性33例(62.26%),男女比例为0.61∶1;年龄最小者27岁,最大者93岁,45岁及以上的患者51例(96.23%)。见表1。
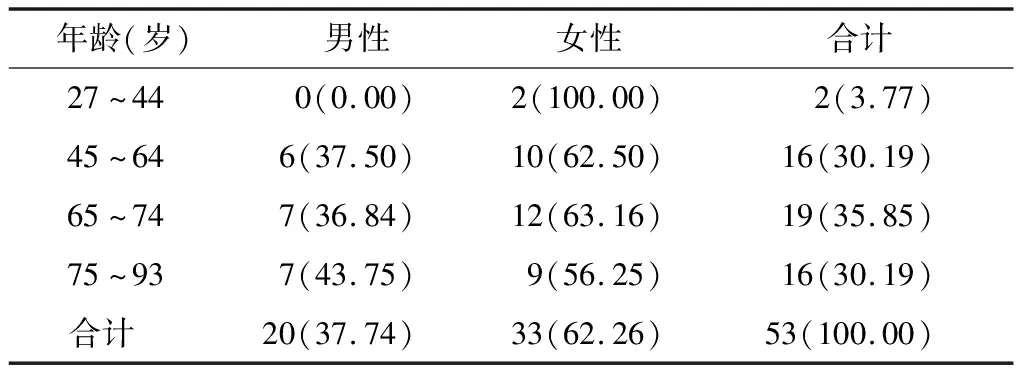
表1 银杏内酯注射液致ADR患者的性别与年龄分布 n(%)
2.2 原患疾病情况
53例ADR报告中,原患疾病主要为腔隙性脑梗死、脑卒中或患者处于脑血管病恢复期等(39例,73.58%),应用银杏内酯注射液以活血化瘀、通经活络、改善微循环等。超功能主治用药14例(26.42%),其原患疾病主要为头晕和眩晕、偏头痛、视神经炎、肺部恶性肿瘤、股骨粗隆间骨折、腰椎退化性病变、椎基底动脉综合征、颈椎病、盆腔炎、肝硬化水肿等。
2.3 用法用量
53例ADR报告中,均采用0.9%氯化钠注射液或5%葡萄糖注射液作为溶媒稀释后静脉滴注,每日一次。49例(92.45%)严格按照药品说明书要求,将银杏内酯注射液10 ml加入到上述溶媒250 ml中稀释后使用;4例(7.55%)在银杏内酯注射液或溶媒的用量上与药品说明书中记载不一致,如取银杏内酯注射液4 ml加入溶媒100 ml或取6 ml加入溶媒250 ml稀释后使用。此外,有4例(7.55%)在ADR过程描述中提示用药滴速且符合要求,其他报告均未作特别说明。
2.4 联合用药情况
53例ADR报告中,5例(9.43%)涉及联合用药,其中联合蕲蛇酶注射液2例(40.00%),天麻素注射液、盐酸纳洛酮注射液、吡拉西坦氯化钠注射液各1例(20.00%)。患者均在上述药品静脉滴注完毕后,给予银杏内酯注射液时出现ADR。
2.5 ADR发生时间
53例ADR报告中,有2例(3.77%)患者连续用药2天均出现ADR,第1次ADR症状好转或消失后,第2天用药过程中或结束后再次出现同样临床表现,分别按2例次ADR统计,故ADR发生总频次按55例次计。其中ADR发生在患者用药第1天的28例次(50.91%),发生在用药过程中的48例次(87.27%)。最早1例ADR发生在首剂用药5 min后,最长1例发生在连续用药第8天给药19 min后。见表2。
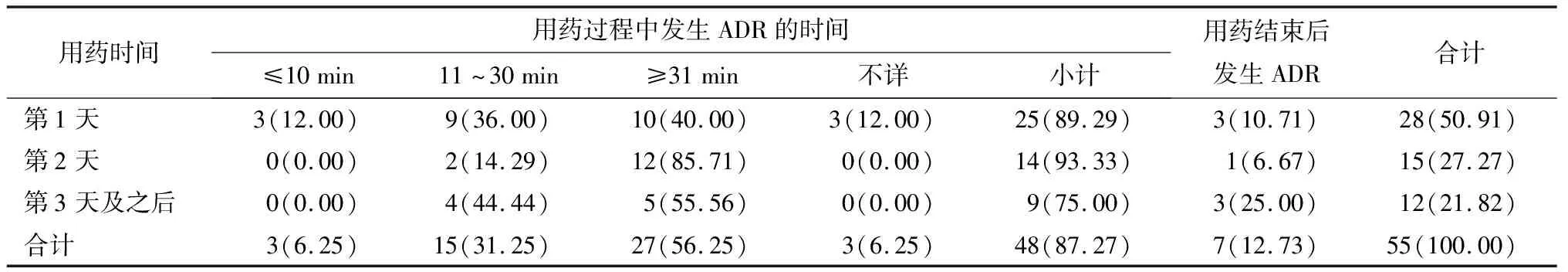
表2 银杏内酯注射液致ADR发生时间分布 n(%)
2.6 银杏内酯注射液致ADR累及系统/器官及主要临床表现
53例ADR报告共涉及临床表现128例次,累及血管与淋巴管类疾病(35例次,27.34%)、呼吸系统、胸及纵隔疾病(23例次,17.97%)、各类神经系统疾病(19例次,14.84%)、心脏器官疾病(14例次,10.94%)、皮肤及皮下组织类疾病(13例次,10.16%)等多个系统/器官。其中新的ADR临床表现86例次(67.19%)。主要临床表现见表3。

表3 银杏内酯注射液致ADR累及系统/器官及主要临床表现
2.7 ADR报告类型及转归
53例ADR报告中,报告类型为已知一般ADR报告7例(13.21%);新的一般ADR 42例(79.25%);新的严重ADR 4例(7.55%)。52例(98.11%)ADR报告在停止输液、休息或经干预治疗后均治愈或有所好转;1例(1.89%)严重ADR报告未好转且转院治疗。
2.8 严重ADR报告
53例ADR报告中,有4例(7.55%)出现严重ADR,其中发生在用药第1天的有3例(75.00%);发生在用药过程中、用药结束后的各2例。共涉及临床表现17例次,除了常见于一般病例中的面部潮红、胸闷、气促、气喘、心悸等症状外,还突出表现为血压升高、不自主运动、局限性抽搐、烦躁、意识模糊、反应迟钝、过敏性皮炎等。严重ADR的临床表现及发生时间分布见表4。

表4 银杏内酯注射液致严重ADR的临床表现及发生时间
3 讨论
3.1 银杏内酯注射液致ADR发生特点
3.1.1与患者年龄、性别的关系
本研究结果表明,53例ADR报告中女性多于男性;45岁以上的患者占96.23%,其中以65岁以上的老年患者为主,该结果与已有研究报道[4]一致。随着患者年龄的增长,其机体脏器的退行性变化、药物代谢与排泄能力下降、基础疾病多、多重用药现象普遍等可能是导致ADR易发的原因[5]。此外,本研究结果表明75岁以上患者占30.19%,但药品说明书提示该药尚未在75岁以上的老年人中进行临床试验,针对这一人群的有效性和安全性还无法确定,因此建议临床需加大对中老年患者尤其是75岁以上老年人的用药监护。
3.1.2临床用药情况
本研究结果表明,ADR报告中银杏内酯注射液超功能主治用药达26.42%,用于治疗头晕和眩晕、视神经炎、腰椎退行性病变、椎基底动脉综合征、颈椎病等,有文献也报道过此类不合理用药情况[6]。这可能是受银杏叶提取物注射液临床应用的干扰,《银杏叶提取物注射液临床应用中国专家共识(2019)》[7]中推荐银杏叶提取物注射液用于治疗眩晕、耳鸣、糖尿病性视网膜病变等临床疾病。两者虽同属银杏叶注射制剂,但药品说明书载明的功能主治和适应症均有较大差别,对上述疾病应用银杏内酯注射液治疗的安全性和有效性也还无法确定。
有4例(7.55%)ADR报告虽未严格按照药品说明书要求配液,但无超剂量使用情况。有研究提示[8],银杏内酯注射液致ADR可能与输液速度等因素有关。因本研究大部分ADR报告缺乏对用药期间滴速情况的描述,故其相关性无法确定。
药品说明书提示银杏内酯注射液尚无药物相互作用相关研究,严禁混合配伍,谨慎联合用药。有研究表明,银杏内酯注射液联合注射用吡拉西坦可促进缺血性脑卒中所致智能及认识功能障碍的恢复[9]、银杏达莫注射液联合蕲蛇酶注射液[10]或联合盐酸纳洛酮注射液[11]可治疗急性脑梗死、银杏叶提取物注射液联合天麻素注射液可治疗血源性眩晕[12],联合用药的疗效较单用银杏叶注射用制剂更好且不良反应轻微。本研究中5例联合用药的ADR报告中也均为一般症状。建议在确需联合应用中药注射剂时,注意药物的使用间隔,并选择适宜溶媒进行冲管,以减少ADR的发生[13]。
3.1.3ADR发生时间
本研究结果表明,ADR可发生于患者用药第1天或连续用药中,且大多数发生在静脉滴注过程中。严重ADR发生时间的统计结果也基本呈现同样规律。因此,在整个用药疗程(14天)中对患者首剂和连续用药都应予以关注,尤其应加强患者用药过程监测,密切关注用药情况。如有异常,应立即停药并积极采取处理措施。
3.1.4ADR累及系统/器官及主要临床表现
本研究中银杏内酯注射液致ADR累及的多个系统/器官及主要临床表现与银杏叶制剂文献报道[14-15]基本一致。血管与淋巴管疾病主要表现为面部潮红、血压升高等;呼吸系统、胸及纵隔疾病主要表现为胸闷、气促、气喘等;各类神经系统疾病主要表现为头晕、头痛等;心脏疾病主要表现为心悸、心慌等;皮肤及皮下组织疾病主要表现为皮疹、瘙痒、过敏性皮炎等;胃肠系统疾病主要表现有恶心、呕吐、口干、上腹不适等。张林生、夏莉君也报道过银杏内酯注射液可引起头晕、心悸、胸闷等ADR[16-17]。
银杏叶类制剂致ADR可能与银杏叶提取物中残留的银杏酸有关[18],银杏酸可引起过敏反应、神经毒性、细胞毒性、抑制谷氨酸转化为抑制性神经递质γ氨基丁酸等[19]。2020年版《中国药典》也加大了对银杏叶提取物中杂质总银杏酸含量限度的控制,要求不得超过5 mg/kg。有文献还提示,有些银杏产品中含有的银杏毒素可能增加癫痫发作的危险[20]。因此,应加强对总银杏酸等杂质含量限度及银杏毒素的控制研究,持续改进生产工艺,提高银杏内酯注射液的安全性。另有研究提示[21],一些肿瘤科患者在使用多西他赛注射液进行抗癌治疗过程中会出现气喘、胸闷、面部潮红、兴奋躁动、荨麻疹等ADR,推测可能是多西他赛注射液中的辅料乙醇导致患者发生醉酒感或乙醇中毒,但银杏内酯注射液致ADR是否与其辅料有关,还有待进一步证实。临床用药前应详细了解患者对银杏类制剂的主要成份或乙醇、甘油等辅料的过敏史,以减少因成份过敏导致的ADR。
3.2 建议
临床应用中药注射剂的过程中,遴选药品不适宜、联合用药不当、滴速过快及超剂量使用、溶媒不当等不合理用药都会导致ADR的发生[22]。因此,医疗机构应严格按照《中药注射剂临床使用基本原则》中的有关要求,加强银杏内酯注射液的临床使用管理,并在中医药理论指导下安全用药,辨证施治;建立银杏内酯注射液合理用药评价标准[23],切实发挥临床药师在合理用药干预中的积极作用[24];加强用药过程监测,密切观察用药反应,及时发现ADR并采取治疗措施,以保障患者用药安全。
药品说明书是指导临床合理用药的主要依据。但对比2019年12月12日新修订的银杏内酯注射液药品说明书发现,不良反应项的内容仅载明该品种临床试验期间发现的ADR信息,缺乏药品上市后安全性研究相关内容。《药物警戒质量管理规范》于2021年12月1日起正式施行,该规范对药品上市许可持有人在药品不良反应监测与报告、风险识别与评估、风险控制等方面也提出了更高要求。建议药品上市许可持有人主动跟踪药品上市后的安全性情况,根据不良反应监测数据、相关安全性研究及文献报道等相关安全性信息,及时修订完善药品说明书中的相关内容。
4 结语
本研究中收集的银杏内酯注射液ADR报告均由宁德市辖区内医疗机构主动上报,报告真实且内容较为完整、准确,能够客观地反映银杏内酯注射液在临床使用中出现的安全性问题,分析结果较为可靠。但因纳入研究的ADR报告数量有限且上报地区范围较窄等,研究还存在一定局限性,相关结果仍有待进一步验证。

