牡蛎蛋白源钙离子螯合肽的制备与性质分析
郭利娜,宫 强,张 彬,陈艳楠
(河南科技大学 食品与生物工程学院,河南 洛阳471023)
牡蛎是全世界分布和养殖范围最广的海洋生物之一,其含有丰富的蛋白质、维生素和矿物质,以及海洋生物特有的多种活性物质,营养价值丰富[1]。我国是牡蛎养殖大国,其年产量可达487.9万t,分别占全国海水养殖产量和贝类产量的24.4%和34.0%[2]。目前,我国牡蛎产品主要以鲜食或肉干产品为主,高附加值加工技术仍有待开发。
牡蛎中蛋白质含量较高,通常占牡蛎肉干的45%~57%[3],其水解后所产生的多肽显示出多种生物活性,其中已报道的牡蛎蛋白源活性肽包括血管紧张素转化酶抑制肽[4]、抗菌肽[5]、抗癌肽[6]、Zn-螯合肽[7]等。因此,使用牡蛎蛋白开发具有良好生物活性的多肽产品为提高牡蛎附加值利用提供了重要思路。
钙是人体中重要的微量元素,钙缺乏将导致骨质疏松,甚至诱发高血压、肾结石和结肠癌等疾病[8]。目前,钙缺乏的治疗依赖于钙补充剂,特别是有机钙补充剂的使用。作为有机钙补充剂中的一种,肽-钙螯合物的研究越来越受到重视。当作为钙的递送载体使用时,肽具有运输速度快、能量消耗少等优势[9]。近年来,已从多种来源的蛋白,包括鹅骨胶原蛋白[10]、大豆蛋白[11]、酪蛋白[12]和小麦胚芽蛋白[13]制备获得了钙-肽螯合物。然而,目前针对牡蛎蛋白源钙离子螯合肽的研究较少。因此,基于实验室前期对牡蛎肽活性的筛选,通过酶解法从牡蛎蛋白制备了钙离子螯合肽并对酶解产物进行了性质分析,从而为牡蛎蛋白的高附加值利用提供了重要科学依据。
1 材料与方法
1.1 试剂
牡蛎蛋白,陕西一诺生物科技有限公司提供;风味蛋白酶(Flavourzyme)、碱性蛋白酶(Alcalase 2.4l)、复合蛋白酶(Protamex)、中性蛋白酶(Neutrase),诺维信公司提供;胃蛋白酶、胰蛋白酶和邻甲酚酞络合酮,Sigma-Aldrich公司提供;木瓜蛋白酶,上海阿拉丁生化科技股份有限公司提供;细胞色素C、抑肽酶、杆菌肽、亮抑酶肽、丙谷二肽,生工生物工程(上海)股份有限公司提供;色谱纯乙腈,赛默飞世尔科技有限公司提供;其他试剂均为分析纯,天津市德恩化学试剂有限公司提供。
1.2 仪器
L5S型紫外分光光度计,上海精密科学仪器有限公司产品;Eclassical 3100型高效液相色谱仪,大连依利特分析仪器有限公司产品。
1.3 蛋白酶的筛选
蛋白酶的最适温度和pH值见表1。

表1 蛋白酶的最适温度和pH值
使用胰蛋白酶、胃蛋白酶、复合蛋白酶、碱性蛋白酶、中性蛋白酶、风味蛋白酶和木瓜蛋白酶,对牡蛎蛋白进行水解研究。具体试验条件如下:在各个蛋白酶的最适温度和最适pH值条件下,以5%的底物质量分数,1/50的酶/底物比(E/S),在恒温水浴振荡器上水解4 h。水解结束后,加热煮沸反应混合物5 min以终止反应,并将混合物以转速10 000 r/min离心10 min,取上清液测定水解度和钙螯合率。综合考虑水解度和钙螯合率两者,选择风味蛋白酶进行后续优化研究。
1.4 风味蛋白酶水解牡蛎蛋白的单因素试验
按照1.3中所述的方法,通过单因素试验优化风味蛋白酶水解牡蛎蛋白的过程,具体方法如下:使用特定底物质量分数(2%,4%,6%,8%,10%)和E/S(1∶100,1∶66.7,1∶50,1∶40,1∶33.3),在一定温度(35,40,45,50,55,60℃)和pH值(4.0,5.0,6.0,7.0,8.0)条件,水解一定时间(1,2,3,4,5,6 h)。水解结束后,加热煮沸反应混合物5 min以终止反应,并将混合物以转速10 000 r/min离心10 min,取上清液测定水解度和钙螯合率。
1.5 水解度的测定
采用OPA法测定蛋白水解度[14],具体方法如下:将100 mmol/L的四硼酸钠溶液25 mL、5% SDS溶液10 mL、水13.9 mL,OPA溶液1 mL、0.1 mL β-巯基乙醇混合以制备OPA测定溶液。取50 μL测试样品与2 mL OPA测定溶液混合并在室温下反应8 min。反应结束后,于波长340 nm处测定反应物的吸光度。以甘氨酸-甘氨酸二肽作为标准品建立标准曲线,并根据标准曲线测定水解前(C1)和水解后(C2)反应混合物中的氨基含量。基于公式(1)测定蛋白水解度DH:
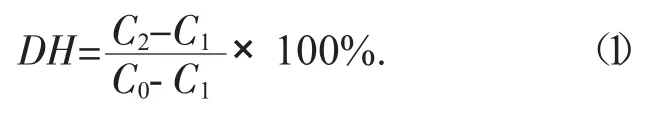
式中:C1——水解前蛋白中的游离氨基含量,mol/L;
C2——水解后反应混合物中的游离氨基浓度,mol/L;
C0——总氨基含量(根据凯氏定氮法测定)。
1.6 钙螯合率的测定
参考Zhao L等人[15]的方法测定钙螯合率,具体步骤如下:将5 mmol/L的氯化钙溶液1 mL和0.2 mol/L pH值8.0的磷酸盐缓冲液2 mL混合,然后向其中加入多肽样品1 mL。将混合物在空气浴振荡器中,在37℃下反应2 h。反应结束后,将混合物以转速10 000 r/min离心10 min。离心结束后,以标准钙离子溶液建立标准曲线,使用邻甲酚酞络合比色法测定上清液中的钙离子含量,并根据公式(2)计算钙离子螯合率:

1.7 多肽的分子量分布
通过高效液相色谱法[16]测定水解多肽的分子量分布,具体方法如下:使用配备有紫外检测器的依利特Eclassical 3100型高效液相色谱,使用TSKgel 2000 SWXL型凝胶色谱柱(300 mm×7.8 mm),以乙腈∶水∶三氟乙酸(体积比为45∶55∶0.1)作为流动相,在进样量20 μL,流速0.5 mL/min,柱温37℃的条件下,于波长214 nm处测定吸光度。使用细胞色素C(12 362 Da)、抑肽酶(6 511.4 Da)、杆菌肽(1 423 Da)、亮抑酶肽(475.59 Da)、丙谷二肽(146.145 Da)作为标准品,以分子量对数(lg MW)为纵坐标,以样品保留时间为横坐标建立标准曲线,并计算样品分子量分布。
1.8 DPPH自由基清除活性
参考刘龙等人[17]的方法,如下所述进行DPPH自由基清除活性的测定:将DPPH溶解于无水乙醇,使其最终浓度为0.1 mmol/L(现用现配)。将0.5 mL牡蛎肽-钙离子螯合物和牡蛎肽溶液与2.5 mL DPPH溶液混合,避光静置30 min,以无水乙醇为参比,于波长517 nm处测定吸光度A1。同时,测定0.5 mL无水乙醇与2.5 mL DPPH溶液混合后的吸光度A2,和0.5 mL样品溶液与2.5 mL无水乙醇混合后的吸光度A3。则DPPH自由基清除率按公式(3)计算为:
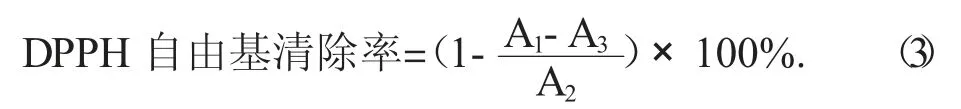
2 结果与分析
2.1 蛋白酶的筛选
首先比较了不同蛋白酶对牡蛎蛋白的水解度和水解产物的钙离子螯合率的影响。使用风味蛋白酶、胰蛋白酶、木瓜蛋白酶和复合蛋白酶水解后所获得的牡蛎多肽的钙离子螯合率较高,均在25%以上;使用复合蛋白酶、碱性蛋白酶、中性蛋白酶和风味蛋白酶时,牡蛎蛋白的水解度较高,均大于30%。从水解度角度考虑,水解度越高则所产生的多肽片段数越多,同时所产生的多肽长度则越短,因此越利于吸收;而从钙离子螯合率角度来看,由于不同蛋白酶的作用位点不同,因此水解产物显示出不同的氨基或羧基末端,因而具有不同的高级结构并显示出不同的螯合率。由于研究的目的在于筛选高钙离子螯合肽,因此在优先考虑钙离子螯合率并兼顾水解度的情况下,选择风味蛋白酶用于后续研究。
蛋白酶种类对水解度和螯合率的影响见图1。
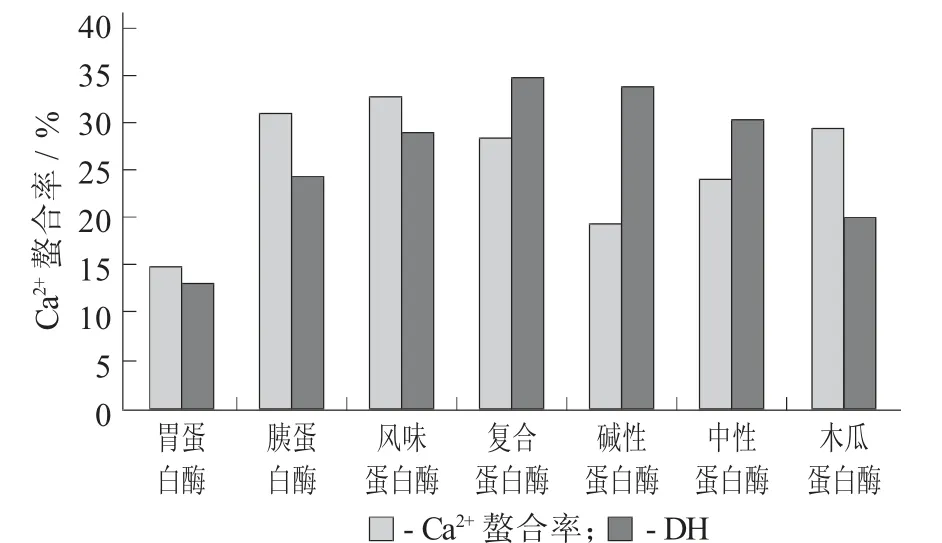
图1 蛋白酶种类对水解度和螯合率的影响
2.2 风味蛋白酶水解牡蛎蛋白的单因素试验
2.2.1 底物质量分数的影响
底物质量分数对水解度和螯合率的影响见图2。
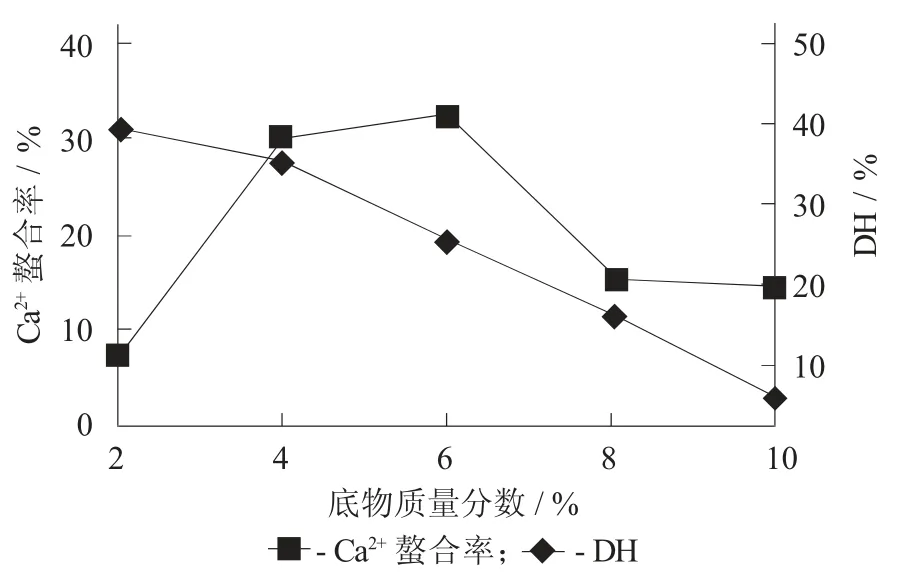
图2 底物质量分数对水解度和螯合率的影响
随着底物质量分数的升高,牡蛎蛋白的水解度逐渐降低,而钙离子螯合率则呈现出先升高再降低的趋势。在底物质量分数较小时,蛋白质的水解度较高,因此水解片段中存在较多氨基酸,不利于钙离子螯合;而在高质量分数下,水解度显著降低,所产生的水解片段长度加大,甚至一些钙离子结合位点可能未充分暴露,导致钙离子螯合率降低。因此,选择6%的底物质量分数进行后续试验。
2.2.2 E/S的影响
E/S对水解度和螯合率的影响见图3。
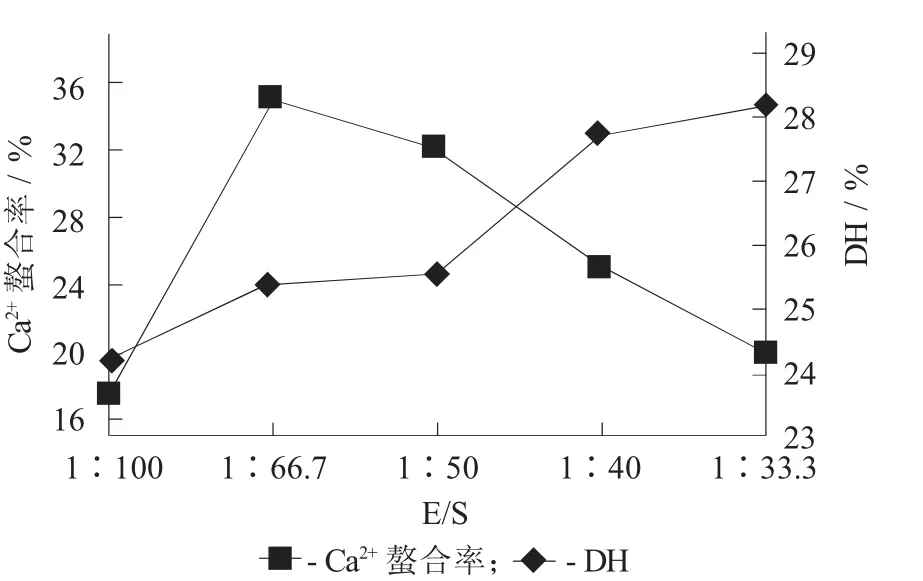
图3 E/S对水解度和螯合率的影响
随着E/S升高,用于反应的蛋白酶逐渐增加,反应速度加快,水解度升高。从钙离子螯合率来看,当E/S=1∶66.7时,钙离子螯合率最大,显示出水解度的变化导致了水解产物组成的显著改变,从而对钙离子螯合率有较大影响。因此,选择E/S=1∶66.7进行后续试验。
2.2.3 水解时间的影响
水解时间对水解度和螯合率的影响见图4。
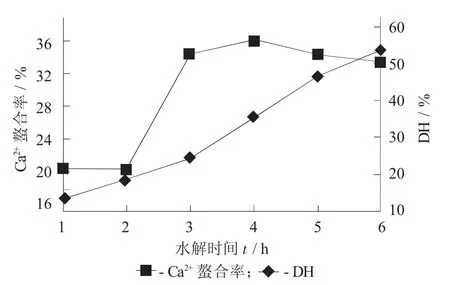
图4 水解时间对水解度和螯合率的影响
随着反应时间的延长,水解度逐渐升高,而钙离子螯合率在前4 h逐渐升高,随后轻微降低。张文婷[18]和庞忠莉[19]分别在研究蓝圆鲹和牡蛎水解产物对二价铁离子的结合中发现随着水解时间的延长,水解度逐渐升高,而金属离子螯合率则随水解时间先升高并随后保持基本不变,该趋势与研究结论类似。因此,选择水解4 h作为最优条件进行后续试验。
2.2.4 水解温度的影响
水解温度对水解度和螯合率的影响见图5。
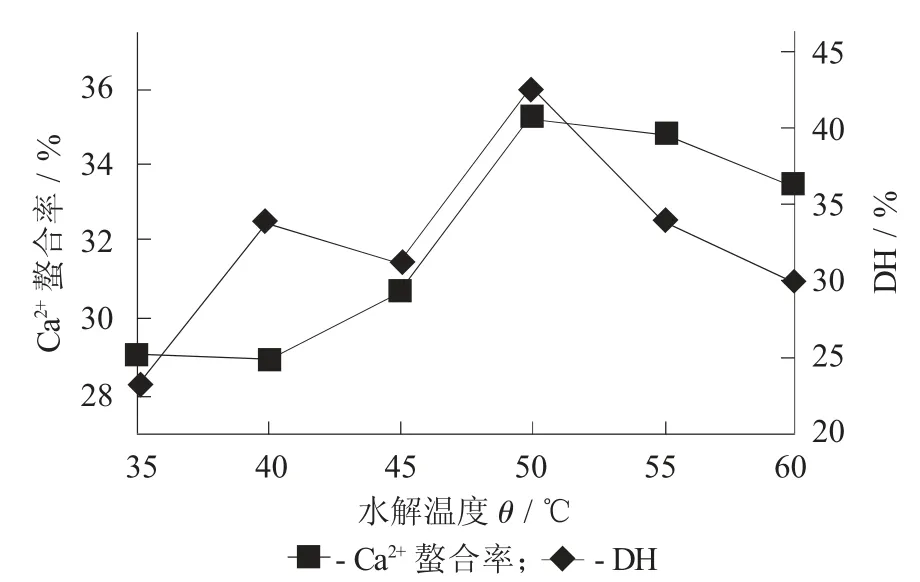
图5 水解温度对水解度和螯合率的影响
由图5可以看出,水解度在50℃时达到最大,这与风味蛋白酶的最适水解温度一致。在该温度下,钙离子螯合率也达到最大。因此,选择50℃作为最优条件进行后续试验。
2.2.5 pH值的影响
pH值对水解度和螯合率的影响见图6。
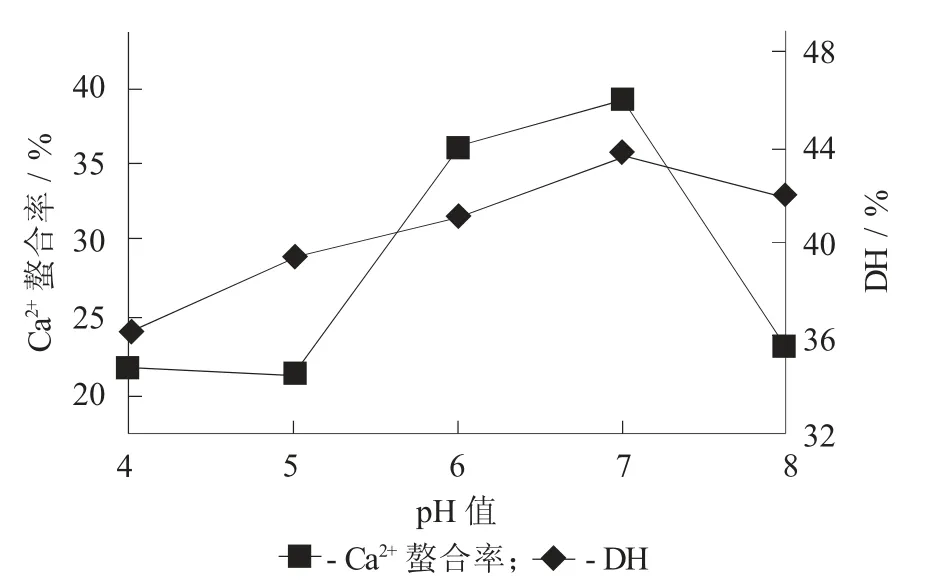
图6 pH值对水解度和螯合率的影响
由图6可以看出,水解度在pH值7.0时达到最大,这与风味蛋白酶的最适水解pH值(6.0)有所偏差,表明以牡蛎蛋白作为底物时,风味蛋白酶的最适pH值为7.0。同时,钙离子螯合率在pH值7.0时也达到最大。通过单因素优化试验,确定当底物质量分数为6%,E/S=1∶66.7时,在温度50℃,pH值7.0条件下水解4 h,此时钙离子螯合率达到38.98%,水解度达到43.6%。
2.3 牡蛎肽的分子量分布
牡蛎肽的分子量分布图见图7。
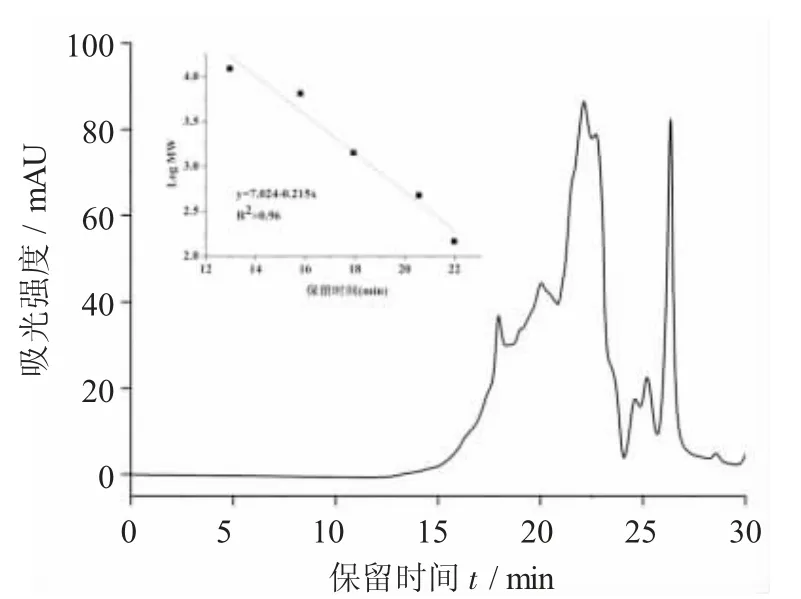
图7 牡蛎肽的分子量分布图
通过高效液相排阻色谱法测定了牡蛎肽的分子量分布。根据液相色谱结果,通过标准曲线计算曲线下面积得到了牡蛎肽的具体分子量分布范围(见表2),结果表明绝大部分的牡蛎肽的分子量小于1 kDa,从而表明水解后的多肽以约八肽或更小的多肽为主。研究表明,分子量分布与钙离子结合能力有关,具有钙离子结合能力的肽的分子量通常小于2 kDa,这从一个方面解释了试验中所获得的牡蛎肽的高钙离子结合能力[20]。
牡蛎肽的分子量分布见表2。
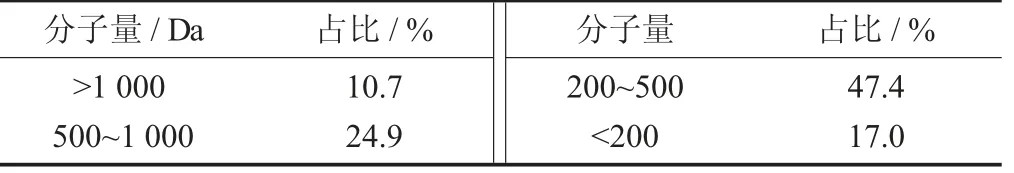
表2 牡蛎肽的分子量分布
2.4 DPPH自由基清除活性
钙离子螯合肽的DPPH自由基清除能力见图8。
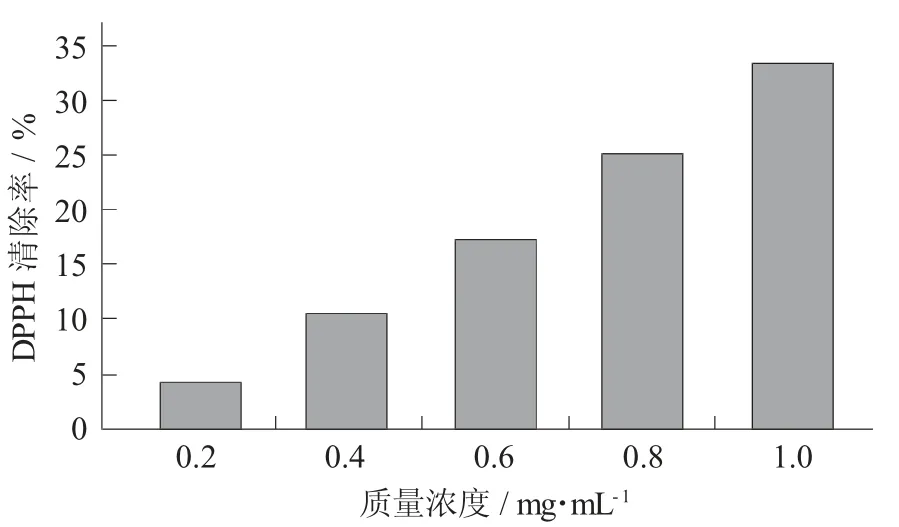
图8 钙离子螯合肽的DPPH自由基清除能力
由图8可以看出,所制备的牡蛎肽除能够与钙离子螯合外,其还具有一定的抗氧化能力,在1.0 mg/mL条件下,其DPPH自由基清除率达到33.5%,因此具有良好的应用价值。
3 结论
(1)以水解度和螯合率为指标,通过水解试验,筛选出风味蛋白酶作为最适于制备牡蛎蛋白源钙离子螯合肽的蛋白酶。
(2)通过单因素试验研究了使用风味蛋白酶从牡蛎蛋白制备钙离子螯合肽的方法,结果表明当底物质量分数为6%,酶∶底物(E/S)比为1∶66.7时,在温度50℃,pH值7.0条件下水解4 h,钙离子螯合率达到38.98%,水解度达到43.6%。
(3)通过高效液相排阻色谱法测定了钙离子螯合肽的分子量分布,结果显示绝大部分牡蛎肽的分子量分布范围在1 kDa以下,表明水解后所获得的多肽以八肽或更小的多肽为主。
(4)通过DPPH自由基清除试验显示,1 mg/mL的钙离子螯合肽的DPPH自由基清除率达到33.5%,表明试验所制备的牡蛎蛋白源钙离子螯合肽不仅可以作为钙补充剂使用,同时还具有一定的抗氧化作用。

