山茱萸果实发育过程中单宁物质的分布与积累特征
陈旋勐,张 岗,高 静,颜永刚,魏 瑶,陈 莹
(陕西中医药大学 药学院/陕西省秦岭中草药应用开发工程技术研究中心,陕西咸阳 712046)
山茱萸为山茱萸科植物山茱萸(CornusofficinalisSieb.et Zucc.)的干燥成熟果肉,又称山萸肉,是中国大宗道地中药材品种之一[1],主产于陕西、山西、河南、甘肃等地[2]。山茱萸味酸涩,性微温,具有补益肝肾,收涩固脱等功效,常用于治疗眩晕耳鸣、腰膝酸痛、阳痿遗精、遗尿尿频、崩漏带下、大汗虚脱、内热消渴等症[3]。山茱萸化学成分主要包含多糖、有机酸、酚类、苷类、环烯醚萜苷、皂苷、鞣质等[4-5]。现代药理学研究表明,山茱萸在抗炎、糖尿病的防治、心脑血管的保护、神经保护、抗肿瘤、抗氧化和抗衰老等方面均表现出较好的活性[5-7]。
单宁,又名单宁酸、鞣酸,是广泛存在于植物体内的次生代谢产物,在植物防紫外线以及抵御病原体侵害等方面都发挥着重要的作用[8]。除此之外,单宁物质能与人体口腔黏膜蛋白结合产生强烈的收敛性,引起“涩感”,过量的单宁摄入后,单宁会与唾液蛋白酶及肠胃中的膳食蛋白质发生交联,导致蛋白质代谢紊乱,影响蛋白质的可消化性和利用率[9];但单宁的适量摄入对多种酶和病菌具有明显的抑制作用[10]。单宁的存在是导致果实涩感的主要原因,与山茱萸果实“味酸涩,性微温”的性味特点相一致。目前,对山茱萸的研究主要集中在炮制加工、化学成分的提取测定、质量评价、药理作用及临床应用等方面[11-14],而对于山茱萸果实中单宁物质的研究报道较少。廖景平等[15]在对山茱萸果皮的解剖学研究中提到单宁主要积累在山茱萸果实中果皮体积膨大的薄壁细胞,即单宁细胞中。乔琦等[16]研究发现山茱萸中果皮的色素块中积累了高浓度的皂甙类和多糖等药用成分。植物中单宁的含量会受到遗传、环境变量以及植物成熟度等多方面的影响[17-20]。但是,对于山茱萸果实发育过程中单宁细胞发育及单宁物质的积累形式仍缺乏深入研究,本实验选取不同发育时期的山茱萸果实作为研究对象,对山茱萸果实发育过程中单宁物质的分布、单宁含量和单宁细胞数目变化以及单宁物质积累特点进行探究,为深入研究山茱萸果实涩味调控机制奠定实验基础。
1 材料和方法
1.1 实验材料
山茱萸果实为2018年3月至今采自于陕西中医药大学药用植物园15年生的健康山茱萸植株,经陕西中医药大学颜永刚教授鉴定为山茱萸科山茱萸属的山茱萸。
1.2 实验方法
1.2.1 果实形态观察在光学显微镜Nikon SMZ745T下对山茱萸果实发育过程中果实的外部形态及内部结构变化进行观察并拍照记录。
1.2.2 石蜡切片法使用50% FAA固定液对所采集的山茱萸果实固定,梯度酒精逐级脱水,二甲苯透明,浸蜡,包埋,Lecia RM2135型手摇式切片机切片,切片厚度8 μm~10 μm,在40 ℃的电热鼓风干燥箱中烘片,番红-固绿染色,中性树胶封片,在Leica DM750 型光学显微镜下观察,并拍照记录。
1.2.3 组织化学染色单宁显色反应:三氯化铁中的铁离子能够与单宁中的酚羟基结合,发生显色反应。取脱蜡后的山茱萸果实纵切片,在三氯化铁溶液中浸染25~30 min,用Leica DM750 型显微镜观察染色结果,并拍照记录。用以鉴别单宁物质在山茱萸果实中的分布。
过碘酸-Schiff试剂在组织学上可以用来检测组织中的多糖物质,高碘酸是一种氧化剂,能够将多糖分子中相邻的二醇基氧化成二醛基,醛基能与Schiff试剂反应生成红色不溶性复合物。取脱蜡后的山茱萸果实纵切片,在过碘酸液中浸染10 min,自来水冲洗10 min,Schiff试剂染色10 min,流水冲洗5 min,用Leica DM750 型显微镜观察染色结果,并拍照记录。
1.2.4 透射电镜法使用Adobe Photophoto CC作图示意山茱萸果实透射电镜的取样部位,将不同发育时期山茱萸果实中果皮部分果肉(图1所示区域)切成2~3 mm的小块,使用2.5%的戊二醛固定液(pH=7.0的磷酸缓冲液配置)4 ℃预固定24 h,然后使用磷酸缓冲液漂洗3次,每次20 min,0.5%的锇酸(pH=7.0的磷酸缓冲液配置)固定2 h,用磷酸缓冲液漂洗3次,每次20 min,梯度酒精脱水,环氧丙烷过渡,Epon812包埋剂包埋,60 ℃烘箱聚合24 h,使用Leica EM UC7超薄切片机切片,切片厚度为1~2 μm,制成半薄切片,经甲苯胺蓝染色,Leica DM750显微镜观察并拍照。根据半薄切片定位情况,使用Leica EM UC7超薄切片机对包埋好的样品进行切片,切片厚度为60~80 nm,经醋酸双氧铀和柠檬酸铅双染色,在日立透射电子显微镜H-7650下观察并拍照。
1.2.5 含量测定可溶性单宁含量测定采用Folin-Ciocaileu法,参考Ikegami[21]和张凡[22]等的方法。取5.0 g山茱萸果肉,以80%甲醇溶液为提取液,按照样品质量(g):提取液体积(mL)为1∶4的比例处理样品,充分匀浆后转入EP管中;5 000 r/min,常温离心10 min,取上清液至50 mL容量瓶中,以20 mL 80%甲醇清洗残渣,重复上述步骤,在50 mL容量瓶中定容;随后移至500 mL的容量瓶中定容将其稀释10倍;取1 mL样品,加入7.5 mL蒸馏水和0.5 mL酚类试剂,3 min后加入1 mL饱和碳酸钠,1 h后在746 nm下测定吸光度,由单宁酸标准曲线计算对应单宁含量。
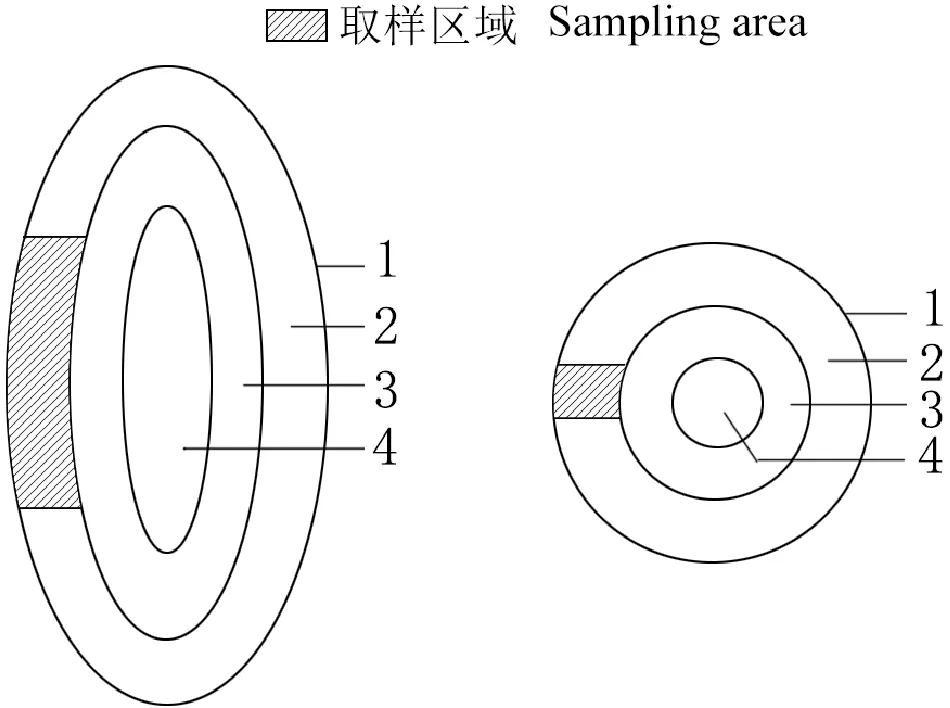
1. 外果皮;2. 中果皮;3. 内果皮;4. 种子图1 透射电镜取样部位示意图1. Exocarp; 2. Mesocarp; 3. Endocarp; 4. SeedsFig.1 Schematic diagram of sampling position of transmission electron microscope
不溶性单宁含量测定参考Oshida等[23]的方法。用1%(v/v)HCl-甲醇溶液溶解测定完可溶性单宁含量的果肉残渣,静置30 min,5 000 r/min、常温离心10 min;取上清液,用1%(v/v)HCl-甲醇溶液再次清洗残渣,重复以上步骤;最后取上清液定容到50 mL,后续测定步骤与可溶性单宁含量测定方法相同。
1.2.6 数据分析用Excel 2016、Graphpad prism 8、SPSS 25.0进行数据统计和差异显著性分析。
2 结果与分析
2.1 果实形态结构观察
对山茱萸果实的外部形态以及内部结构观察并结合果实性状测定结果,将山茱萸果实的发育划分为幼果期、中果期、成熟期3个时期。
幼果期(开花至花后90 d)果皮颜色为绿色,果实纵、横径差异明显,果实纵径最大为14.6392 mm,果实横径最大为6.4728 mm (图2);中果期(花后90~180 d)果皮颜色在较长一段时间内为绿色,后期果皮颜色由绿转黄,果实横径较幼果期末期增加了2.3828 mm(图2);成熟期(花后180~210 d)果皮颜色由黄色逐步转为红色,全红之后果皮颜色进一步加深,果实纵、横径差异较小,果实纵径保持在14.3076~14.6376 mm,果实横径8.6656~8.8556 mm (图2)。
2.2 单宁物质的组织化学定位
山茱萸果实为核果,主要由果皮和种子两部分组成,果皮由外到内依次是外果皮、中果皮和内果皮(图3,A)。山茱萸果实外果皮由一层排列整齐的矩形细胞组成。中果皮体积膨大的薄壁细胞中积累的棕色物质经三氯化铁染色后显蓝黑色 (图3, C),表明含有单宁;经过碘酸-Schiff试剂反应显色呈紫红色(图3,D),表明含有多糖。在山茱萸果实内果皮中有一些细胞体积较大,与周围细胞差异明显,即异细胞[15],它是由内果皮特化的细胞发育而来的,纵切面观其形态呈椭圆形或圆形。
2.3 单宁含量及单宁细胞数目变化
对不同发育时期山茱萸果实纵切观察结果如下:
幼果期(开花至花后90 d):幼果期早期山茱萸果实中果皮薄壁细胞大小约为0.0119 mm,尚未发现有单宁物质的积累(图4,A)。随着果实进一步发育,中果皮体积膨大的薄壁细胞中逐渐开始积累单宁物质(图4,B),单宁物质经番红-固绿对染呈紫红色,单宁细胞数目也不断增多(图4,B-D)。幼果期总单宁和可溶性单宁含量变化呈增长趋势,不溶性单宁含量变化不明显(图5)。其中开花后30~60 d总单宁含量平均日增长速率为48.3836%,可溶性单宁含量平均日增长速率为48.222%;花后60~90 d,总单宁含量的平均日增长速率为8.455%,可溶性单宁含量平均日增长速率为9.5370%。

图2 不同发育时期山茱萸果实形态结构变化Fig.2 Changes of morphological structure of C. officinalis fruit at different development stages

Ep. 外果皮;Me. 中果皮;En. 内果皮;Pa. 薄壁细胞;TC. 单宁细胞;Id. 异细胞;黑色箭头→指示单宁细胞;A. 番红-固绿染色,示山茱萸果实纵切面结构;B. 未染色,示阴性对照;C. 三氯化铁染色,示单宁物质染色结果呈蓝黑色;D. PAS反应,示单宁物质染色结果呈紫红色图3 山茱萸果实中单宁细胞分布Ep. Epicarp; Me. Mesocarp; En. Endocarp; Pa. Parenchyma cell; TC. Tannin cell; Id. Idioblast; Black arrow indicates tannin cell;A. Saffron-fast green staining shows the longitudinal section structure of C. officinalis fruit; B. No staining, showing negative control; C. FeCl3 staining showed that tannin were black-blue; D. PAS reaction showed that tannin was purplish redFig.3 Tannin cell distribution in C. officinalis fruit
中果期(花后90~180 d):山茱萸果实中单宁细胞的数目减少(图4,E)。总单宁和不溶性单宁的含量均呈先增后减的趋势,可溶性单宁的含量不断减少(图5)。其中花后90~150 d可溶性单宁的含量变化与不溶性单宁的含量变化呈负相关。可溶性单宁含量的平均日减速率为9.9570%,不溶性单宁含量的平均日增速率为11.8882%;花后150~180 d总单宁含量、可溶性单宁含量和不溶性单宁含量均呈下降趋势,其中总单宁含量的下降速率最大为17.6180%。
成熟期(花后180~210 d):山茱萸果实单宁细胞数目减少(图4,F)。总单宁、可溶性单宁和不溶性单宁的含量均呈下降趋势(图5),其中,总单宁和可溶性单宁含量的平均日下降速率均大于不溶性单宁含量的平均日下降速率,总单宁、可溶性单宁和不溶性单宁平均日下降速率分别为31.3680%、23.9127%和7.4553%。
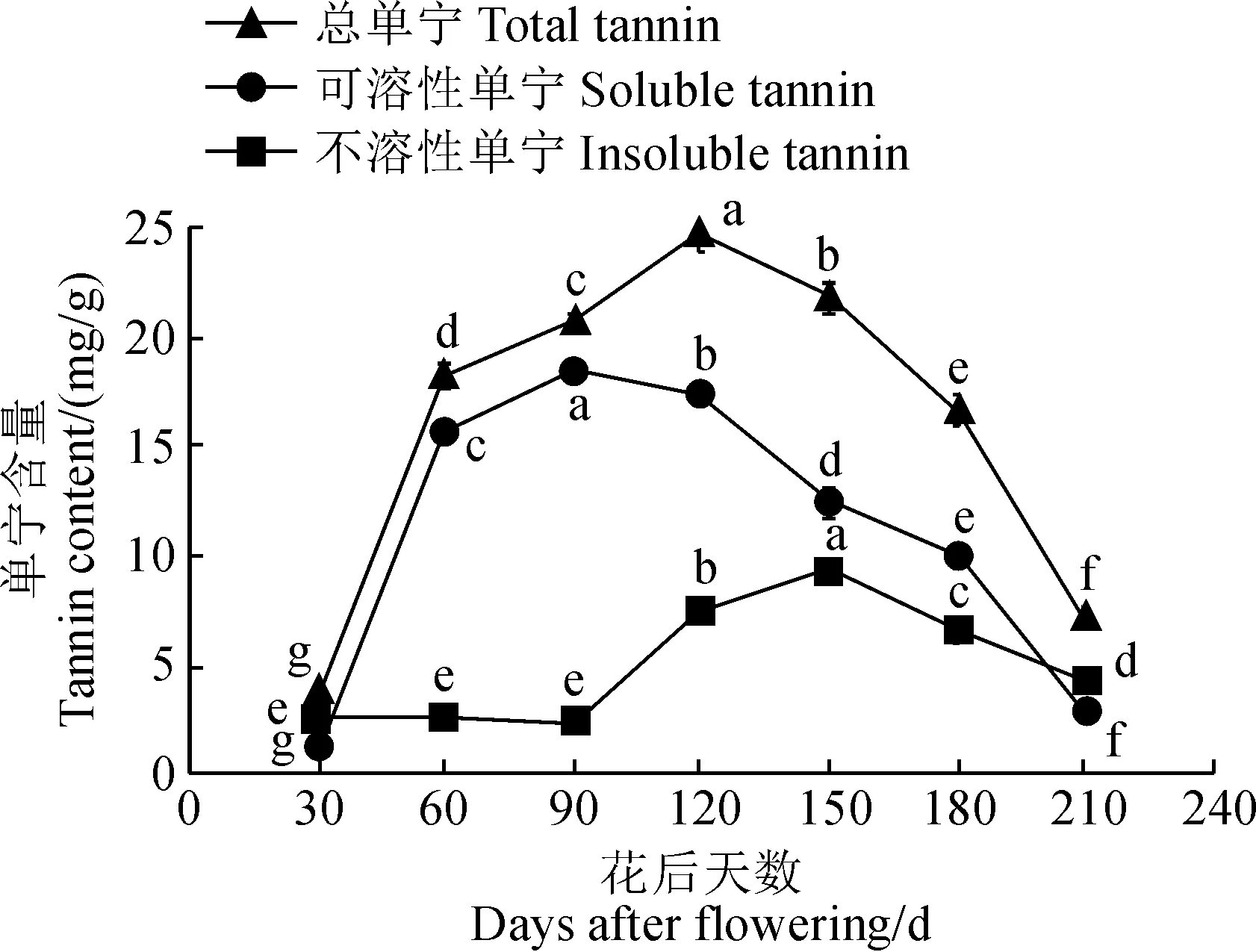
不同小写字母表示花后天数间存在显著差异(P<0.05)图5 山茱萸果实发育过程中单宁含量变化Different normal letter means significant difference among days after flowering (P<0.05)Fig.5 Changes of tannin content during fruit development of C. officinalis

CW. 细胞壁;V. 液泡;N. 细胞核;M. 线粒体;Tn. 单宁物质;VE. 囊泡;ICS. 细胞间隙;PD. 胞间连丝;C. 叶绿体;A. 单宁物质尚未积累;B-C. 细胞质的小液泡中积累单宁;D-E. 细胞质和中央液泡中积累单宁;F. 细胞壁周围有质体存在图6 山茱萸幼果期果实中单宁细胞发育CW. Cell wall; V. Vacuole; N. Nucleus; M. Mitochondria; Tn. Tannin substance; VE. Vesicle; ICS. Intercellular space; PD. Plasmodesmata; C. Chloroplast; A. Tannin has not yet accumulated; B-C.Tannin is accumulated in small vacuoles of cytoplasm; D-E. Tannin accumulated in cytoplasm and central vacuole; F. Plastids around the cell wallFig.6 Tannin cell development in C. officinalis fruit at young fruit stage
2.4 单宁物质积累特点
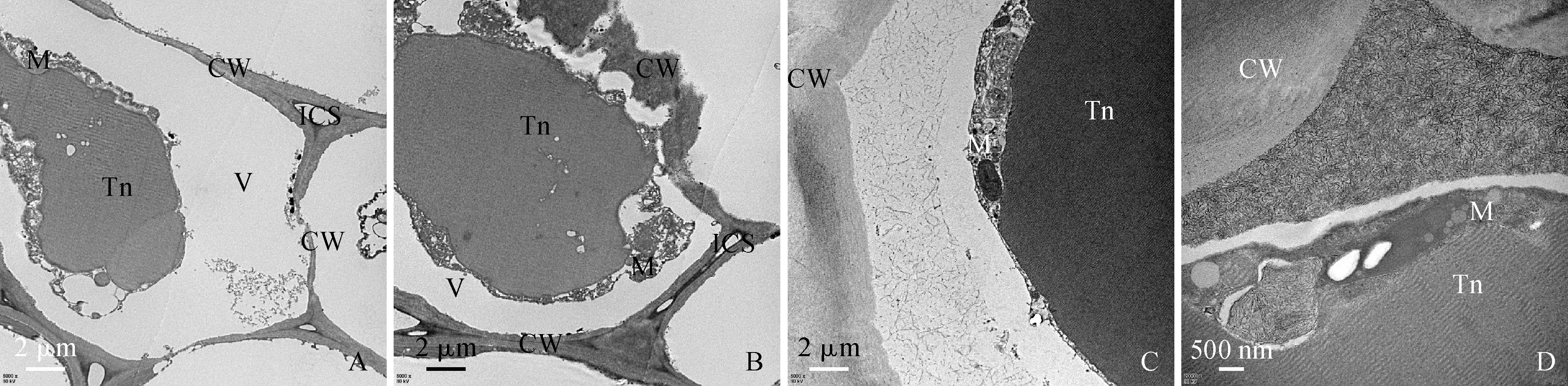
山茱萸果实幼果期早期,中果皮薄壁细胞内尚未观察到单宁物质积累(图4,A);超微观察可见,薄壁细胞细胞壁厚度均匀,细胞质在整个细胞中所占比例较大,细胞核体积较大,核仁大且明显,细胞内具有线粒体及体积大小不一的液泡 (图6,A)。单宁物质最早积累在单宁细胞细胞质的小液泡中,小液泡间会发生相互融合,融合后的液泡中单宁物质积累增多(图6,B-C)。随着中央大液泡形成,单宁物质主要积累在单宁细胞细胞质的小液泡以及中央大液泡中,囊泡数目较多(图6,D);单宁细胞进一步发育后,细胞核核膜、核仁消失,细胞壁周围有质体存在,单宁物质主要积累在中央大液泡中(图6,E-F)。
中果期时山茱萸果实中单宁细胞体积增大且形态不规则(图4,E),单宁细胞壁厚度与幼果期时相比有明显差异。中果期细胞壁厚度不均,细胞壁中段厚度较小,细胞间隙较大,单宁物质积累在体积较大的中央大液泡中(图7,A)。单宁细胞进一步发育后,细胞壁厚度差异明显,单宁物质周围线粒体数目较多(图7,B)。中果期后期,中央大液泡液泡膜周围出现一些电子致密物质(图7,C)。
成熟期单宁细胞壁膨大,中央大液泡液泡膜附近出现电子致密度较高的物质,单宁物质周围线粒体数目较多(图7,D)。
CW. 细胞壁;V. 液泡;M. 线粒体;Tn. 单宁物质;ICS. 细胞间隙;PD. 胞间连丝;A-B. 单宁细胞壁变化;C-D. 单宁细胞中电子致密物质图7 山茱萸中果期(A-C)和成熟期(D)果实中单宁细胞发育CW. Cell wall; V. Vacuole; M. Mitochondria; Tn. Tannin substance; ICS. Intercellular space; PD. Plasmodesmata.; A-B. Changes of tannin cell wall; C-D. Electron dense substances in tannin cellsFig.7 Tannin cell development in C. officinalis fruit at middle fruit stage (A-C) and mature fruit stage (D)

a. 颗粒状;b. 不规则状;c. 板块状;A. 半薄切片;B、D. 石蜡切片;C、E. 超薄切片图8 单宁积累的不同形态a. Granular; b. Irregularities; c. Plate shape; A. Semi-thin section; B and D. Paraffin section; C and E. Ultrathin section; Fig.8 Different forms of tannin accumulation
山茱萸果实中单宁物质最早积累在细胞质的小液泡中,随着单宁细胞进一步发育,单宁物质以颗粒状(图8,B-C)、不规则状(图8,B)、板块状(图8, D-E)等不同形态积累在中央大液泡中,单宁物质积累的3种不同形态不仅在植物不同发育时期存在,在同一发育时期也会同时存在(图8,A)。
3 讨 论
3.1 单宁物质积累特性与山茱萸果实涩味变化相关
单宁是广泛存在于植物体内的次生代谢产物[8],在不同植物中分布位置不同。葡萄、香蕉、石榴等果实中单宁主要积累在外果皮中[24],而在山茱萸果实中单宁物质主要积累在由中果皮薄壁细胞特化而来的单宁细胞中,这一研究结果与廖景平对山茱萸果实中单宁物质分布的研究结果相一致[15]。单宁物质经PAS反应显色,表明含有多糖,单宁细胞中单宁和糖化合的这种形态有利于防止单宁对细胞质产生沉淀作用[15-16]。植物能够协调自身发育特性以加强对环境的适应性[25-26],Jan Lorie M. Robil等发现随着宝莲花的生长发育单宁的含量也会发生变化,宝莲花中单宁的分布方式与植物为适应环境的防御和繁殖特性相关[27]。山茱萸果实发育过程中单宁细胞数目的变化与单宁含量的测定结果相符,均呈先增后减的变化趋势。这一变化趋势可能与山茱萸果实对环境的适应性及果实涩味变化相关。
研究表明,果实涩味强弱受到单宁细胞的体积、数目、形状及其生长发育进程的影响[28]。苯丙氨酸解氨酶是果实涩味物质合成途径中的关键酶和限速酶,其活性高峰多出现在果实的幼果期和成熟期[28]。而自然脱涩的果实中乙醛和乙醇是单宁的凝固剂,乙醛作为细胞内不需转运蛋白即可直接跨膜的小分子物质,在细胞膜完整时乙醛可直接跨越液泡膜,使液泡内可溶性单宁转变为不可溶性单宁,从而降低果实涩味[29]。王玥等对不同品种柿果实的研究发现:柿果实成熟过程中可溶性单宁与水溶性果胶结合是引起柿果脱涩的因素之一[30]。在山茱萸果实幼果期(花后30~60 d)总单宁和可溶性单宁含量增加,单宁细胞数目逐渐增多,这可能与单宁合成过程中相关酶活性较高有关。中果期(花后120 d)时总单宁含量达到最高,中果期早期(花后90~150 d)山茱萸果实中可溶性单宁含量减少,不溶性单宁与可溶性单宁的含量变化呈负相关,可能存在有可溶性单宁向不溶性单宁转化的趋势,以降低果实涩味。中果期后期(花后150~180 d)单宁细胞数目减少,总单宁、可溶性单宁和不溶性单宁的含量均降低。随着果实发育可溶性单宁可能与细胞内的一些物质结合形成复合体,从而使果实涩味降低[29]。成熟期时果实颜色鲜艳,总单宁、可溶性单宁以及不溶性单宁的含量均呈下降趋势,果实的涩味降低,便于吸引鸟类等潜在的种子散布者对种子进行传播[31]。
3.2 单宁物质积累的细胞学特性
单宁物质是植物长期进化过程中与环境相互作用的结果,在植物提高自身保护和生存竞争能力、协调与环境关系上充当重要角色[32-33],竹笋中单宁物质被大液泡挤至细胞壁附近的细胞质中,仅有少量进入液泡,积累量少,分布稀疏[34]。而在山茱萸果实中单宁物质早期积累在中果皮单宁细胞细胞质的小液泡中,小液泡间会发生相互融合,单宁物质积累增多,随着单宁细胞的进一步发育,中央大液泡中积累单宁物质。Magda Andréia Tessmer等对‘金宝’和‘扶余’两个柿品种中单宁物质的研究结果表明:在柿果实的同一发育时期存在有单宁物质积累的不同形态[35]。山茱萸果实中单宁物质积累的时空特征与柿果实相同,山茱萸果实中单宁物质积累的不同形态不仅在植物不同发育时期存在,在同一发育时期也会同时存在,单宁物质主要以颗粒状、板块状以及不规则状积累在单宁细胞中。单宁物质属于类黄酮类次生代谢产物,其合成主要经过莽草酸途径、苯丙烷途径和类黄酮途径最终形成[9]。缩合单宁的合成途径已成为研究植物次生代谢基因表达及调控的模式途径。在拟南芥ANS/LDOX突变体tds4中缩合单宁积累量减少,囊泡运输紊乱,不能形成中央大液泡,缩合单宁前体的合成与运输与囊泡运输形成液泡的过程联系紧密[36]。山茱萸果实的单宁细胞中可见明显的小液泡和囊泡的存在,这可能与山茱萸果实中单宁前体的合成与运输相关。单宁细胞发育过程中线粒体数量较多,可见单宁的积累与组织代谢能力加强相对应[37]。基于对不同发育时期山茱萸果实中单宁物质积累特征的研究,后续可结合代谢组及转录组等的分析结果以揭示山茱萸果实中单宁物质合成机制,进而为山茱萸果实涩味调控的研究提供理论依据和实验基础。

