参与调控桂花花朵开放的SPL基因鉴定及表达分析
吴秀怡,田清尹,杨秀莲,岳远征,王良桂
(南京林业大学 风景园林学院,南京 210037)
桂花(Osmanthusfragrans)是原产于中国的一种重要观赏经济树种。花是其最重要的观赏器官,具有形小繁多,芬芳馥郁,颜色丰富的特性[1]。同时,它富含多种有益于人体健康的营养元素,常用于配料制作各种中国传统美食,在精油、洗护用品等化学工业中也拥有巨大的应用潜力[2-4]。桂花具有极高的开发利用价值,因此,研究参与调控桂花花朵开放过程中相关基因的作用机制及功能具有重要意义。
SPL(SQUAMOSA-promoter binding protein-like)基因是一个调控花发育过程的重要枢纽,仅存在于绿色植物中。SPL基因家族成员均含有由76个氨基酸残基构成的SBP结构域,即两个锌指结构(Cys-Cys-His-Cys或Cys-Cys-Cys-Cys和Cys-Cys-Cys-His)和一个核定位信号(NLS)[5]。两个锌指结构通过结合锌离子来维持蛋白质构象的稳定,而核定位信号与第二个锌指结构部分重叠,引导蛋白进入细胞核中进行转录调控[5]。SPL基因首次在金鱼草中被发现[6],之后又陆续从单细胞藻类到高等植物中被成功克隆出来[7-8]。目前,有关SPL基因家族的全基因组鉴定已在拟南芥[9-10]、水稻[11]、小麦[12]、矮牵牛[13]、麻风树[14]和桃[15]中得到系统性的研究,其功能也被相继报道。
在模式植物拟南芥中,共鉴定得到17个SPL基因家族成员,它们在参与调控拟南芥花朵开放过程中发挥至关重要的作用[9-10]。SPL基因可以调控植物的开花时间和花器官的生长,如过表达AtSPL3的拟南芥出现提前开花的现象并导致花序异常[16],抑制AtSPL10的表达则会影响拟南芥花柄的伸长[17]。在花药育性方面,过表达AtSPL8会降低拟南芥的育性[18],它通过影响赤霉素生物合成和油菜素类固醇信号传导起到正向的调控作用。此外,SPL基因还参与调控花色和花香物质的合成。MicroRNA156(miR156)通过调控AtSPL9破坏MYB-bHLH-WD40复合体的稳定性来抑制二氢黄酮还原酶DFR(dihydroflavonol reductase)的表达,进而负调控花青素的生物合成[19]。同时,AtSPL9对倍半萜合成酶AtTPS21表达的调控可以促进拟南芥在开花阶段形成(E)-b石竹烯等香气物质[20]。
桂花花朵开放是一个较为特殊的生物学过程,它需要特殊的环境条件,如温度、空气湿度和光照等[21-22]。此外,不同品种的桂花在花朵开放过程中也有不同的作用机制,如色与香的合成过程及差异变化一直以来都是研究的热点[23]。本研究基于课题组前期的桂花全基因组数据,鉴定得到29个SPL基因家族成员,系统分析了基因结构、系统发育关系和不同组织间表达模式,筛选出可能参与调控桂花花朵开放过程中的SPL基因,通过qRT-PCR技术分析SPL基因在花朵不同发育阶段的表达情况,进行亚细胞定位和酵母自激活实验的验证,为解析SPL基因参与调控桂花花朵开放过程的分子机制奠定基础。
1 材料和方法
1.1 材 料
以桂花‘日香桂’(O.fragrans‘Rixianggui’)品种为实验材料,采自南京林业大学校园内。采集时间为每日上午9:00~11:00,采集样品为花朵开放过程中不同发育阶段的花瓣:铃梗期(S-1)、香眼期(S0)、初花期(S1)、盛花期(S2)和末花期(S3),相邻两个花期间隔1~2 d(图1),每个花期3个生物学重复。所有样品采集后立即放入液氮中速冻处理,并置于-80 ℃超低温冰箱保存。
1.2 方 法
1.2.1 桂花SPL基因家族成员鉴定从Pfam网站下载SPL家族的结构域模型文件(Pfam03110),使用HMMER软件从桂花全基因组数据库中初步筛选出所有包含SPB结构域的蛋白序列[24],利用Batch CD-search、Pfam和SMART这3个在线工具验证其是否含有完整的SPB保守结构域。应用Weblogo3将SBP结构域可视化,运用ExPASy网站分析OfSPL蛋白序列的相对分子质量和理论等电点值,使用WoLF PSORT在线预测OfSPL蛋白的亚细胞定位。
1.2.2 桂花OfSPL生物信息学分析利用MEGA7.0软件将OfSPL与AtSPL编码的蛋白序列构建系统进化树,采用邻接法(neighbor-joining,NJ),Poission模式、完全删除和1000次重复进行测试,AtSPL的蛋白序列下载自Tair官网。在桂花全基因组GFF3文件中提取OfSPL的染色体信息(染色体长度和基因的起始、终止位点)绘制染色体定位图。使用TBtools获取桂花SPL基因家族成员的基因结构信息并进行基因结构的可视化展示。
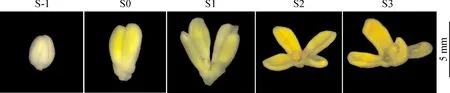
S-1. 铃梗期;S0. 香眼期;S1. 初花期;S2. 盛花期;S3. 末花期图1 桂花花朵开放的不同发育阶段S-1. Bud-pedicel stage; S0. Bud-eye stage; S1. Primary blooming stage; S2. Full blooming stage; S3. Flower fading stageFig.1 Different flower development stages of O. fragrans flower opening
1.2.3 桂花不同组织及花发育不同阶段表达分析基于桂花全基因组的RNA-seq表达数据得到7个不同组织(根、茎、幼叶、成熟叶、初花期、盛花期和末花期)的FPKM值,进行SPL基因家族成员的表达分析。利用TBtools完成表达热图的绘制,筛选出在花组织中较高表达的SPL基因。
按照天根植物总RNA提取试剂盒的说明提取桂花花朵不同发育阶段的RNA,采用EasyScript一步法反转录试剂盒完成cDNA的合成,并用去离子水稀释10倍。使用Primer 5.0软件设计OfSPL的特异性引物,以桂花RAN为内参基因进行实时荧光定量[25-26]。测定结果均为3次生物学和3次技术性重复的平均值±SE,利用SPSS(22.0)统计软件进行方差分析和差异显著性比较。
1.2.4OfSPL10/21候选基因亚细胞定位及酵母自激活为了构建35S∷GFP-OfSPL10/21,将OfSPL10/21的CDS序列克隆到pCAMBIAsuper1300-GFP载体上。采用携带35S∷GFP-OfSPL10/21农杆菌(GV3101)及对照载体注射本氏烟草叶片进行瞬时表达分析。待浸润植株于生长室正常培养2 d后,在德国Zeiss公司的LSM710显微镜上观察绿色荧光蛋白(GFP)荧光信号。
将OfSPL10/21的CDS序列克隆到pGBKT7载体获得pGBKT7-OfSPL10/21,再将pGBKT7-OfSPL10/21和阴性对照pGBKT7转化到酵母AH109菌株上,并于SD/-Trp、SD/-Trp-ade和SD/-Trp-ade+X-α-gal培养基上培养3 d(30 ℃)后观察变化。
2 结果与分析
2.1 OfSPL基因家族成员鉴定
基于桂花全基因组数据,共鉴定得到29个OfSPL家族成员,根据其在染色体上的位置,依次命名为OfSPL1—OfSPL29(表1),它们不均匀地分布在桂花15条染色体上(图2)。29个OfSPL家族成员均含高度保守的SBP结构域(图3)。此外,OfSPL10/17/21/22蛋白序列还包含ANK结构域,OfSPL11包含RRM结构域。29个OfSPL蛋白分子量从15.053 kD跨度到119.887 kD,最长的OfSPL19含有1 088个氨基酸,而最短的OfSPL2仅有133个氨基酸,理论等电点分布在6.16~9.83之间。
2.2 OfSPL系统发育和基因结构分析
为了解桂花SPL基因的系统进化关系,将29个桂花SPL蛋白和16个拟南芥SPL蛋白构建系统进化发育树。结果显示,29个桂花SPL蛋白聚为8个亚群,每个亚群分别含有7、6、10、4、6、9、3和1个蛋白,其中桂花OfSPL分别为4、3、7、3、3、5和2个。除了亚群8,每个亚群至少包含1个AtSPL和1个OfSPL(图4,表2)。为进一步研究桂花SPL基因的系统进化关系,对其外显子、内含子的基因结构进行分析。基因结构分析结果显示,不同组的外显子数量存在差异,但在同一组中几乎一致,共分为7个组G1—G7(图5)。
2.3 OfSPL不同组织表达模式及花发育不同阶段分析
从桂花7个不同组织样本的RNA-seq表达数据中获得24个OfSPL的FPKM值(图6),5个OfSPL(OfSPL1/2/6/20/27)未找到表达量。结果显示,24个OfSPL在不同组织中的表达模式不同,其成员之间表达存在较大差异。亚群6中OfSPL10/17/19/21/28、亚群2中OfSPL9、亚群3中OfSPL7/16/25、亚群4中OfSPL18、亚群5中OfSPL8和亚群7中OfSPL27在不同组织中均有表达,其中,OfSPL9/10/17/18/19/21/27/28这8个基因在花组织中的整体表达量较高。
为了探究OfSPL在桂花花朵开花过程中的潜在功能,对OfSPL10/21在桂花花朵不同发育阶段S-1~S3进行qPCR技术分析。结果显示,OfSPL10/21在花朵不同发育阶段均有不同程度的表达,OfSPL10/21的相对表达量随着花朵逐渐开放基本呈现先上升后下降的趋势(图7)。
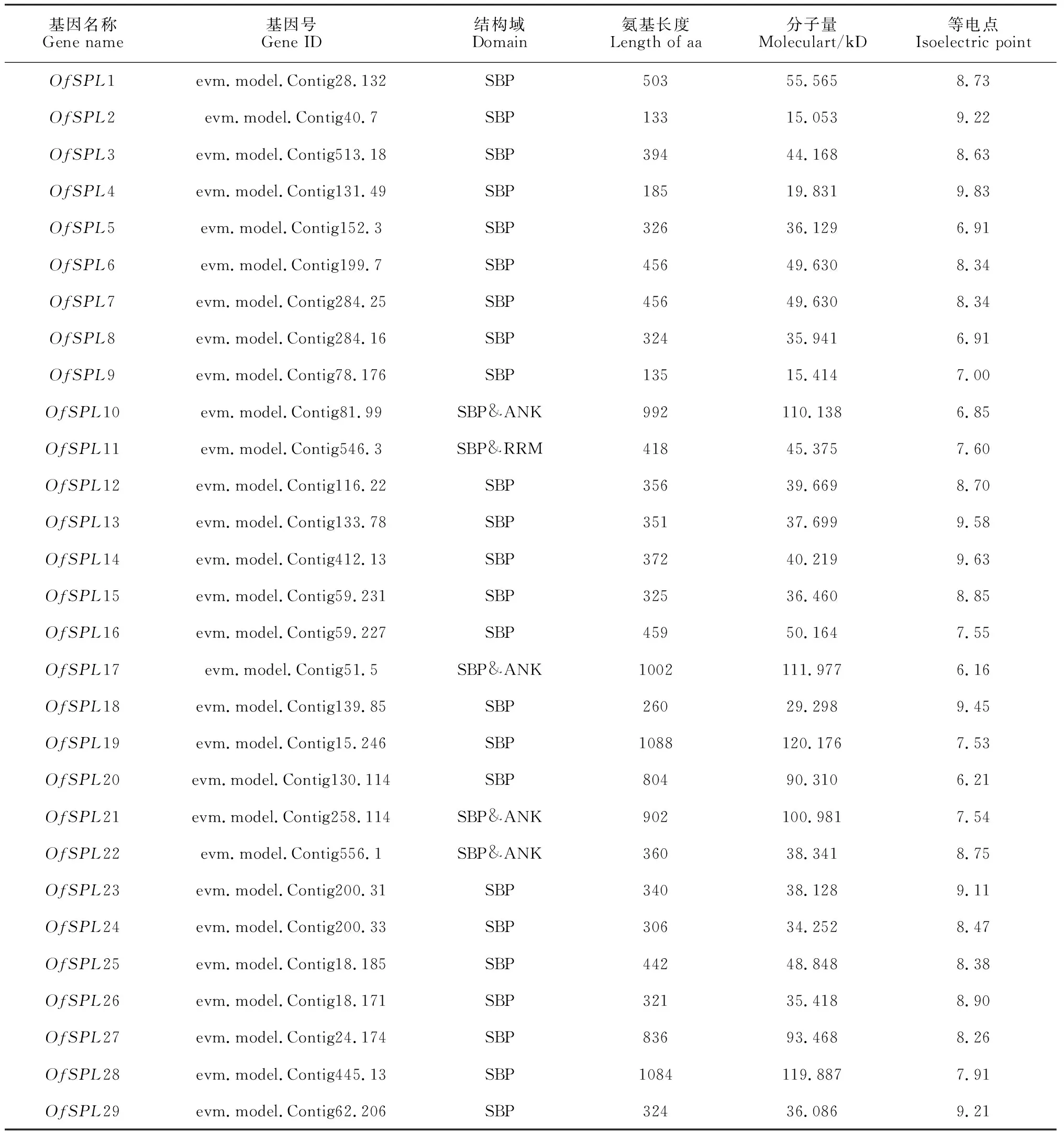
表1 桂花OfSPL基因家族成员
2.4 OfSPL10/21蛋白的亚细胞定位及酵母自激活
使用WoLF PSORT在线预测OfSPL蛋白的亚细胞定位,OfSPL10/21均主要定位于细胞核上。为进一步验证其编码蛋白的亚细胞位置,在本氏烟草中进行35S∷GFP-OfSPL10/21亚细胞定位实验,探究OfSPL10/21基因在转录调控系统中的潜在功能。结果显示,35S∷GFP-OfSPL10/21融合蛋白的绿色荧光信号在细胞核和细胞质膜上能够被明显地观测到(图8),表明OfSPL10/21蛋白主要定位在细胞核中。
为了进一步确定OfSPL10/21的转录激活功能,将筛选出的OfSPL10/21序列克隆到酵母表达载体pGBKT7中。阴性对照pGBKT7和pGBKT7-OfSPL10/21在连续稀释的SD/-Trp培养基上生长良好,在SD/-Trp-Ade和SD/-Trp-ade+X-α-gal培养基上均不能正常生长(图9)。
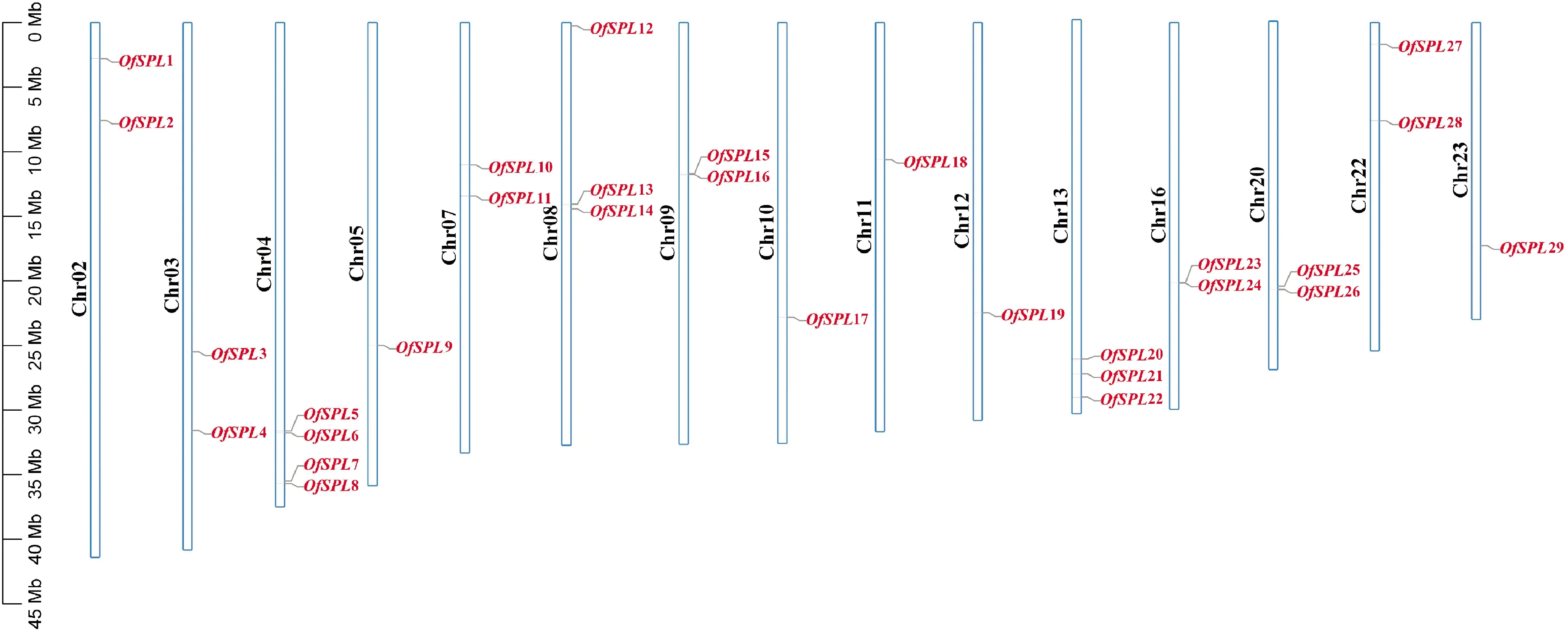
左侧比例尺表示染色体长度图2 桂花SPL的染色体定位The scale on the left provides the relative length of chromosomesFig.2 Chromosomal localization of SPLs in O. fragrans
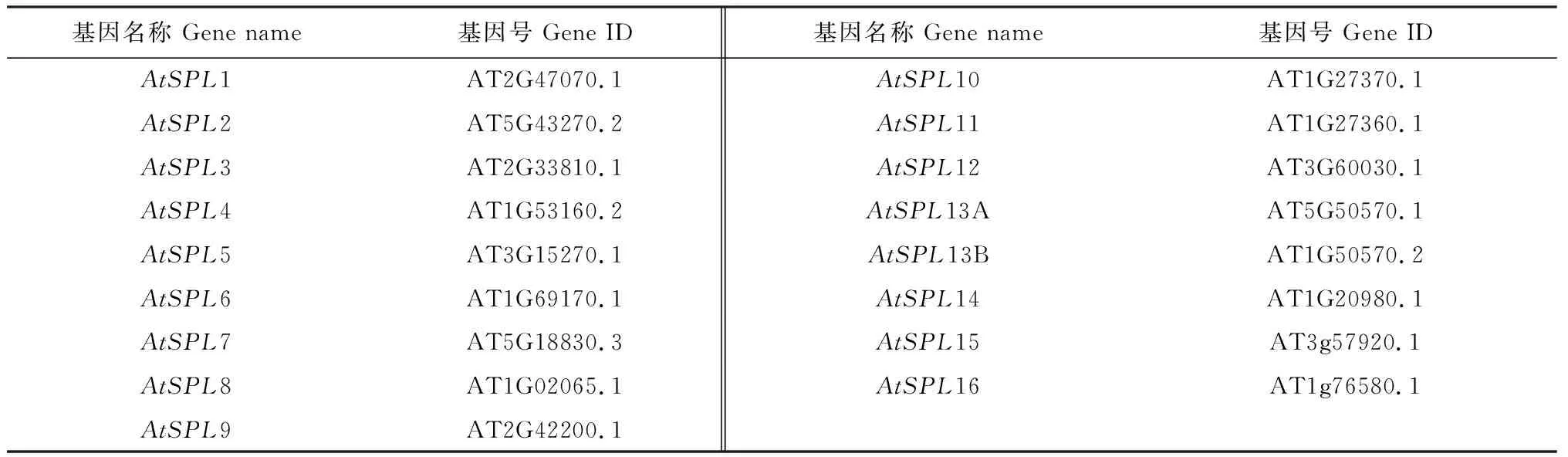
表2 拟南芥SPL基因家族成员登录号
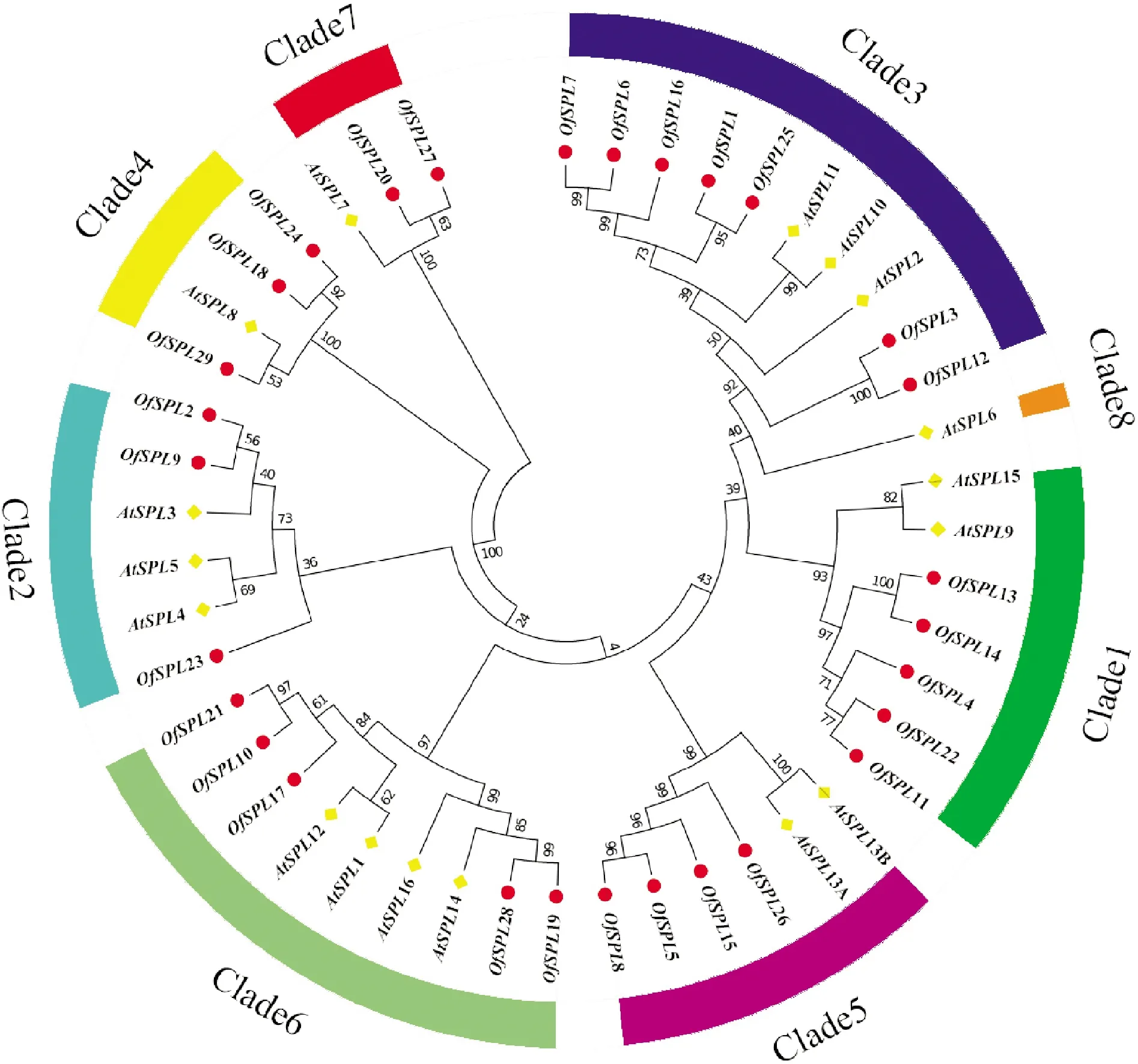
Of. 桂花;At. 拟南芥图4 桂花SPL基因家族的系统发育分析Of. Osmanthus fragrans; At. Arabidopsis thalianaFig.4 Phylogenetic analysis of SPL gene family in O. fragrans
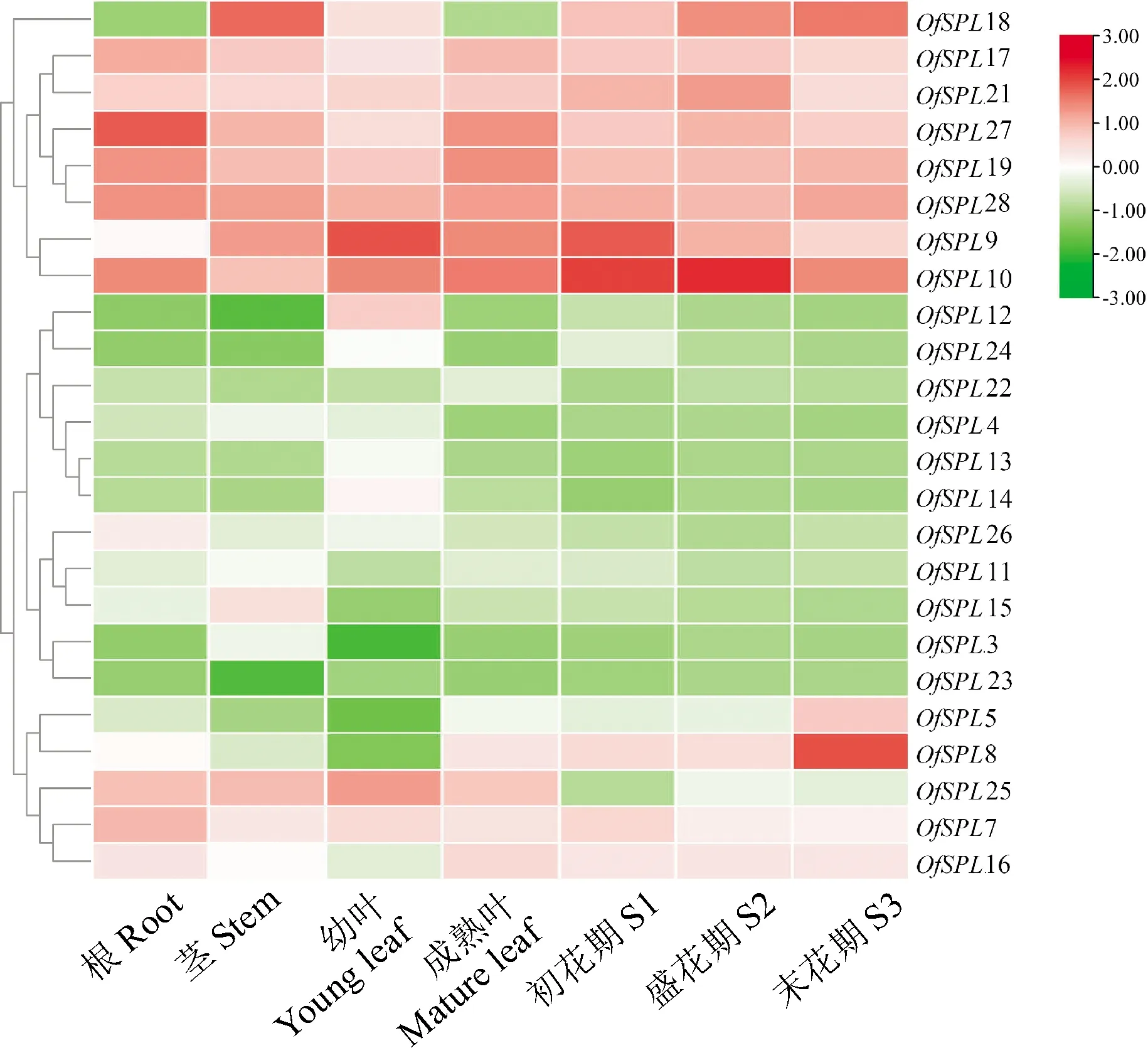
图例表示标准化的FPKM值。红色表示高表达水平,绿色表示低表达水平图6 桂花SPL基因家族不同组织及花期中的差异表达Legends represent the normalized FPKM values. Red means high expression level, while green means low expression levelFig.6 Differential expression of SPL family in different tissues and flowering stages of O. fragrans
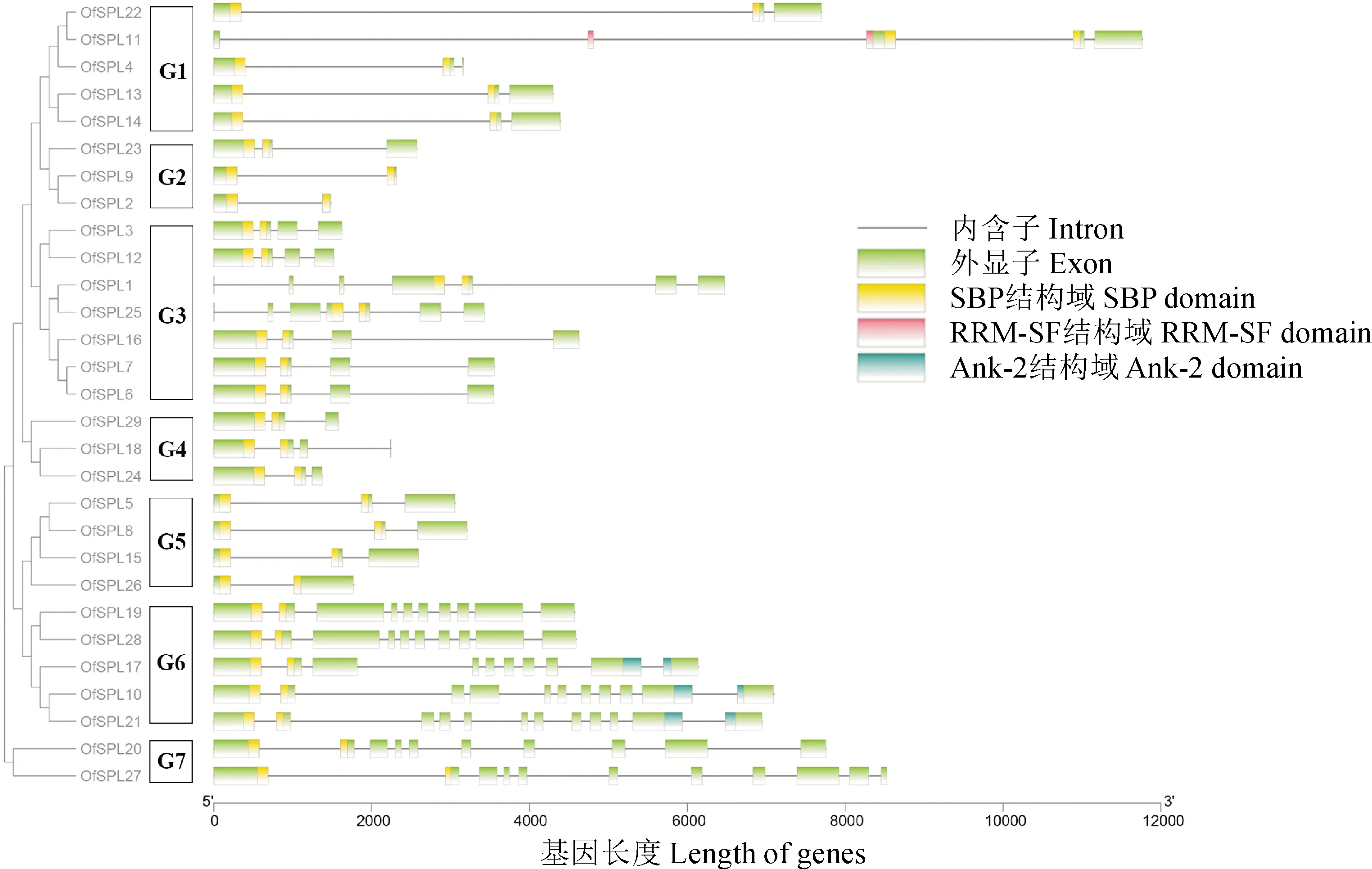
图5 桂花SPL基因家族的基因结构分析Fig.5 Analysis of gene structure of SPL gene family in O. fragrans
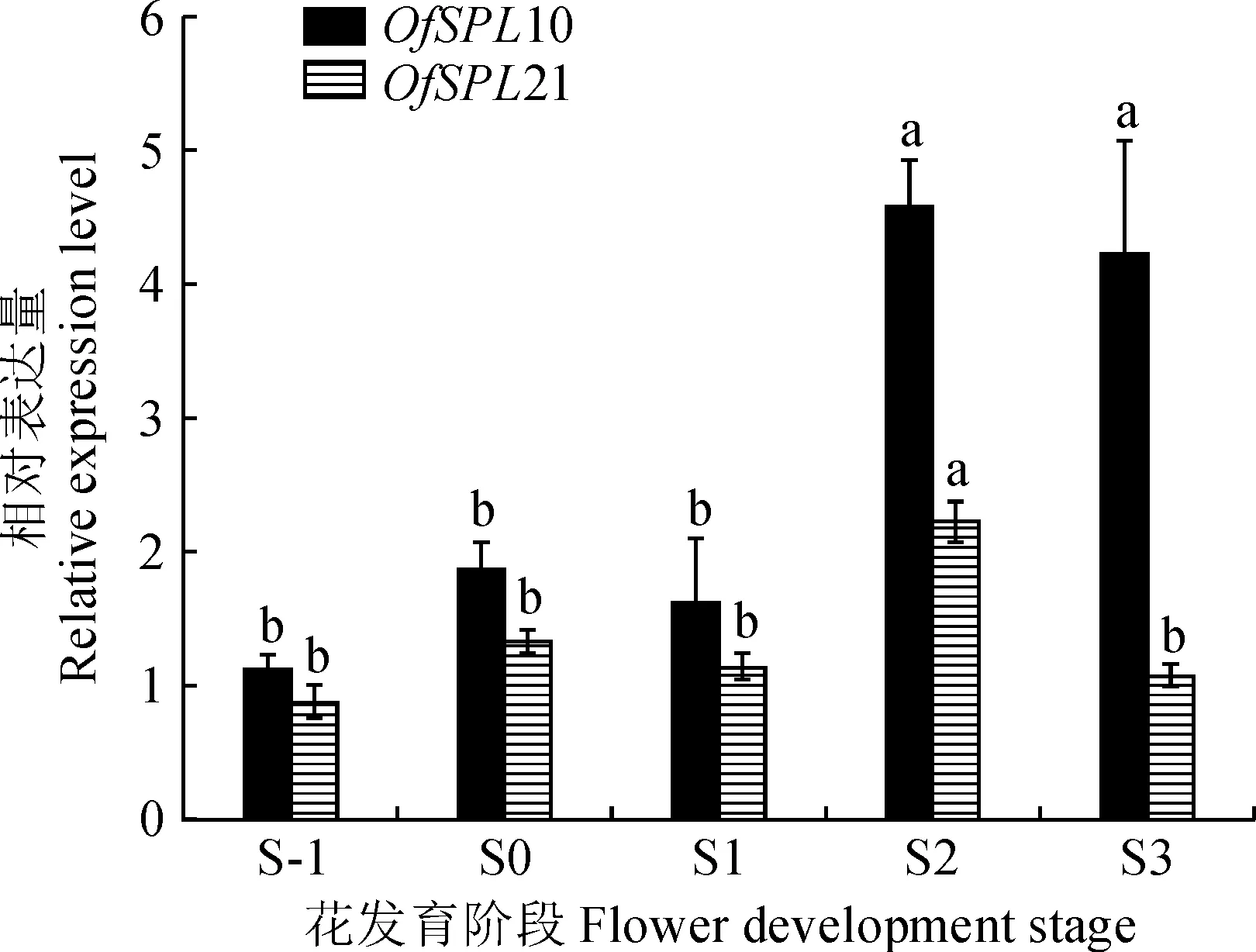
不同小写字母表示基因表达量存在显著性差异(P<0.05)图7 OfSPL10/21基因在桂花花朵不同发育阶段的表达Different lowercase letters indicate significant difference in gene expression (P<0.05)Fig.7 Expression levels of OfSPL10/21 in different flower development stages of O. fragrans
3 讨 论
SPL是植物特有的具有高度保守SBP结构域的特异性家族,在花朵开放过程中发挥重要的调控作用。迄今为止,有关SPL基因的研究在模式植物中取得了很大进展,但对大多数木本观赏植物的报道较少。SPL基因家族成员可聚类为8个亚群[9-11],在有的研究中也被分为6个亚群[27-28]。本研究通过桂花全基因组共鉴定出29个OfSPL家族成员,根据8个亚群的分类方法分到其中7个亚群中,第8亚群不含SPL基因。大部分OfSPL与AtSPL同源性极高并归为同一亚群,且具有相似的外显子/内含子结构,该结果与桃SPL基因家族成员的基因结构分布情况较吻合[15]。由此,我们推测同一亚群中桂花OfSPL和拟南芥AtSPL可能具有相似的生物学功能。
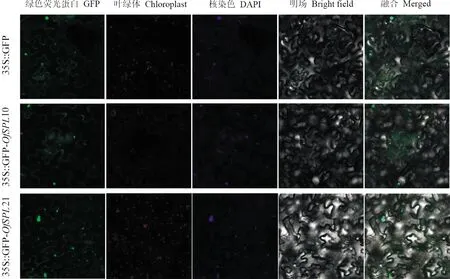
激光共聚焦显微镜的激发波长的设置为:GFP.500 nm(绿色);叶绿体.400 nm(红色)图8 OfSPL10/21蛋白在本氏烟草表皮细胞中的亚细胞定位The excitation wavelength of the confocal laser microscope was set as GFP. 500 nm (green). Chloroplasts. 400 nm (red)Fig.8 Subcellular localization of OfSPL10/21 in the epidermal cells of Tobacacia benzoi

图9 OfSPL10/21在酵母中的转录自激活活性分析Fig.9 Transactivation analysis of OfSPL10/21 in yeast cells
基因在植物中的表达决定其功能,基因的表达模式反映了其功能[13]。大多数OfSPL在不同的组织中表达不同,说明OfSPL在桂花生长发育过程中参与了多个生物学过程。已有研究报道,同一亚群中大多数同源SPL基因具有相似的表达模式[29]。在桂花中,属于第6亚群的5个基因OfSPL10/17/19/21/28几乎在所有组织中都较高表达,其余亚群中大部分OfSPL都较低表达,这与椰子SPL基因家族成员的表达情况一致[30]。OfSPL9/10/17/18/19/21/28/27在花组织中较高表达,推测这8个基因可能参与了桂花花朵开放的过程。其中,OfSPL10在所有组织中的表达量都极高,它可能在桂花生长中起着至关重要的作用。有报道同源基因AtSPL1和AtSPL12在拟南芥花序中的高表达增强了花序的耐热性[31]。在本研究中,OfSPL10/21的表达趋势和桂花花香物质的释放及花色呈色的规律一致[23,32],由此推测其可能参与调控花色与花香物质的生物合成。
许多研究表明,具有转录激活活性的转录因子通常定位于细胞核中发挥调控作用[33],如枸杞LbSPL6基因在细胞核上调控下游基因的表达[34]。在桂花中,OfSPL10/21定位于细胞核,说明它们可以在细胞核中发挥活性。然而,部分转录因子并非特异定位在细胞核上,它们可能在一定的诱导状态下才能转移到细胞核中发挥功效,如膜定位的MfNACsa在干旱胁迫下会转移到细胞核中[35],或者与其他基因发生互作,其位置也会受到影响[36]。转录自激活分析显示,OfSPL10/21不具有转录自激活活性,因此,我们推测它们可能与其他基因发生相互作用。
本研发现,OfSPL9/10/17/18/19/21/27/28可能参与了桂花花朵开放的过程,推测OfSPL10/21可能参与调控桂花花色与花香物质的生物合成。通过亚细胞定位和酵母自激活验证,发现OfSPL10/21主要定位在细胞核上,推测它们可能需要与其他基因发生互作才能发挥调控作用。本研究为进一步探究SPL基因参与桂花花朵开放过程中的作用机制提供了基因资源。

