下肢创伤性闭合骨折患者围术期血栓弹力图参数与凝血功能 炎症及血液流变学指标的相关性研究
廖湘成, 孙 可, 莫柱宁, 黄惠妮, 阳子骥, 罗瑞献, 朱春丽, 黎海澜
患者发生骨折后,由于骨结构受到破坏性挤压,血管内膜损伤,炎症介质释放,血液凝血系统被激活,使血液处于高黏、高凝和高聚状态。另外,手术也进一步造成组织、血管内皮的广泛损伤,激发骨折患者本身就处于活跃状态的凝血功能,促进血栓栓塞的发生。尤其是绝大多数不能下床活动的下肢创伤骨折患者,更加剧了血液的高凝状态,易诱发下肢深静脉血栓(lower extremity deep vein thrombosis,LDVT)形成,引起国内外学者的广泛关注。血栓弹力图(thromboelastography,TEG)可反映凝血开始到纤维蛋白溶解的全动态过程,与传统的凝血功能检查相比,TEG不但能使临床医师了解血液体外凝血的全过程,而且可以更形象地了解高凝状态[1]。Hobson等[2]发现TEG参数中血块强度值(MA值)越高,血栓发生的概率越高。多项研究也发现,当MA值>68 mm时患者发生血栓的风险明显增加[3~5]。血液流变学和炎症状态等多种因素都对骨折患者的血液高凝状态产生影响[6-7]。但目前关于下肢骨折患者TEG参数与凝血功能、血液流变学、炎症等实验室指标的相关分析鲜见。鉴此,本研究将就其进行探讨,以评价TEG对评估下肢骨折患者凝血功能、炎症及血液流变状态的意义,及其在评估患者血液高凝状态中的临床应用价值。
1 资料与方法
1.1一般资料 选取2018年11月至2020年7月我院收治的81例下肢创伤性闭合骨折患者的临床资料。其中男42例,女39例;年龄6~90(59.37±22.01)岁;股骨骨折46例,胫腓骨骨折15例,其他骨折20例。纳入标准:(1)经X线平片检查确诊的下肢创伤性闭合骨折患者;(2)心、肺、肝、肾功能基本正常;(3)无高脂血症、糖尿病、血栓栓塞史。排除标准:(1)围术期未完成TEG监测;(2)合并血液病及先天性凝血功能障碍;(3)信息资料不完整。
1.2TEG检查方法 采用北京乐普公司西斯芬检测仪及其相应的检测试剂进行TEG检查。采集患者围术期(术前或术后)全血3 ml,于标本送达后2 h之内进行测试。检测指标包括:(1)凝血时间(R值),反映凝血因子情况;(2)血块生成时间(K值),反映纤维蛋白原(fibrinogen,FIB)的功能和水平;(3)血块生成速率(α角),反映FIB的功能和水平;(4)血块强度值(MA值),反映血小板(platelet,PLT)数量及功能。
1.3其他临床资料的收集 通过医院病历系统收集研究对象的性别、年龄等一般临床资料,以及凝血功能检查结果[凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、FIB、PLT],炎症指标检查结果[C反应蛋白(C-reactive protein,CRP)、白细胞(white blood cell,WBC)]和血流动力学指标检查结果[血沉(erythrocyte sedimentation rate,ESR)、红细胞压积(hematocrit,HCT)]。其中,凝血功能指标(PT、APTT、FIB)采用STAGO全自动血凝仪(stago,法国)进行检测;PLT、WBC、HCT采用sysmex SP-10血细胞分析仪(sysmex,日本)进行检测;CRP采用免疫荧光干式定量法通过免疫分析仪(Jet-iStar3000,杭州)进行检测;ESR采用Monitor-100全自动血沉仪(Vital Diagnostic,意大利)进行检测。以上各指标的检测样本与TEG检查所用为同一时间所获样本,均在同一天进行检测。
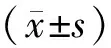
2 结果
2.181例患者各指标检查结果 81患者中MA值≥68 mm者68例,高凝状态发生率为83.95%。TEG、凝血功能、炎症指标、血流动力学指标检查结果见表1。

表1 81例患者各指标检查结果
2.2TEG检查指标与凝血功能指标的Pearson相关分析结果 R值与APTT、FIB呈显著正相关(P<0.05);K值与PLT呈显著负相关(P<0.05);α角与PLT呈显著正相关(P<0.05);MA值与APTT、FIB、PLT呈显著正相关(P<0.05)。见表2。

表2 TEG检查指标与凝血功能指标的Pearson相关分析结果
2.3TEG检查指标与炎症指标、血液流变学指标的Pearson相关分析结果 R值与ESR呈显著正相关(P<0.05);K值与HCT呈显著正相关(P<0.05);α角与ESR呈显著正相关,与HCT呈显著负相关(P<0.05);MA值与CRP、ESR呈显著正相关(P<0.05),与HCT呈显著负相关(P<0.05)。见表3。
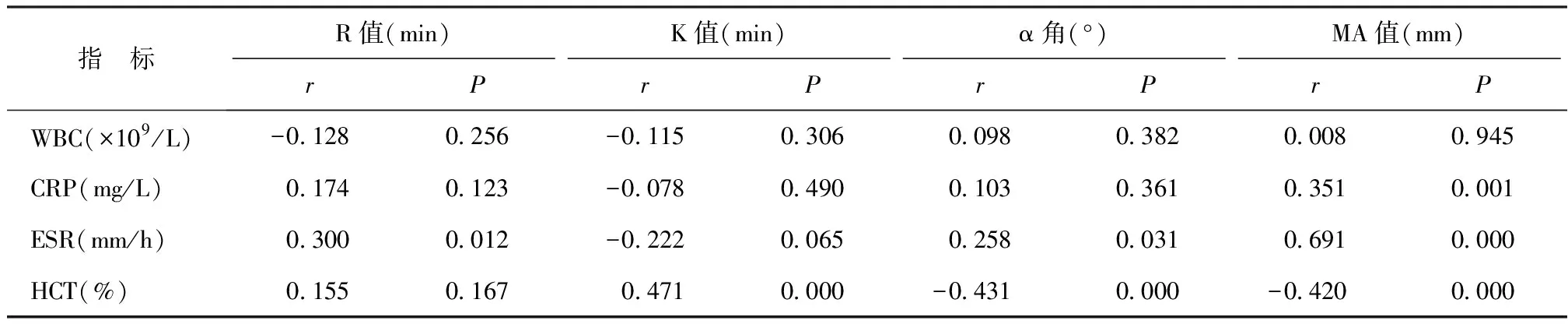
表3 TEG检查指标与炎症指标、血液流变学指标的Pearson相关分析结果
3 讨论
3.1创伤骨折后患者的血液处于高凝状态,被认为是诱发围术期深静脉血栓(deep vein thrombosis,DVT)的主要原因之一,也是目前临床尚未解决的难题。1948年Hartert首先设计血栓弹力仪以描记凝血过程的动态曲线(即TEG),TEG能动态地观察血液的凝固全过程,反映血液的高凝状态[8-10]。目前,常规凝血检测反映的是某一成分含量的多少及活性的高低,且只能反映某一环节的变化,并不能反映血液是否处于高凝状态。血液高凝过程非常复杂,是体内各种凝血及抗凝成分相互调节的结果。因此,单一成分的变化并不足以反映凝血的“总体”或“全貌”。TEG能动态观察并精确记录血块形成的全过程,也是目前判断血液高凝状态的最可靠和最敏感指标。McCrath等[3]的研究前瞻性纳入了240例接受外科手术的患者,发现MA值增加与术后高凝状态及血栓并发症相关。本研究MA≥68 mm有68例,高凝状态发生率为83.95%,提示创伤骨折患者在围术期内多处于高凝状态。进一步分析发现,PLT与MA值、α角呈正相关,而与K值呈负相关;FIB与MA值呈正相关;APTT与R值、MA值呈正相关。考虑骨折患者的高凝状态可能主要与体内增高的FIB和PLT的水平及功能有关。许寻等[8]在分析髋膝关节置换术后的患者血液高凝状态中也发现,APTT与R值呈正相关;PLT与α角呈正相关,与K值呈负相关;MA值与FIB、PLT呈正相关。
3.2止血和炎症之间存在广泛的交叉作用,慢性炎症通过释放促炎症因子活化补体,激活内外源性凝血途径。CRP是一种急性期全身炎症生物标志物,在感染、炎症和组织损伤时迅速增加。王玉洁等[11]发现慢性肾脏病(chronic kidney disease,CKD)5期患者血液高凝状态与炎症因子密切相关,并且CRP可能是促进其发生的危险因素。本研究结果提示MA值与CRP呈正相关,与朋云峰等[12]研究结果一致。也有研究显示,MA值与超敏C-反应蛋白(hypersensitive C-reactive protein,hs-CRP)之间存在显著关联性,说明MA值不仅能反映血小板的功能状态,而且能间接反映炎症状态,提示该指标可作为评价血小板聚集和炎症的潜在临床参数[13-14]。
3.3血栓形成是在血管内皮细胞、血小板、凝血、抗凝、纤溶系统以及血液流变学等多种因素改变的综合作用下发生的,这些因素在血栓形成之前己发生不同程度的变化[15]。血液流变学是研究血液的流动性、黏滞性、变形性和凝固性的学科,反映血液循环系统内在环境。ESR作为一种血液流变学指标,与红细胞聚集性存在显著的相关性[16]。红细胞聚集性增强,是体内血栓形成的危险因素之一,同时也是反映炎症的指标之一。本研究结果发现,ESR与MA值、α角、R值呈正相关;而HCT与MA值、α角呈负相关,与K值呈正相关。ESR的升高增加了血流缓滞的程度,从而使血栓形成的可能性增加。
综上所述,下肢骨折患者围术期多处于高凝状态,TEG参数与常规凝血指标、炎症指标、血液流变学指标等均具有一定的相关性,具有较好的临床参考价值。

