CircRNA-1565对非小细胞肺癌A549细胞增殖和凋亡的影响*
张茹茹,朱正秋,彭猛青,徐 娟,张 坤
(1.江苏省宿迁市钟吾医院/宿迁市肿瘤医院肿瘤科 223800;2.徐州医科大学附属医院肿瘤科,江苏徐州 221000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是一种常见的恶性肿瘤,具有早期诊断困难、生存率低、预后不良等特点[1]。尽管针对NSCLC的治疗和研究取得了一定的进展,但NSCLC细胞较高的增殖活性是NSCLC患者预后的主要影响因素。因此,研究NSCLC发生、发展的分子机制,对NSCLC的预后具有重要意义[2]。环状RNA(CircRNA)是一类特殊的非编码RNA,研究表明CircRNA与肿瘤的产生密切相关,CircRNA分子富含微小RNA(microRNA)结合位点,可以和靶基因竞争性结合microRNA,进而解除microRNA对靶基因的抑制作用,改变相关基因的表达水平,调控肿瘤的发生与发展[3-5]。本研究构建CircRNA-1565低表达NSCLC A549细胞,进而探讨CircRNA-1565通过TET2基因对NSCLC A549细胞增殖、细胞周期和凋亡的影响,为NSCLC的精准靶向治疗奠定理论基础。
1 资料与方法
1.1 一般资料
选取2017年5月至2020年6月宿迁市钟吾医院收治的30例NSCLC患者为研究对象,其中男14例,女16例,平均年龄(62.0±4.3)岁。纳入标准:(1)患者经过病理科确诊符合非小细胞肺癌NCCN诊断指南(2017年第5版);(2)术前6个月未接受其他治疗方案;(3)无高血压、糖尿病等基础性疾病;(4)患者及其家属知晓本试验所有研究方案,并签署知情同意书。本研究由宿迁市钟吾医院伦理委员会批准通过。
1.2 方法
1.2.1仪器与试剂
肺癌A549、HCC827、PC9、NCI-H1650、NCI-H1299细胞系购自中科院上海细胞库;DMEM培养基、青链霉素、胰酶、胎牛血清购自美国Sigma公司。转染质粒购自上海凯吉公司;qPCR试剂盒购自日本Takara公司;MTT试剂盒购自大连美伦公司;BCA试剂盒购自北京索莱宝科技有限公司;TET2、Cyclin D1/E1、CDK1/2、Bax、PARP、GAPDH一抗购自美国Abcam公司;RIPA、胰酶、ECL显色液购自上海碧云天公司;FITC Apoptosis Detection KitⅠ试剂盒购自美国 BD 公司。Lipo6000TM购自上海碧云天公司;Trizol 试剂购自美国 Invitrogen 公司;多功能呈像仪、实时荧光定量PCR仪购自美国Bio-Rad公司;倒置显微镜、无菌操作台购自日本基恩士公司;流式细胞仪购自美国Beckman Coulter公司;倒置荧光显微镜购自日本Olympus公司;DYY-7C电泳仪购自美国GE公司;二氧化碳培养箱购自美国Thermo公司;台式高速冷冻离心机购自美国Beckman Coulter公司;化学发光仪购自美国BioRad公司。
1.2.2临床标本分析
取30例NSCLC患者癌组织和癌旁组织,按照核酸提取试剂盒说明书操作,提取两种组织RNA定量,逆转录合成cDNA,按照 qPCR试剂盒说明操作检测两种组织CircRNA-1565、TET2表达情况,引物序列见表1。

表1 基因引物序列
1.2.3细胞培养
将处于对数生长期的A549、HCC827、PC9、NCI-H1650、NCI-H1299细胞置于37 ℃、5% CO2饱和湿度培养箱进行培养,使用含10%胎牛血清的DMEM培养基进行培育,细胞贴壁生长至90%,采用0.25%胰酶消化传代,qPCR检测各组细胞CircRNA-1565表达情况。
1.2.4细胞分组和转染
取对数生长期A549细胞,用1%胰酶消化制备单细胞悬液(1×106/mL),接种于6孔板中,5% CO2、37 ℃培养箱培养,细胞贴壁生长融合至70%后,按照转染试剂说明书进行操作。分组:对照组(正常A549细胞)、阴性对照组(转染无序基因序列的A549细胞)、实验组(转染 CircRNA-1565反义基因序列质粒,沉默CircRNA-1565表达的A549细胞)。转染完毕后,qPCR检测各组细胞CircRNA-1565表达水平。
1.2.5MTT检测细胞增殖活性
取各组对数生长期细胞,用1.5%胰酶消化、离心制备细胞悬液(1×104个/mL),接种于96孔板,每孔100 μL,37 ℃、5% CO2饱和湿度培养箱进行培养,分别设置12、24、36、48 h 4个检测时间点,检测时每孔加入100 μL MTT工作液,去上清液后,每孔加150 μL DMSO,室温摇床10 min,多功能酶标仪检测570 nm处吸光度(A)值,每组实验重复3次。
1.2.6流式细胞术检测细胞周期
取各组对数生长期细胞,用1.5%胰酶消化、离心制备细胞悬液(1×106个/mL),按照细胞周期检测说明书操作,采用流式细胞仪检测各组细胞周期,每组实验重复3次。
1.2.7流式细胞术检测各组细胞凋亡情况
取各组对数生长期细胞,用1.5%胰酶消化、离心制备细胞悬液(1×106个/mL),接种于6孔板,每孔200 μL,37 ℃、5% CO2饱和湿度培养箱进行培养24 h,待细胞贴壁融合生长至70%时,每孔加入200 μL T/E消化细胞,收集细胞悬液,混匀至tube管中,按照细胞凋亡试剂盒操作说明书检测各组细胞凋亡情况,用流式细胞仪检测各组细胞凋亡情况,每组实验重复3次。
1.2.8Western blot检测细胞周期/凋亡蛋白表达情况
取各组对数生长期细胞,用1.5%胰酶消化,均匀铺板至6孔板,待细胞生长融合至80%时,去细胞悬液,1×PBS溶液清洗3次,采用RIPA冰上消化裂解30 min,3 000 r/min离心10 min,取上清液进行BCA蛋白定量,按照试剂盒说明书进行,使用LB溶液制备电泳样品,采用十二烷基硫酸钠-聚丙烯酸酰胺凝胶电泳(SDS-PAGE)分离,转膜,封闭(5% BSA),孵育兔抗TET2、Cyclin D1/E1、CDK1/2、Bax、PARP一抗4 ℃冰箱过夜,1×PBS溶液清洗3次,孵育IgG二抗2 h后,加入ECL显色液,多功能呈象系统曝光成像,采用Image J进行蛋白定量分析。
1.3 统计学处理
2 结 果
2.1 qPCR检测组织和细胞中CircRNA-1565的表达情况
与肺癌组织比较,癌旁组织CircRNA-1565表达水平明显降低(P<0.05),A549细胞CircRNA-1565表达水平明显高于其他肺癌细胞系(P<0.05),见图1。

A:CircRNA-1565 在不同组织中的表达; B:CircRNA-1565 在不同细胞系中的表达;a:P<0.05,与癌组织比较;b:P<0.05,与其他细胞系比较。图1 CircRNA-1565在肺癌不同组织和细胞系中表达情况
2.2 qPCR检测CircRNA-1565和TET2在各组细胞中的表达情况
与对照组和阴性对照组比较,实验组细胞CircRNA-1565和TET2表达水平明显降低(P<0.05),见图2。

a:P<0.05,与对照组和阴性对照组比较。图2 CircRNA-1565和TET2在各组细胞中的表达情况
2.3 MTT检测各组细胞活性
与阴性对照组比较,实验组细胞增殖活性明显降低(P<0.01),见图3。

a:P<0.05,与对照组比较。图3 MTT检测各组细胞增殖活性
2.4 细胞周期检测
与对照组和阴性对照组比较,低表达CircRNA-1565的实验组A549细胞G0/G1期和G2/M细胞比例增加,而S期细胞比例降低(P<0.05),见图4。

a:P<0.05,与对照组和阴性对照组比较。图4 流式细胞术检测各组细胞周期
2.5 细胞凋亡检测
与对照组和空白对照组比较,实验组A549细胞经转染 CircRNA-1565反义基因序列后凋亡率上升,差异有统计学意义(P<0.05),见图5。

a:P<0.05,与对照组和阴性对照组比较。图5 流式细胞术检测各组细胞凋亡情况
2.6 Western blot检测细胞蛋白表达情况
与对照组和阴性对照组比较,实验组细胞TET2蛋白、细胞周期蛋白Cyclin D1/E1、CDK1/2表达水平明显下调,凋亡蛋白Bax、PARP表达水平明显上调(P<0.05),见图6。
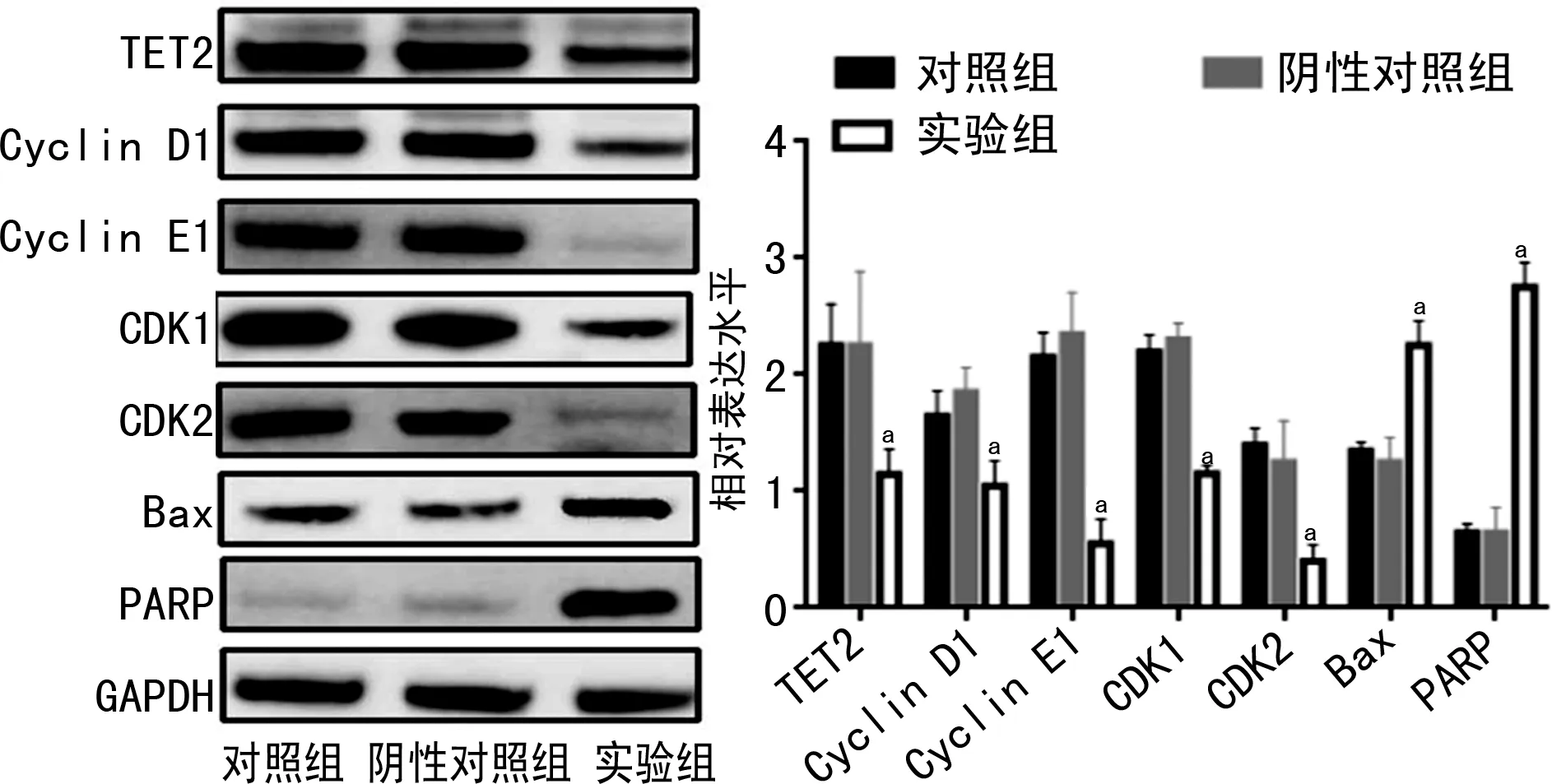
a:P<0.05,与对照组和阴性对照组比较。图6 Western blot检测各组细胞蛋白表达情况
3 讨 论
肺癌是一种常见的恶性肿瘤,其较高的发病率(11.6%)和病死率(18.4%),极大地影响了我国居民健康水平的改善[6]。肺癌分为鳞癌、腺癌、大细胞肺癌、小细胞肺癌4种,其中NSCLC占肺癌的80%~85%[7]。NSCLC的发生、发展涉及多种影响因素,早期诊断治疗对NSCLC的防治具有重要意义。研究NSCLC的分子机制,寻找新型的肿瘤标志物和分子靶点已经成为了性新的研究热点。
CircRNA是一种由共价键形成的闭合环状RNA,广泛参与了细胞调节、免疫自稳、组织发育等生命活动[8-9]。CircRNA作为内源性非编码RNA包含多个miRNA结合位点,可与U1 snRNP、RNA聚合酶Ⅱ等蛋白相互作用,竞争性结合miRNA的作用靶点,具有miRNAsponge的作用[10-11]。研究CircRNA的表达与多种肿瘤的发生密切相关,CircRNA-001569可通过miR-145/HBXIP轴影响乳腺癌细胞恶性生物学行为,CircRNA-001287可通过CEP55促进肾癌细胞的增殖,CircRNA-HIPK3、LARP4、ZNF609也被证实在鼻咽癌中异常表达[12-13]。CircRNA-1565是一种新发现的CircRNA,目前已经发现CircRNA-1565在前列腺癌、胰腺癌、食管癌的产生过程中发挥重要作用[14-15],而CircRNA-1565在NSCLC方面的研究报道较少,因此,本研究选择CircRNA-1565为研究对象,通过构建CircRNA-1565低表达A549细胞系,观察CircRNA-1565对非小细胞肺癌A549细胞增殖、细胞周期和凋亡的影响。
研究结果显示,相对于NSCLC患者癌旁组织,肺癌组织中CircRNA-1565表达水平明显增高,说明CircRNA-1565与肺癌的发展密切相关。qPCR选择CircRNA-1565高表达细胞系A549细胞,通过转染沉默质粒构建CircRNA-1565低表达细胞系。10-11转位酶2(TET2) 一种催化甲基胞嘧啶转化为5-羟甲基胞嘧啶,启动基因去甲基化的甲基胞嘧啶双加氧酶[16]。TET2的高表达可激活经典癌症Wnt/β-catenin通路的表达,促进肝癌、肺癌、胰腺癌等多种癌症产生且与肿瘤细胞的细胞周期、细胞凋亡密切相关[17]。qPCR检测各组A549细胞中CircRNA-1565和TET2表达情况,结果显示,与对照组比较,实验组细胞CircRNA-1565和TET2表达水平同时降低,说明CircRNA-1565与TET2呈正相关。MTT结果显示,与对照组A549细胞比较,实验组低表达CircRNA-1565 A549细胞增殖活性明显降低。流式细胞仪检测各组细胞细胞周期和凋亡情况,实验组细胞在G0/G1期和G2/M细胞比例增加,而S期细胞比例降低,同时实验组细胞凋亡率上升,说明CircRNA-1565具有促进A549细胞增殖活性、抑制细胞凋亡的作用。为了进一步明确具体的分子机制,本研究采用Western blot检测各组细胞周期蛋白Cyclin D1/E1、CDK1/2和凋亡蛋白Bax、PARP的表达。Cyclin D1/E1、CDK1/2、Cyclin D1/E1可与CDK1/2结合形成周期蛋白复合物直接促进细胞成熟进行有丝分裂,推进细胞周期运行[18-22]。DNA修复酶PARP是细胞凋亡核心成员半胱天冬酶的切割底物,可通过识别结构损伤的DNA片段而被激活,被认为是细胞凋亡的感受器[23-25]。结果显示,经转染 CircRNA-1565反义基因序列质粒后,实验组A549细胞TET2蛋白、细胞周期蛋白Cyclin D1/E1、CDK1/2表达水平明显下调,凋亡蛋白Bax、PARP表达水平明显上调。说明CircRNA-1565可能通过抑制TET2基因的表达,进而诱导细胞周期蛋白下调,凋亡蛋白下调控制A549细胞的周期和凋亡。
综上所述,CircRNA-1565在NSCLC患者癌组织中高表达,低表达CircRNA-1565可抑制A549细胞的增殖活性和细胞周期,促进细胞凋亡。其具体的作用机制可能与CircRNA-1565通过TET2基因调控细胞周期蛋白Cyclin D1/E1、CDK1/2和凋亡蛋白Bax、PARP的表达有关。CircRNA-1565具有成为NSCLC肿瘤诊断标志物和分子治疗靶点的潜在价值,其具体的作用机制有待进一步研究明确。

