CCL2/CCL3及CCR5在功能磁共振鉴定骨关节炎不同阶段的表达
孙世宇,吴 鹏,常 涛,张婷婷,陈明慧,俞红丽,牛小引,赵 璇
(1.同济大学附属第十人民医院麻醉科,上海 200072; 2.同济大学附属第十人民医院骨科,上海 200072)
到目前为止,全球有超过2.4亿人患有临床症状的骨关节炎,其中大约28%为60岁以上的老年患者[1-3]。骨关节炎(osteoarthritis,OA)常累及膝关节,可诱发关节水肿,造成关节畸形,影响患者的日常活动[4-6],且长时间的炎症可导致剧烈的慢性疼痛[7-8]。关节软骨不仅可以降低关节的受力,还可以减少关节的摩擦力[9-11],因此从广义上来说,OA病变即软骨病变。但由于关节内部结构及软骨中各种细胞因子交互复杂,OA的病理生理机制至今不明确。
随着MRI技术的飞速发展,MRI的应用对于评估骨关节疾病蕴含着巨大潜力[12-13]。Shao等[14]用超短回波磁共振成像(ultrashort echo magnetic resonance imaging,UTE MRI)动态监测TKA术后离体股骨髁软骨标本的变化,结果表明,UTE MRI成像具有准确、无创的特点,有利于诊断早期OA,并对其行早期干预。本研究将UTE MRI成像用于评估OA的严重程度,并用Mankin评分辅助OA分级并验证UTE MRI成像对于评估OA的准确性。
1 资料与方法
1.1 一般资料
选取2020年6月—12月同济大学附属第十人民医院骨科因OA行人工全膝关节置换术(total knee arthroplasty, TKA)的18例患者离体股骨髁软骨标本。纳入标准:患者年龄60~75岁;行单侧全膝关节置换手术。排除标准:类风湿性关节炎、股骨头坏死、关节周围骨折、4周内行免疫治疗或者镇痛治疗等治疗措施、感染、神经性关节病、肢端肥大症、骨软骨瘤;近1年内行膝关节镜手术;近6个月关节内注射或系统性使用(口服、静脉或肌内注射)类固醇药物。
1.2 方法
1.2.1 磁共振扫描 对所有患者的离体股骨髁软骨标本进行UTE MRI扫描。标本离体后清除股骨髁周围软组织,然后经过股骨髁中心层面取厚度约为5 mm的厚片,用生理盐水浸过的纱布包绕后放入-80 ℃冰箱,待MRI扫描,扫描使用3.0T MRI扫描仪。离体股骨髁软骨标本薄片放置在全氟溴辛烷溶液中,扫描时标本及线圈均置于MRI扫描仪正中央,标本的长轴与B0磁场平行。扫描序列为2D UTE T2*序列,图像只采集标本中央单层图,每个序列扫描用时3 min。当进行MRI的感兴趣区采集时,每个股骨髁标本的关节软骨分别于各层(软骨钙化层及表层关节软骨)从左向右依次采集5个感兴趣区进行UTE T2*分析,具体采集方法见图1。

图1 离体标本采集方法
1.2.2 免疫组织化学法 将扫描后的离体股骨髁软骨标本用乙二胺四乙酸浸泡脱钙,然后分为两部分,一部分行Safanin-O染色,由有8年关节软骨研究经验的病理学医生根据Mankin评分标准进行评级。1级为正常软骨组织(Mankin得分为0~1分),2级为轻度软骨退变(2~5分),3级为中度软骨退变(6~9分),4级为重度软骨退变(10~14分),见表1。所有股骨髁标本的关节软骨的采集方法与MRI所使用的相一致。根据病理染色Mankin评分标准从行全膝关节置换手术的患者中选取3组:2级OA组(Mankin评分2~5分)、3级OA组(Mankin评分6~9分)、4级OA组(Mankin评分10~14分);每组6例患者,共18例患者。将此3组患者Safanin-O染色后剩下的一部分离体股骨髁软骨标本切片,用免疫荧光法分析切片中CCL2、CCL3、CCR5表达情况。

表1 Mankin评分标准
1.3 统计学处理

2 结 果
2.1 3组患者一般情况比较
3组患者的年龄、体质量指数(body mass index, BMI)、性别差异均无统计学意义,见表2。

表2 三组患者一般情况比较
2.2 OA级别高组的患者磁共振影像显示骨关节炎严重
本次研究将所有患者离体股骨髁软骨标本先行磁共振扫描,然后行Safanin-O染色Mankin评分,根据Mankin评分结果将OA患者分为三级并入组,OA级别越高磁共振显示骨关节破坏越严重,见图2、表3。
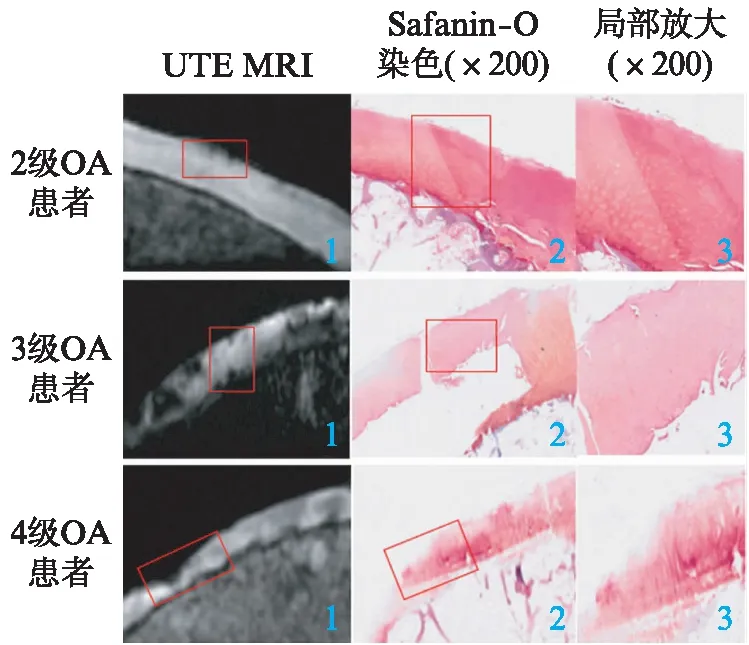
图2 离体股骨髁软骨标本UTE MRI成像

表3 部分不同等级OA股骨髁标本Safanin-O染色后的Mankin评分
2.3 OA级别高组患者的股骨髁CCL2、CCL3及CCR5表达增加
本次研究根据Mankin评分将OA患者的股骨髁标本分为三级,OA级别高组的患者骨关节破坏严重,且其股骨髁标本CCL2表达增加,CCL3及CCR5表达也增加,见表4及图3~5。
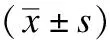
表4 不同等级OA股骨髁标本CCL2、CCL3、CCR5的表达阳性百分比

图3 Mankin评分为4分的2级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
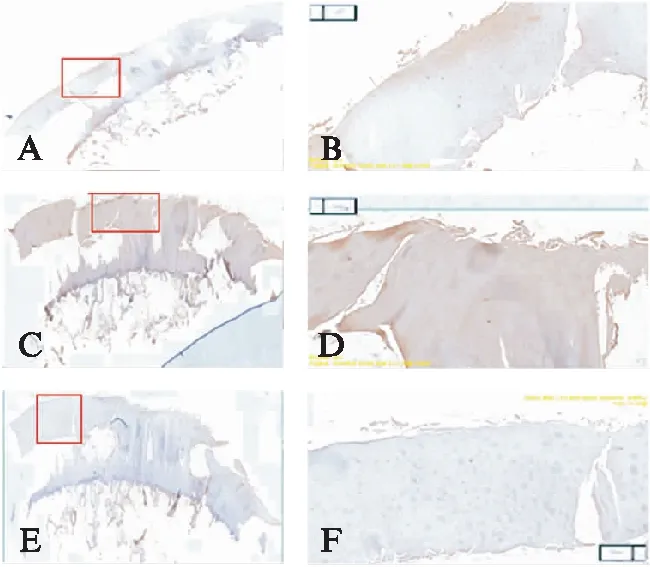
图4 Mankin评分为6分的3级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
3 讨 论
早中期OA患者常伴发关节疼痛,临床多采用关节腔内注射药物治疗;一项Meta分析表明,关节腔内注射药物只能暂时缓解OA患者疼痛及软骨变性,无法根治[15];OA患者在早中期缺乏有效的干预手段[16]。晚期OA病变主要为软骨变性脱落,目前彻底根治OA最有效的治疗方法是TKA,只有这种疗法可以恢复晚期OA患者的关节活动[4],但是TKA手术价格高昂且易发生术后疼痛,对TKA手术患者造成二次痛苦[17]。其他治疗手段如保守治疗、关节腔内注射治疗等都不能彻底解决骨关节炎损伤的问题。造成这一现象的主要原因是目前OA的发生发展机制尚不清楚,因此不能有效地对OA行早期干预与治疗。故目前须探讨OA发生发展中趋化因子表达机制,在OA的早期或者超早期进行诊断与干预,有效地减少老年患者中晚期OA的发生率,降低患者行TKA的概率。

图5 Mankin评分为10分的4级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
CCL2是CC类趋化因子家族中的成员,可调控疼痛的发生与发展[18-20];CCL3参与调控糖尿病小鼠神经病理性疼痛发展[21]。CCR5是一种7跨膜G蛋白偶联受体,在疼痛的发生与发展过程中有重要作用[22]。研究表明,在OA患者中,炎症因子及趋化因子的增加可诱发并加剧骨关节炎疼痛,加速骨关节功能退化[3]。有文献报道,CCR5表达上调可加重OA的骨质破坏[23],且严重膝关节炎患者血浆的CCL3浓度也会增高[24]。也有研究显示,CCL2在OA患者的软骨破坏及炎症进展中有重要作用,而CCR5作用甚微[25]。所以CCL2及CCR5在OA中对骨关节软骨损伤作用尚存在争论,故CCL2、CCL3及CCR5在骨关节炎发生发展中的表达及作用机制需进一步确认。
研究表明,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可刺激CCL2表达,CCL2诱发巨噬细胞聚集并使其极化为M1型巨噬细胞和M2型巨噬细胞[26]。M1型巨噬细胞是分泌促炎因子的促炎型细胞,M2型巨噬细胞是抗炎型细胞[27];M1和M2型巨噬细胞的失衡情况可以直接反映膝关节OA的严重程度。相比正常时,M1型巨噬细胞越多,M2型巨噬细胞越少,膝关节OA病理越严重[28]。OA患者骨质破坏越严重,其M1型巨噬细胞数量远超过M2型巨噬细胞。有研究[29]先在OA患者中注射一种新型成像剂,然后用CT扫描观察OA患者骨关节中巨噬细胞的动态变化;结果提示OA患者严重程度和巨噬细胞的数量有显著关系。相对于CT扫描,UTE MRI基本不具有放射性,用于临床更利于患者接受,所以本次研究用UTE MRI评估OA患者的严重程度,并探讨其股骨髁软骨中趋化因子的表达情况。
本研究将OA患者术后的股骨髁软骨离体标本行UTE MRI扫描,扫描完成后Safanin-O染色,根据Mankin评分对标本分级入组;每组标本行免疫组化检测其中趋化因子的表达情况。结果显示,相对于低级别OA组,高级别OA组中CCL2、CCL3、CCR5表达增加。本研究结果表明,UTE MRI可用于评估OA的严重程度;且CCL2、CCL3、CCR5的表达与OA患者的关节破坏严重程度呈正相关。据此,可采用UTE MRI的方法在早期诊断骨关节炎且阻断关节中CCL2、CCL3、CCR5的高表达,达到延缓甚至治疗OA的目的。但此次研究尚有欠缺,研究中没有探讨CCL2、CCL3、CCR5通过何种机制影响膝关节中巨噬细胞的表达,后续还需进一步试验证明。

