湿解西兰花尾菜制备富里酸及其抗氧化活性研究
李顺勤,贾永秀,贾洪玉,隋文杰*,张 民,刘 锐,吴 涛
(1.天津科技大学省部共建食品营养与安全国家重点实验室,天津 300457;2.天津科技大学食品科学与工程学院,天津 300457;3.山东省农业科学院农业资源与环境研究所,山东济南 250100;4.天津农学院,天津 300384)
尾菜是指蔬菜在种植、采收、运输、销售及生产加工环节中无法利用或被抛弃的部分[1-3]。尾菜含水率一般70%~95%,pH 6.0~9.0,可溶性固形物含量5%~19%,主要干物质包括纤维素、半纤维素、木质素、碳水化合物、蛋白质、脂质、矿物质、维生素等[4-5]。大规模无法利用的尾菜,造成严重的资源浪费和环境污染[6]。据国家统计局数据显示,2019 年我国蔬菜年产量在7.9 亿t 以上,尾菜量保守估计至少达2.63 亿t[7]。因此,尾菜治理与资源化利用已成为亟需解决的难题。
目前,尾菜的处理方式主要有直接还田、堆肥、青贮饲料与沼气利用等,在实际处理中受制于占地面积大、处理周期长与产品附加值低等多种因素[8-10]。湿解技术作为一种常用的生物质水热预处理手段,已逐渐被用于食品领域[11-13]。将尾菜置于反应罐,利用饱和蒸汽加热达到设定温度,并维持一定时间,短时间内使尾菜组织快速升温升压,促进物料发生水热降解与聚合反应,经过一系列缩合反应,从而转化成为稳定的腐植酸类物质[14-15]。腐植酸(humic substances,HS)是一类呈棕黑色或棕褐色,酸性、无定形的有机大分子物质。依据溶解性差异,腐植酸可分为富里酸、胡敏酸和胡敏素[16]。其中,富里酸(fulvic acid,FA)具有水溶性好、分子量小、氧化还原能力较强等优点,含羧基、羟基、酚羟基等多种活性官能团,在消炎、减轻溃疡、抗氧化等方面有显著疗效[17-19]。
基于以上尾菜产生与利用过程中存在的处理周期长、产品附加值低的问题,本研究采用湿解技术处理西兰花废弃根茎并从中提取纯化得到富里酸,并进一步考察富里酸的总还原能力以及对ABTS+自由基、DPPH 自由基、羟基自由基(·OH)、超氧阴离子自由基(O2·-)的清除能力,为尾菜资源化利用及产品开发提供技术指导。
1 材料与方法
1.1 材料与试剂
西兰花根茎,收集于天津科技大学泰达校区第二学生餐厅。
无水乙醇、氢氧化钠、抗坏血酸钠、过硫酸钾、过氧化氢、水杨酸、磷酸二氢钠、硫酸亚铁、磷酸氢二钠、邻苯三酚、铁氰化钾、三氯化铁与三氯乙酸等,均为分析纯,购自国药化学试剂有限责任公司。
三羟甲基氨基甲烷、ABTS、DPPH,生化试剂,国药化学试剂有限责任公司。
浓盐酸(质量分数36%~38%),天津市风船化学试剂科技有限公司。
1.2 仪器与设备
QBS-200B 试验台,河南鹤壁正道生物能源有限公司;CP64 电子天平(0.000 1 g),上海奥豪斯仪器有限公司;MODULYOD-203 真空冷冻干燥机,美国Thermo fisher 科技公司;DH-101 电热恒温鼓风干燥箱,天津中环实验电炉公司;XMTD-204 数显式电热恒温水浴锅,天津市欧诺仪器仪表有限公司;SHZ-82A 振荡器,常州国华电器有限公司;TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 富里酸制备
1.3.1 西兰花湿解处理
将新鲜的西兰花根茎切片,于70 ℃鼓风干燥箱中烘至相对含水率为40%。取250.0 g 原料置于反应罐内,通入饱和水蒸气至1.1 MPa(184 ℃)、1.7 MPa(204 ℃)与2.3 MPa(220 ℃),并维持10 min,迅速打开卸料阀泄压放料,收集湿解物料,自然风干后保存待用。
1.3.2 富里酸提取纯化
将湿解物料与原料置于105 ℃鼓风干燥箱中干燥4 h,参考NY/T 1867—2010 富里酸含量测定[20]。参考IHSS推荐的方法,提取纯化富里酸[21]。称取3.0 g 湿解物料或原料,加入0.1 mol/L 氯化氢溶液100.0 mL,在室温下振荡提取,1 h 后放置过夜,摇匀离心,并用中速滤纸过滤,滤液即为富里酸。并采用XAD-8 型树脂和钠型732 阳离子交换树脂柱进行洗脱纯化,冷冻干燥后于70 ℃鼓风干燥箱内烘干,研细并称量质量,即得纯化富里酸样品。
1.4 富里酸抗氧化性测定
1.4.1 ABTS+自由基清除率测定
参考包骐林等[22]的方法。称取20.0 mg 富里酸,加20 mL 蒸馏水配制成1.0 mg/mL,分别稀释为不同梯度富里酸溶液(0.001~1.0 mg/mL)。
ABTS 溶液配制方法:称取过硫酸钾与ABTS,配制成终浓度为7.0 mmol/L 的溶液,在黑暗室温下反应12 h。设定波长为734 nm,采用pH 7.4 的PBS 缓冲液稀释反应液至吸光度值A0为0.7±0.02,作为待用溶液。
吸取2.0 mL 不同浓度富里酸溶液(0.001~0.05 mg/mL),加入4.0 mL ABTS 稀释液,紧接着涡旋30 s,于室温下避光反应10 min。以VC 为阳性对照,在734 nm处测定吸光度值A1。通过公式(1)计算其对ABTS+自由基的清除率。

1.4.2 DPPH 自由基清除率测定
参考左玉等[18]的方法。样品溶液配制方法如1.4.1 所述。加入2.0 mL、0.10 mmol/L DPPH 溶液,涡旋30 s,在黑暗室温下反应30 min。设定波长为517 nm,以蒸馏水为参比,测定样品反应液吸光度,记为A1。将2.0 mL DPPH溶液与2.0 mL 蒸馏水振荡均匀测定吸光度A0。将2.0 mL无水乙醇与2.0 mL 样品溶液振荡均匀,测定吸光度A2。按照公式(2)计算其对DPPH 自由基的清除率。

1.4.3 羟基自由基(·OH)清除率测定
参考段景峰等[23]的方法。样品溶液配制方法如1.4.1所述。取2.0 mL 6 mmol/L 过氧化氢溶液、2.0 mL 6 mmol/L FeSO4溶液与2.0 mL 样品溶液,振荡均匀,置于37 ℃水浴锅中反应10 min,紧接着加入2.0 mL 6 mmol/L水杨酸溶液,置于水浴锅中反应30 min 后取出。设定波长为510 nm,以蒸馏水为参比,测定样品反应液的吸光度,记为A1。同理2.0 mL 过氧化氢溶液、2.0 mL FeSO4溶液、2.0 mL 蒸馏水、2.0 mL 样品溶液振荡均匀,测定吸光度A2。2.0 mL 过氧化氢溶液、2.0 mL FeSO4溶液、4.0 mL蒸馏水振荡均匀,测定吸光度A0。按照公式(3)计算其对·OH 自由基的清除率。

1.4.4 超氧阴离子自由基(O2·-)清除率测定
参考左玉等[18,23]的方法,样品溶液配制方法如1.4.1所述。预先设定水浴锅温度为25 ℃,取pH 8.2 的Tris-HCl 缓冲溶液5.0 mL 于试管中,置于水浴锅20 min。将0.5 mL 邻苯三酚溶液(浓度5.0×10-3mol/L)与2.0 mL 样品溶液依次加入,涡旋30 s,进行水浴反应4 min。设定波长为320 nm,以1.0×10-2mol/L HCl 溶液为参比,测定样品反应液的吸光度A1;将上述样品溶液替换为2.0 mL 蒸馏水,测定吸光度A0;将邻苯三酚溶液替换为0.5 mL HCl 溶液,测定吸光度A2。按照公式(4)计算其对O2·-自由基的清除率。

1.4.5 总还原力测定
参考左玉等[18]报道的方法,样品溶液配制方法如1.4.1所述。取1.0 mL 样品于试管中,依次加入磷酸盐缓冲液(pH 6.6、0.2 mol/L)2.0 mL 和1%铁氰化钾溶液2.0 mL,涡旋30 s,置于50 ℃水浴锅中反应20 min 后,加入10%三氯乙酸溶液2.0 mL 结束反应。取上述反应液2.0 mL 于试管中,依次加入2.0 mL 蒸馏水、0.4 mL 三氯化铁(质量分数为0.1%),在室温下避光反应30 min。设定波长为700 nm,测定样品反应液与平行实验组吸光度值,取平均值。
1.5 数据处理
数据处理利用SPSS statistics 24 统计软件,组间比较采用单因素方差分析(One-Way ANOVA),检验水准P<0.05,作图采用Origin 9.0 软件。
2 结果与分析
2.1 湿解富里酸条件优化
如图1 所示,未纯化前,原料直接提取的富里酸含量为118.1 g/kg;随着湿解温度的增加,富里酸含量呈逐渐增加的趋势,当条件为220 ℃、10 min 时,湿解后富里酸含量最高,为166.6 g/kg,较原料直接提取提高了38.0%。研究结果表明,湿解处理可以提高物料中富里酸含量。
由于提取方法为酸提,未纯化的富里酸中可能含有大量的单糖、氨基酸、多肽等物质,为考察湿解处理对富里酸得率的实质影响,进一步对粗富里酸进行树脂纯化分离。如图1 所示,原料中的富里酸纯化后得率为6.1 g/kg;湿解温度为204 ℃时,纯化后富里酸得率最高,为32.9 g/kg,为原料提取的5.4 倍;随着湿解温度的增加,富里酸得率呈先上升后降低的趋势,说明湿解处理可促进半纤维素中乙酰基的断裂,显著提高富里酸产率;但温度过高,过于激烈的反应环境不利于半纤维素、纤维素等物质降解产物的稳定存在,促使富里酸进一步缩聚或降解为甲酸、糠醛等挥发性成分。因此,湿解富里酸的最适条件为204 ℃、10 min。

图1 纯化前后湿解富里酸的得率Fig.1 The yield of FA from treated samples before and after purification
2.2 富里酸对ABTS+自由基的清除能力
如图2 所示,随着浓度增加,富里酸清除ABTS+自由基的效果明显增强。以VC 作为对照,发现富里酸具有较强的ABTS+自由基清除能力。当添加量为0.05 mg/mL时,富里酸对ABTS+自由基清除率为98.9%。富里酸中羧基和醌基等官能团形成的芳香共轭体系,同APTS+自由基结合变为ABTS,导致溶液蓝绿色减弱或消失[19]。

图2 富里酸的ABTS+自由基清除率Fig.2 APTS+radical scavenging of FA
2.3 富里酸对DPPH 自由基的清除能力
DPPH 自由基是一种稳定的含氮芳香环自由基[24]。如图3 所示,在0.01~1.0 mg/mL 范围内,随着浓度的增加,富里酸清除DPPH 自由基作用明显增强;当添加浓度为0.50 mg/mL 时,富里酸对DPPH 自由基清除率为97.4%,同富里酸浓度为1.00 mg/mL 时对DPPH 自由基的清除率相近。研究结果表明,富里酸具有较强的DPPH 自由基清除能力,可能是破坏了N-中心自由基稳定性而达到清除效果。富里酸中羧基和醌基等官能团形成的芳香共轭体系[18],同DPPH 自由基的孤对电子配对,导致吸收度减弱或消失[19],富里酸对DPPH 自由基清除作用与浓度呈一定线性量效关系。
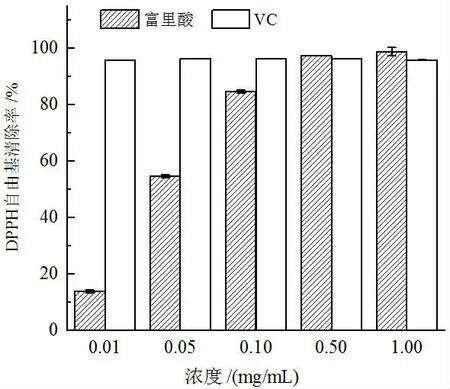
图3 富里酸的DPPH 自由基清除率Fig.3 DPPH radical scavenging capacity of FA
2.4 富里酸对羟基自由基(·OH)的清除能力
如图4 所示,在0.2~1.5 mg/mL 范围内,富里酸清除·OH 的能力随浓度增加而逐渐增强。当添加浓度为1.5 mg/mL 时,富里酸对·OH 清除率为43.3%,同等浓度下VC(对照)对·OH 清除率接近100%。研究结果表明,富里酸具有一定的·OH 清除能力。·OH 是导致体内脂质过氧化反应的一种活跃的自由基[19],富里酸中活性基团同羟基自由基结合,终止自由基介导的氧化链式反应,抑制脂质过氧化[19]。

图4 富里酸的·OH 清除率Fig.4 ·OH scavenging of FA
2.5 富里酸对超氧阴离子自由基(O2·-)的清除能力
O2·-在人体中数量众多且分布最广。如图5 所示,在0.05~1.0 mg/mL 范围内,富里酸清除O2·-作用随着浓度增加逐渐增强。当浓度达到1.0 mg/mL 时,富里酸的O2·-清除率为56.7%,同等浓度下VC(对照)的O2·-清除率为99.9%。研究结果表明,富里酸具有一定的O2·-清除作用。富里酸中羧基和醌基等官能团形成的芳香共轭体系,同O2·-结合,达到清除效果[19],且富里酸的O2·-清除作用与浓度呈正相关。

图5 富里酸的O2·-清除率Fig.5 O2·-scavenging of FA
2.6 富里酸总还原力
如图6 所示,随着浓度增加,富里酸的总还原力逐渐增大。当浓度为0.5 mg/mL 时,富里酸的总还原力吸光值为1.0;以同等浓度VC 为对照,其吸光度值为3.3。研究结果表明,富里酸总还原力为VC 的三分之一左右,具有一定的还原能力。富里酸中的部分活性基团作为电子给予体,将Fe3+还原为Fe2+,破坏自由基链反应的电子供体,达到清除自由基的效果[19]。

图6 富里酸的总还原力Fig.6 Reduction capacity of FA
3 结论
研究表明,以富里酸得率为指标,得出湿解处理西兰花根茎的最适条件为204 ℃、10 min,富里酸得率为162.96 g/kg,相比原料提高38.0%。进一步采用酸提、XAD-8 型树脂和钠型732 阳离子交换树脂制备富里酸,经纯化后富里酸得率为32.9 g/kg。在0.5 mg/mL 添加浓度下,湿解富里酸对ABTS+自由基和DPPH 自由基的清除率超过90%,对羟基自由基和超氧阴离子自由基的清除率分别为14.1%与32.3%。可见,富里酸具有较强的ABTS+自由基、DPPH 自由基清除能力,以及一定的羟基自由基、超氧阴离子自由基清除能力,且随着湿解富里酸浓度的增加,其抗氧化作用增强。

