超高温堆肥过程中微生物群落及其理化性质研究
王艳成, 黄升日, 董微巍, 申鹏飞, 朴春香
( 1.延边大学 农学院, 吉林 延吉 133000; 2.吉林省和龙市工商业联合会, 吉林 和龙 133400 )
超高温堆肥作为一种新型堆肥技术,因其可加速有机物分解和缩短堆肥腐熟时间而受到广大学者的关注[1-2].研究表明,微生物在堆肥过程中对堆肥品质具有决定性作用[3-5].廖汉鹏等将极端嗜热微生物菌剂添加在脱水污泥的超高温堆肥中,经过15~20 d超高温好氧发酵处理实现了污泥(初始含水率为80%)的生物干化和高温腐熟[6].Peng等利用极端的嗜热菌剂显著降低了堆体(新鲜鸡粪和稻壳)中的N2O排放[7].由于超高温堆肥环境(堆肥过程中的温度高于100 ℃,堆肥时间超过6周)与普通环境不同,因此超高温堆肥所产生的微生物种类、数目及其理化性质(温度、pH、含水率和C/N)与普通环境下产生的微生物种类、数目及其理化性质有很大区别.目前,对超高温堆肥过程中微生物类群变化的相关研究较少[8-10],因此本文采用聚合酶链式反应 - 变性梯度凝胶电泳(PCR - DGGE)方法对微生物群落组成进行探讨,并测定了超高温堆肥过程中温度、pH、含水率以及C/N等理化指标的变化情况,以期为超高温生境下畜禽类便的微生物资源的开发和利用提供参考.
1 材料与方法
1.1 堆置装置与材料
自引发式堆肥装置主体由两层不锈钢材料制成,如图1所示.该装置长、宽、高为5.5 m、4.2 m、2.0 m,装置中层(保温层)添加的是厚度为50 mm的聚氨酯.发酵过程中采用底部加压通风的方式(通风管道直径Φ=0.38 m),利用重型设备移动和混合料堆.试验材料采用有机废弃物(由牛粪、羊粪、马粪、木屑组成)和全发酵堆肥,并按质量比1∶1混合接种.
1.2 试验设计
利用图1中的实验装置设计高温堆肥实验.实验采用每周翻堆混匀工艺.实验中采用活性白土将堆体的含水率调整至60%,采用尿素将C/N调整至30,并进行强制通风供氧(曝气量控制在0.1 L/min左右).采样点设置为3个(图1中a、b、c点),采样时间为发酵的第7、14、21、28 d和35 d.在每个采样点随机采集3份样品,且将采集的样品混合均匀后再分装3份,以此保证样品的代表性.采集后的样品立即放入液氮中并带回实验室中保存(-70 ℃)备用.

图1 自引发式堆肥装置及采样点示意图
1.3 样品分析
1.3.1堆体理化指标的检测
按文献[11]中的方法测定a、b、c 采样点样品的温度、pH值、含水率和C/N.
1.3.2样品的DNA提取及PCR扩增
取堆肥样品各0.3 g,采用强力土壤DNA提取试剂盒(美国,MOBIO)提取基因组DNA,并将提取好的DNA用超纯水稀释20倍后继续作扩增实验.采用引物GC - 341F(5′- CGC - CCG - CCG - CGC - GCG - GGC - GGG - GCG - GGG - GCA - CGG - GGG - GCC - TACGGGAGG - CAG - CAG - 3′)和907R(5′- CCG - TCA - ATT - CMT - TTR - AGT - 3′)对样品的微生物DNA进行PCR扩增.PCR 反应体系为: 2×Taq Master Mix 25 μL, 10 μmol/L 上下游引物各1 μL, DNA 1 μL, 双蒸水22 μL, 共计50 μL.扩增反应程序为: 95 ℃初始变性10 min, 93 ℃变性30 s, 65 ℃退火30 s, 60 ℃退火30 s, 55 ℃退火30 s, 25个循环, 72 ℃延伸8 min, 于4 ℃保存.扩增目标基因片段大小约为576 bp.
1.3.3变性梯度凝胶电泳(DGGE)的检测
利用变性梯度凝胶电泳分离PCR 扩增产物,使用DCodeTM通用突变检测系统(Bio - Rad,Hercules,CA,USA)评估DGGE[12].变性梯度凝胶的制备方法为:在pH 7.4的20 mmol/L Tris缓冲液中加入0.5 mmol/L乙二胺四乙酸(EDTA)和10 mmol/L醋酸钠,制备过程所用的试剂为聚丙烯酰胺(质量分数为8%~12%)、尿素(1.4~4.9 mol/L)和变性剂(质量分数为30%~70%).制备出的变性梯度凝胶的长、宽、高分别为160 mm、60 mm、1 mm.凝胶制备完成后,将其放在20 mmol/L Tris缓冲液(pH 8.0)中电泳850 min(电压为100 V,温度为60 ℃),然后利用SYBR Green I对凝胶染色30 min.染色完成后,利用凝胶影像分析系统观察凝胶并拍照.采用Quantity One 软件分析所拍摄的图像.
1.3.4条带回收及测序方法
将清晰单一的条带进行切割后溶于50 μL超纯水(4 ℃)放置24 h,然后继续PCR扩增、DGGE电泳、切胶,直到条带清晰并单一.切下处理好后的代表性条带装入1.5 mL离心管中,并按SK8131试剂盒方法回收目的DNA片段.取适量回收的DNA做模板并进行PCR扩增(扩增条件及步骤同1.3.2方法),然后将产物送至日本三岛信息生物学中心进行测序.利用DNA数据库提供的DDBJ - Blast程序对所得条带进行系统发育分析.
1.4 数据处理
采用OriginPro 2021软件对数据进行计算、作图.
2 结果与分析
2.1 堆体温度的变化情况
微生物生长繁殖的最适温度为30~60 ℃.当温度高于65 ℃时,大多数微生物转变为芽孢休眠,只有少部分嗜热菌可以继续存活[13].由图2可知,堆体的温度变化趋势主要分为2个阶段.第1阶段为快速升温期(0~7 d), 3个采样点的堆体温度均在第7 d达到峰值,分别为91.0 ℃、104.0 ℃和50.0 ℃.其原因是好氧微生物能够快速分解物料中的可降解有机物,并释放能量,进而快速提高堆体温度.第2阶段为缓慢降温期(7~35 d),该阶段堆体温度从峰值缓慢下降至略高于室温.其原因是堆体中的有机物含量减少,使得微生物活性和热量下降所致.
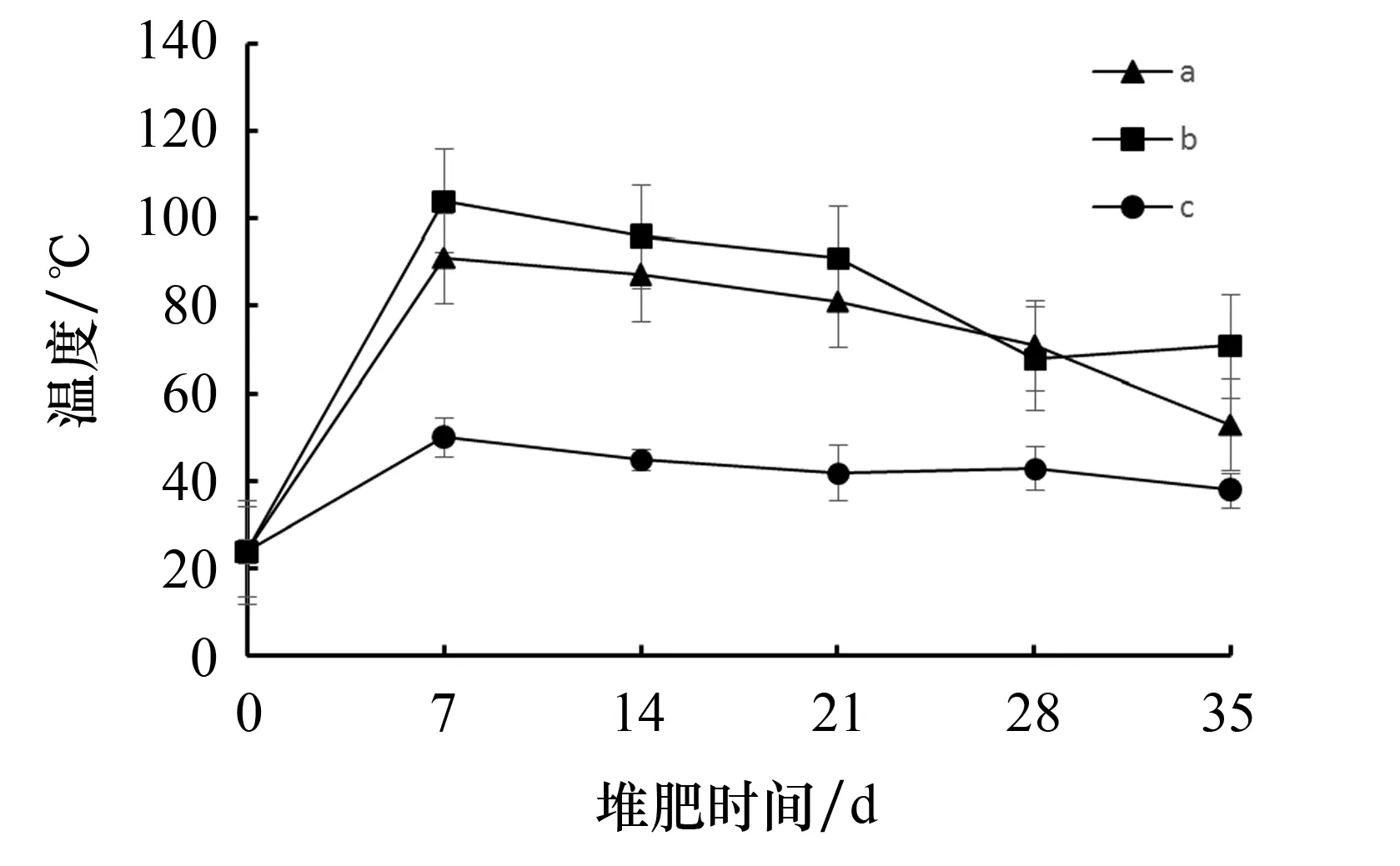
图2 堆肥过程中的温度变化情况
2.2 堆体的pH变化情况
图3为堆肥过程中pH的变化.由图3可以看出:在0~7 d,堆体的pH呈升高趋势.其原因是在此过程中微生物进行的是有氧呼吸,物料中的蛋白质、尿素、尿酸等高氮有机物能够快速降解,并产生大量铵态氮所致.在7~14 d,堆体的pH呈下降趋势.其原因是在该阶段嗜热微生物进行的是厌氧呼吸,由此产生了大量有机酸所致.在14~35 d,堆体的pH再次呈升高趋势.其原因是在该阶段嗜热微生物代谢的是蛋白质,进而使堆肥的氨氮的含量不断增加所致.在第35 d,各采样点的pH值均高于8.0.
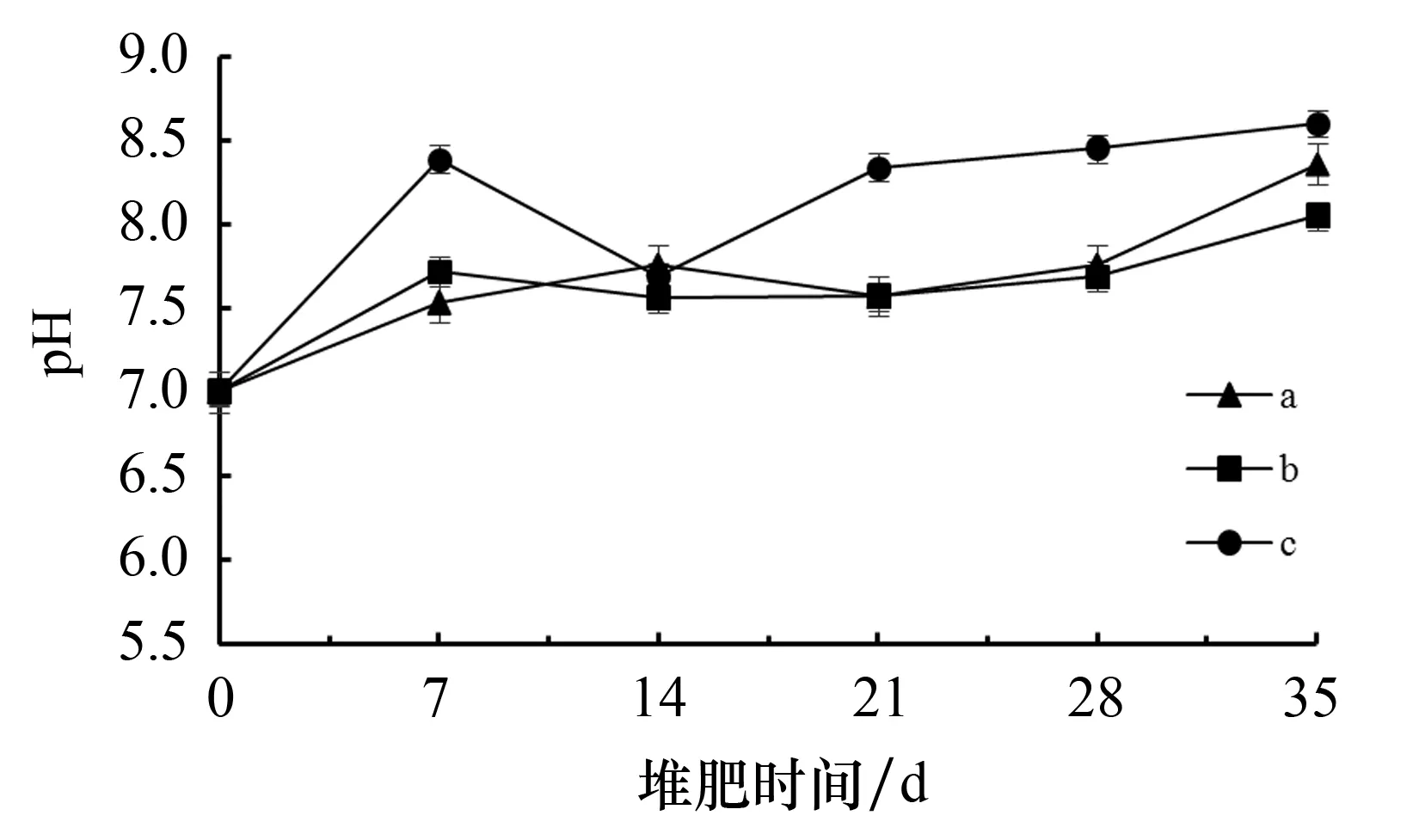
图3 堆肥过程中的pH变化情况
2.3 堆体含水率的变化情况
由于微生物只能利用水溶性有机物进行生长、代谢和繁殖,所以堆肥过程中需保持合适的含水率.由于含水率>65%时,含水率会影响堆料空隙中的空气扩散,进而易形成厌氧环境(不利于堆肥发酵),因此本试验用活性白土将堆体的含水率调整至60%.由图4可以看出:在堆肥的整个过程中堆体的含水率总体呈逐渐下降趋势,其中堆肥在7~14 d时堆体的含水率下降得最快,其主要原因是微生物在堆肥过程中产生了大量热量,进而加速了水分的蒸发所致.而在21~35 d时含水率下降得相对较为缓慢,其原因是温度逐渐降低,水分蒸发变得缓慢.另外,3个采样点的含水率为b点>a点>c点.
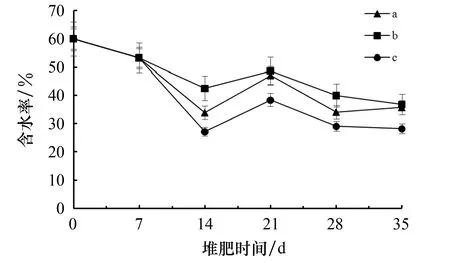
图4 堆肥过程中的含水率变化情况
2.4 堆体C/N的变化情况
C/N变化通常用于衡量堆肥腐熟度.堆肥腐熟时堆体的C/N值趋向于微生物菌体的C/N值(12左右).由图5可以看出:堆体的C/N值随堆肥时间呈逐渐下降趋势,其中在0~7 d时下降得最快,且此时温度和含水率均较高.当堆肥时间为第35 d时C/N值达到12左右,由此可认定堆肥发酵基本完成.
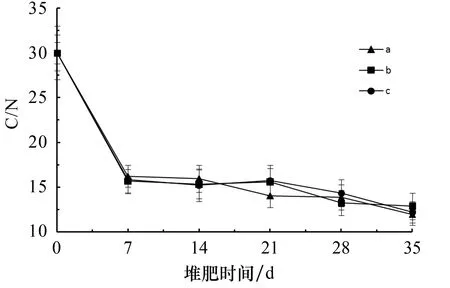
图5 堆肥过程中的C/N值变化情况
2.5 条带序列的DGGE谱图分析
微生物总DNA的DGGE图谱如图6所示.图中,条带的数量越多表示样品中微生物的种类越丰富,条带越亮表示种类数量越多.从图6可以看出:在整个堆肥过程中,条带k、o、p、q为共有的优势菌群,表明这些菌群可能对堆肥起关键作用;条带f、h、k、l、m的亮度随着堆肥进程的推进而明显增加,说明这几种菌种的含量随堆肥时间而逐渐提高;条带a、b、c、e出现在28~35 d,说明这些菌种不适应前期的超高温环境,而适应堆肥后期的堆体环境.另外,不同采样点的菌群组成和数量也存在差异.在采样点a和c, 条带q在发酵前期含有的微生物数量较多,但在末期含有的微生物数量降低;在采样点b, 在 7~14 d范围内无条带q产生.
将图6中的不同条带切割后回收并对其DNA进行测序.测序后的分析结果见表1.由表1可知,堆肥过程中共检测出6个细菌门、8个纲(或者目)、17种不同种属的细菌,其中在条带h、m、 o、 p和q上检测出的细菌与未培养堆肥细菌属(Uncultured compost bacterium)、嗜热盐菌属(Rhodothermussp.)、 热杆菌属(Thermaerobactercomposti)、嗜热栖热菌属(Thermusthermophilus)和嗜热球形杆菌(Sphaerobacterthermophilus)的相似性达到100%,其余条带a、b、c、d、e、f、g、i、j、k、l、n分别与鞘脂杆菌(Sphingobacteriaceaebacterium)、类芽胞杆菌(Paenibacillussp.)、高温放线菌(Thermoactinomycetaceaebacterium)、Alviniconchahesslerigillendosymbiont、鸟氨酸芽孢杆菌(Ornithinibacillussp.)、土芽孢杆菌(Geobacillussp.)、酸微菌(Acidimicrobiaceaebacterium)、Planifilumfimeticola、Planifilumyunnanense、马氏酵母菌株(Rhodothermusmarinusstrain)和未培养的堆肥细菌(Uncultured compost bacterium)检测出的微生物相似性均达90%以上.由以上可以看出,高温堆肥过程中微生物呈多样性,且有明显的差异动态演替性.本文检测出的上述微生物与文献[14-15]中检测到的微生物相类似,由此进一步表明上述种类的微生物对极端环境具有较强的耐受性.
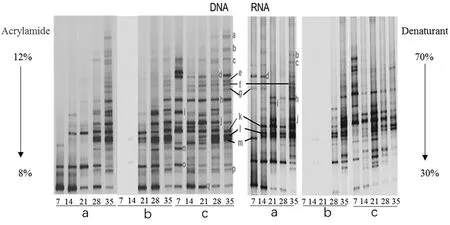
图6 堆肥过程中微生物总DNA的DGGE图谱
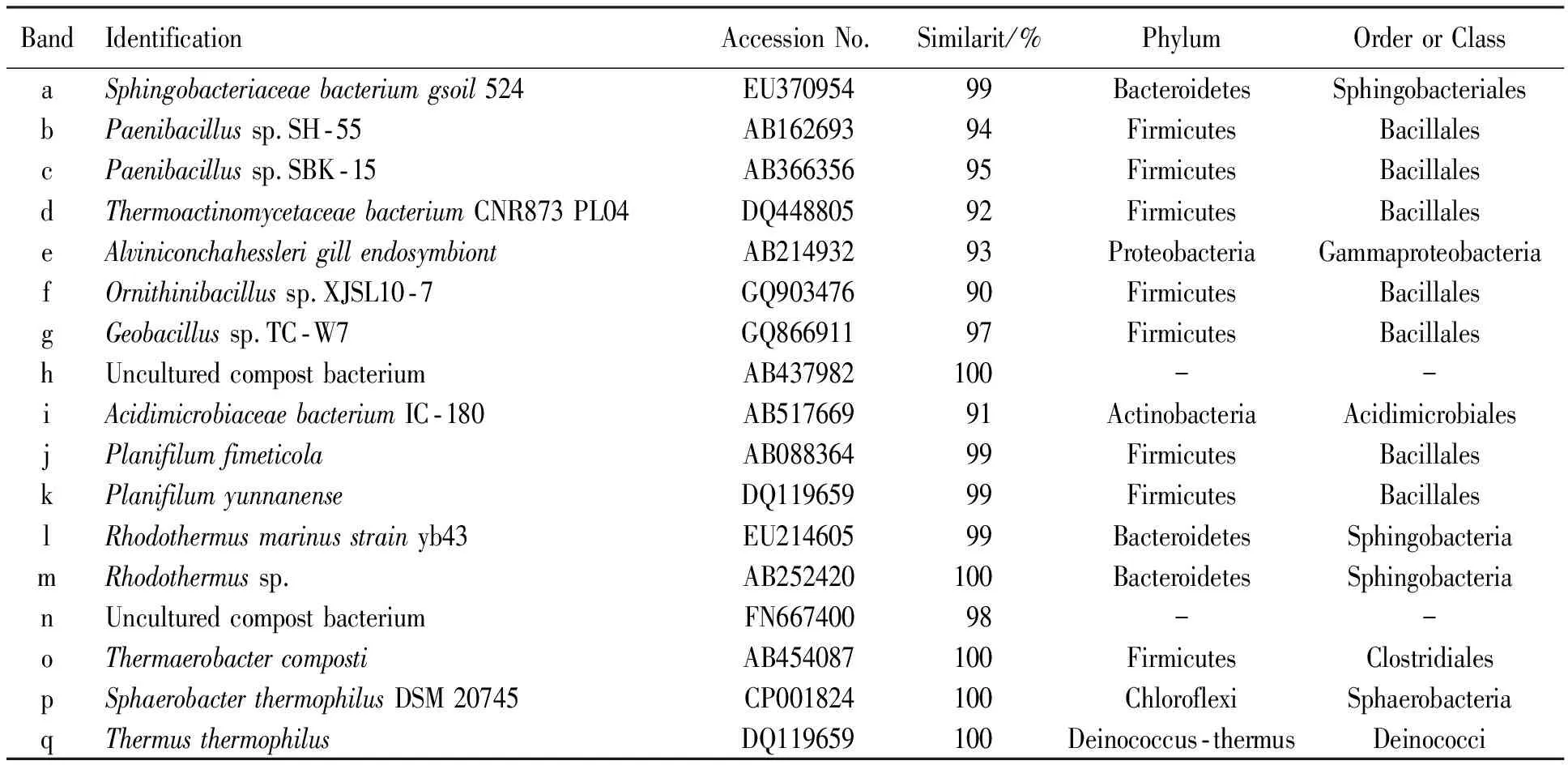
表1 DGGE条带细菌16S rDNA部分基因序列比对分析
3 结论
对超高温堆肥过程中的微生物类群变化和堆体的理化性质(含水率、pH、温度、C/N)进行研究显示:堆肥在35 d完成,堆肥过程中微生物呈多样性,且不同微生物的相对含量有所差异;在堆肥过程中共测出6个细菌门(其中Firmicutes菌门为主要优势菌门)和17种不同种属的细菌(其中嗜热菌为主要优势菌属).堆体的理化性质随微生物的类群变化而变化,其中除pH外其他指标均随堆肥时间呈下降趋势.本研究结果可为超高温堆肥畜禽粪便发酵菌种的筛选和功能菌剂的制备提供理论基础.在今后的研究中,我们将对超高温堆肥过程中出现的嗜热菌种进行筛选和纯化,以制备出更为优良的超高温堆肥复合工程菌剂.

