养殖密度对厚颌鲂幼鱼生长、饲料利用及肠道抗氧化应激性能的影响*
王 尧 陈晨光 张洁若 高煜杰
(海南大学海洋学院 海南 海口 570228)
厚颌鲂(Megalobrama pellegrini)俗称乌鳊,属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲌亚科(Culterinae)、鲂属(Megalobrama),主要分布在长江上游干流及乌江、岷江、赤水河、沱江、嘉陵江等支流的中下游,是我国长江上游地区具有较高经济价值的鱼类之一(李文静等, 2007)。然而,由于栖息地的破坏以及过度捕捞等人为因素的影响,导致其种群数量急剧减少,现属于三级保护物种(刘军, 2004)。目前,虽已能够进行厚颌鲂的人工繁育,但其相关研究工作开展较晚,缺乏对其养殖模式的探究,因此,也限制了其种质资源的有效恢复以及此优良品种的快速发展。
集约化养殖已逐步成为我国渔业生产的主要方式,极大促进了我国水产养殖业的快速发展。而其中养殖密度是集约化养殖生产过程中最基本的生产管理要素,增加养殖密度也是提高单位水体产量的常用方法。然而,养殖密度过高,将对鱼类生长产生负面影响,同时造成水体环境恶化,从而增大养殖风险(张晓等, 2020)。在多数常见鱼类研究中如大菱鲆(Scophthalmusmaximus)(乔 玮 等 , 2014)、 施 氏 鲟(Acipenser schrenckii) (任源远等, 2014)、团头鲂(Megalobrama amblycephala) (亓成龙,2016)、瓦氏黄颡鱼(Pelteobagrusvachelli) (姚清华等, 2018)和罗非鱼(Oreochromisniloticus) (肖炜等, 2019)均发现养殖密度过高会抑制鱼体的正常生长。此外,养殖密度引起的生理压力会导致鱼体产生氧化应激,加快活性氧(ROS)的产生,并对动物体内细胞结构产生损伤,从而危害鱼体健康。同时,也会消耗参与组成抗氧化系统的某些维生素和矿物元素,导致必需营养元素的缺乏(Costas et al, 2013)。而机体内由超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽酶系(GR、GSH-Px、GST)组成的抗氧化体系能够清除体内多余自由基,从而保证机体健康。而非酶系统中热休克蛋白(HSP)及谷胱甘肽(GSH)等小分子物质,可保护蛋白质等分子物质免受自由基诱导的损害(Limon-Pacheco et al, 2009)。研究显示,养殖密度过高时鱼体内抗氧化酶活性(SOD, GSH-Px)减弱,抗氧化能力降低,而脂质过氧化产物(丙二醛)和应激反应代谢产物(葡萄糖、乳酸和皮质醇)升高(张龙等, 2019)。但对于有些鱼类而言,养殖密度过低不利于其集群行为的发生,因而也会影响鱼体生长,且较低的养殖密度也限制了资源的有效利用,减少养殖收益(Millancubilloet al,2016)。由此可见,适宜的养殖密度对养殖鱼类生长和健康至关重要。
因此,本文以厚颌鲂幼鱼为研究对象,探究养殖密度对其生长性能、鱼体组成和抗应激性能的影响,以期为提高厚颌鲂幼鱼苗种培育效率、恢复其种质资源提供科学依据。
1 材料与方法
1.1 实验材料与实验设计
实验用厚颌鲂幼鱼由金沙江珍稀特有鱼类增殖放流站孵育,挑选健康活泼、规格相近的个体1620尾,初始平均体重为(0.45±0.01) g,体长为(3.10±0.02) cm,分别置于15个玻璃纤维缸(直径为50 cm,高度为75 cm)中。实验共设计5个密度梯度组,分别为0.15 kg/m3(50尾/桶)、0.24 kg/m3(80尾/桶)、0.34 kg/m3(110尾/桶)、0.42 kg/m3(140尾/桶)和 0.50 kg/m3(170尾/桶),每个处理组设置3个平行,开展为期42 d的养殖实验。实验期间每天投喂鱼体体重为5%的商品饲料(四川通威,粗蛋白为33%,粗脂肪为4%),分别于09:00和16:30进行投喂。采用流水养殖,水温为(26.0±0.5)℃,溶解氧(DO)为(6.02±0.20) mg/L。
1.2 样品采集
42 d养殖实验结束后,所有实验鱼饥饿24 h,统计每个养殖缸中鱼体终末体重、尾数及投喂饲料总量,并依据以下公式计算相关指标:
增重率(WG, %)=100×(Wt-W1)/ W1;
特定生长率(SGR, %/d)=100×(lnW2-lnW1)/(t2-t1);
饲料系数(FCR)=F/[n(W2-W1)];
成活率(SR, %)=终末尾数/初始尾数×100%。
式中,n为尾数,F为总投饵量(g),W1、W2为初始时间(t1)和实验结束(t2)时鱼体体重(g)。
每个实验缸随机选取 11尾鱼,用 MS-222将其麻醉,从中选取5尾鱼用于全鱼组分分析;取6尾鱼解剖得到肠道样品,立即置于液氮中用于后续酶活分析和RNA提取。
1.3 体成分分析
水分含量:将全鱼样品放置在105℃烘箱中并按照减重法进行水分测定及计算(GB/T9695.15-2008);粗蛋白含量:利用杜马斯燃烧法快速定氮仪(Elementar,德国)(AOAC, 2005)进行测定;粗脂肪含量:利用脂肪抽提仪(海能SOX406, 中国)有机溶剂抽提法(石油醚,沸程为60℃~90℃)进行粗脂肪测定(GB/T14772-2008)。
1.4 肠道氧化应激相关指标测定
肠道粗提液的制备:准确称取肠道样本并记录,与 0.1 mol/L磷酸盐缓冲液按照质量体积比1∶9混合,进行冰浴匀浆,4℃ 12,000 r/min 离心 15 min,收集上清液转到新的离心管,置于-80℃冰箱保存待测。总蛋白含量测定利用BCA微板法;超氧化物歧化酶(SOD)活性利用WST-8法测定;总抗氧化能力(T-AOC)利用ABTS法;丙二醛(MDA)含量利用硫代巴比妥酸法测定;还原性谷胱甘肽(GSH)含量利用DTNB微板法测定。其中,过氧化氢酶(CAT)活性和MDA含量测定采用碧云天试剂盒(上海碧云天生物技术有限公司),其他3种酶的测定均采用南京建成试剂盒(南京建成生物工程研究所)。
1.5 肠道氧化应激相关基因表达分析
利用Trizol试剂法(Invitrogen, 美国)提取厚颌鲂肠道总 RNA,用1.0%琼脂糖凝胶电泳检验 RNA完整性,参照反转录试剂盒(PrimeScript RT Master Mix,TaKaRa)说明书,将RNA反转录为cDNA。在荧光定量 PCR 仪(QuantStudio 6 Flex, Applied Biosystems, 新加坡)上进行实时荧光定量PCR (qPCR)测定,该实验反应总体系为10 μL,包括5 μL TB Green Premix ExTaq(TaKaRa,大连),各 0.2 μL 正反引物(10 μmol/L),4.1 μL无核酶DEPC水和0.5 μL cDNA。qPCR反应程序如下:95℃,10 min;95℃,15 s,56℃,60 s,40个循环;70℃,20 s。引物序列根据NCBI上鱼类相关目的基因序列用Premier 5.0设计,验证正确后使用,详见表 1。在每个 PCR反应最后,扩增产物的溶解曲线表明这些反应均是单一产物。标准曲线采用8个不同稀释浓度(每个3个平行),扩增效率根据E=10(-1/slope)-1计算。目的基因表达水平由2-ΔΔCt法计算。

表1 实时荧光定量基因表达引物序列Tab. 1 Primers used for real-time quantitative RT-PCR (qPCR)
1.6 数据统计分析
数据用平均值±标准误(Mean±SE)表示,采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA)和Tukey’s多重检验,P<0.05为差异显著。
2 实验结果
2.1 养殖密度对厚颌鲂幼鱼生长、饲料利用及成活率的影响
如表 2所示,厚颌鲂幼鱼生长(末平均体重、增重率和特定生长率)随着养殖密度的逐渐增大呈先上升后下降的趋势。鱼类增重率和特定生长率在密度为0.34 kg/m3时最高,显著高于最高密度处理组(0.5 kg/m3)(P<0.05),但与其他密度处理组间无显著差异(P>0.05)。饲料系数在0.5 kg/m3密度处理组时最高,显著高于 0.15、0.24和 0.34 kg/m3密度处理组(P<0.05),其他各组间饲料系数差异不显著(P>0.05)。提高养殖密度并没有造成养殖鱼成活率降低,实验各组存活率均较高,差异不显著(P>0.05)。

表2 养殖密度对厚颌鲂幼鱼生长及饲料利用的影响Tab. 2 Effects of stocking density on growth and feed utilization of juvenile M. pellegrini
2.2 全鱼体成分指标
厚颌鲂幼鱼体组成受到养殖密度的显著影响(表 3)。随着养殖密度的逐渐升高,鱼体体组成呈现出先上升而后下降的趋势。当养殖密度为0.34 kg/m3时,厚颌鲂幼鱼全鱼粗蛋白和粗脂肪含量显著高于其他各实验组(P<0.05),而最高密度处理组(0.5 kg/m3)全鱼粗蛋白和粗脂肪含量显著低于其他各实验组(P<0.05)。

表3 养殖密度对厚颌鲂幼鱼全鱼体成分的影响Tab. 3 Effects of stocking density on whole-body composition of juvenile M. pellegrini
2.3 肠道抗氧化酶活性相关指标
如表4所示,厚颌鲂幼鱼肠道抗氧化酶相关指标受到养殖密度的显著影响。其中,低密度组(0.15 kg/m3)和高密度组(0.42和0.50 kg/m3)鱼体肠道总抗氧化能力显著低于0.24和0.34 kg/m3密度处理组(P<0.05)。肠道SOD和CAT活性随养殖密度增大呈显著降低的趋势,养殖密度为0.50 kg/m3时,肠道SOD和CAT活性最低,且显著低于其他各处理组(P<0.05)。GSH含量随着养殖密度增大呈先上升后下降的趋势,最高值出现在0.34 kg/m3处理组,且显著高于其他各实验组(P<0.05)。最高养殖密度组(0.50 kg/m3)肠道MDA含量显著高于其他各处理组(P<0.05),而0.24 kg/m3密度组鱼体肠道MDA含量最低,并显著低于其他各处理组(P<0.05)。

表4 养殖密度对厚颌鲂幼鱼肠道抗氧化酶活性的影响Tab. 4 Effects of stroking density on intestinal antioxidant enzymes activities of juvenile M. pellegrini
2.4 肠道氧化应激相关基因表达
如图1所示,厚颌鲂幼鱼肠道Hsp90基因表达在各密度处理组间无显著差异(P>0.05)。CYP1A基因表达随养殖密度增大有升高趋势,其中,最低密度实验组(0.15 kg/m3)厚颌鲂幼鱼肠道CYP1A基因表达最低,且与0.42 kg/m3实验组间有显著性差异(P<0.05),其他各处理组间无显著性差异(P>0.05)。最高养殖密度组(0.50 kg/m3)鱼体肠道Nrf2基因表达水平最高,显著高于0.15和0.34 kg/m3密度处理组;而鱼体肠道MnSOD基因表达在最高养殖密度组(0.50 kg/m3)显著低于适中养殖密度组(0.34 kg/m3)。
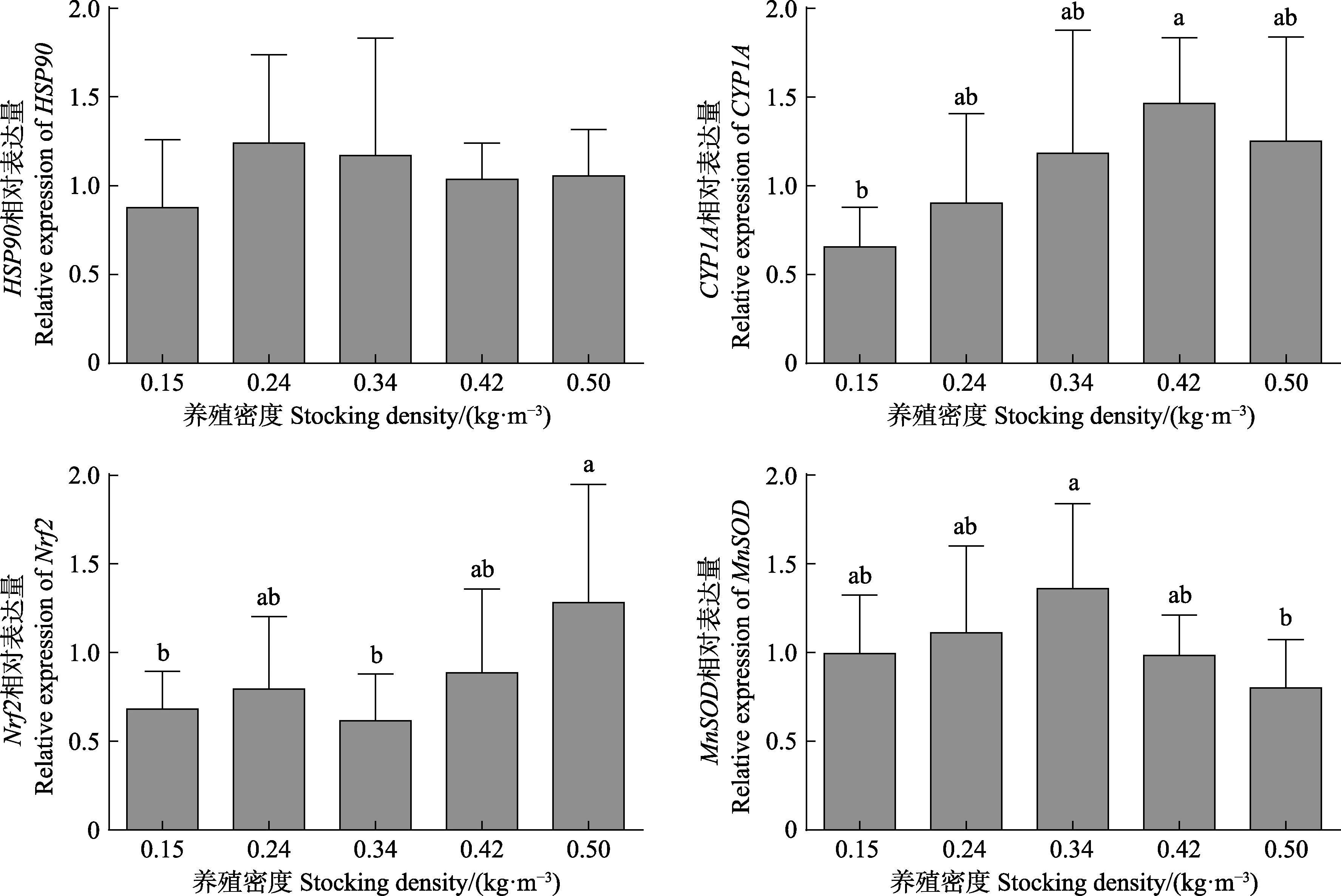
图1 养殖密度对厚颌鲂幼鱼肠道氧化应激相关基因表达的影响Fig.1 Effects of stocking density on intestinal oxidative stress related genes expressions of juvenile M. pellegrini
3 讨论
适宜的养殖密度对鱼类早期生长及存活起到至关重要的作用,同时,也是提高水产养殖生产收益的重要方式。结果显示,过高的养殖密度(0.50 kg/m3)会显著抑制厚颌鲂幼鱼生长,而适宜养殖密度(0.34 kg/m3)条件下鱼体增重率达到最大值。同样,在大口黑鲈(Micropterus salmoides)(倪金金等, 2020)、罗非鱼(左腾等, 2019)、塞内加尔舌鳎(Solea senegalensis)(Andradeet al, 2015)及斑点叉尾(Ictalurus punctatus)(Refaeyet al, 2018)等鱼类的研究中均发现,养殖密度过高时会显著抑制鱼体生长。刘群等(2014)认为,高密度养殖条件对鱼体造成的应激效益会提高其对能量的消耗以及分配利用,从而干扰鱼类正常生理状态,进而对生长产生不利影响。然而,在石首鱼(Argyrosomus japonicus)中的研究发现,提高养殖密度能够促进鱼体生长,低密度情况下反而会抑制鱼体生长(Pirozziet al,2009; Millancubilloet al, 2016)。同样,银鲳(Pampusargenteus)幼鱼在低密度养殖条件下生长显著低于中密度组,表明群居习性鱼类在过低养殖密度时不利于其生长(倪嘉豪等, 2020)。以上研究表明,养殖密度对鱼体生长的影响与种类、生长阶段、实验设计以及养殖条件密切相关。因此,有必要研究和确定养殖对象的最适养殖密度,从而为提高养殖效率提供依据。
养殖密度较高时会增加鱼体间摄食时的竞争及游动速度,导致能量消耗增加或者影响部分鱼体的摄食过程,最终影响鱼体生长(Calabrese et al, 2017)。本研究结果也显示,当养殖密度过高时(0.50 kg/m3)厚颌鲂幼鱼饲料系数显著升高。在杂交鳢(Channa maculata × C. argus)(吴晓清等, 2017)、施氏鲟(Li et al,2012)等鱼类的研究中也呈现出类似实验结果。同时,还发现随着养殖密度升高,摄食率和蛋白质效率降低,表明过高的养殖密度降低了鱼体对饲料的利用效率,继而影响其生长。但在罗非鱼(左腾等, 2019)、团头鲂(Qi et al, 2016)等鱼类中的研究显示,养殖密度对鱼体饲料系数无显著影响。本实验结束时,所有实验组鱼体成活率均较高,未受到高密度的影响。Iguchi等(2003)认为,在适宜养殖密度范围内,鱼体成活率受到养殖密度的影响较小,但超过一定阈值后,成活率也会随着密度的升高而降低,这也是大多数实验中鱼体成活率并未受到养殖密度显著影响的主要原因。而Aksungur等(2007)研究显示,养殖密度过高时底栖鱼类大菱鲆成活率显著降低。因此,养殖密度对鱼类成活率的影响也与其生活习性密切相关。
鱼类在养殖过程中不断摄取营养物质,通过消化、吸收和转化等过程,将一部分营养物质用于能量代谢而维持生命活动,其他部分则以蛋白质、脂肪等形式储存,用于生长与繁殖。鱼体蛋白质和脂肪水平能够直接反映鱼类营养价值。而除饲料组成之外,养殖环境和养殖方式等均会对鱼体成分造成显著影响(Toko et al, 2007)。本研究结果显示,最高密度养殖条件下鱼体水分含量、粗蛋白和粗脂肪含量相较于最低密度组显著降低,在斑点叉尾研究中也发现类似结果(Omar, 1996)。Ren 等(2017)研究发现,高密度养殖会引起脂蛋白脂肪酶和脂肪酶mRNA表达量降低,过氧化物酶体增殖物激活受体α mRNA表达量升高,从而导致高密度组肌肉脂肪含量较低。由此可见,在高密度养殖条件下鱼体脂肪代谢受到影响。针对杂交鲟幼鱼的研究也显示,鱼体粗蛋白、粗脂肪含量随养殖密度增大而降低,养殖60 d时,高密度组鱼体粗蛋白含量显著较低,而粗脂肪含量无显著差异(步艳等, 2014)。亓成龙等(2016)研究显示,团头鲂幼鱼鱼体粗脂肪含量则随着养殖密度升高而显著降低,而粗蛋白含量在不同的养殖密度组之前不存在显著性的差异。但在施氏鲟(任源远等, 2014)和瓦氏黄颡鱼(姚清华等, 2018)的研究中,高密度条件下鱼体肌肉粗脂肪含量显著低于低密度组。
鱼类进行正常生命活动时,细胞代谢不断产生氧自由基。但当机体受到外界环境刺激时,体内产生过多自由基如不能及时清除,则会对细胞分子甚至机体产生危害。大量研究表明,不适宜的养殖密度会导致鱼体产生应激反应,从而产生过量氧自由基(ROS)。SOD和CAT是动物体酶类抗氧化系统的重要组成部分,能够清除体内多余自由基,保护自身免受氧化损伤(Barton, 2002)。本研究结果显示,厚颌鲂幼鱼肠道SOD活性和CAT活性随养殖密度的增大呈显著下降趋势。同样,在斜带石斑鱼(Epinepheluscoioides)(郑乐云等, 2013)和大菱鲆(Liu et al, 2016)研究中也发现,血清SOD活性和肝脏SOD、CAT活性随着养殖密度升高而显著下降。此外,养殖密度过高时,厚颌鲂幼鱼肠道脂质过氧化终产物MDA含量显著增加,表明厚颌鲂幼鱼与其他大多数鱼类一样,养殖密度过高时,氧化应激水平会增加。而在鲫鱼(Carassius cuvieri)中的研究同样发现,高密度情况下不仅血清MDA含量显著升高,碱性磷酸酶和溶菌酶等免疫指标也显著降低(吴宗凡等, 2014)。然而,在石首鱼中研究发现,低密度实验条件下鱼体更易处于应激状态,与高密度组相比具有更高的血清皮质醇和葡萄糖水平(Pirozzi et al, 2009)。由此可见,不同鱼类对养殖密度的耐受存在较大差异,且由应激引起的生理变化也各不相同。
细胞色素P450 (CYP450)是生物体内含有多种超家族CYP450血红蛋白或相同结构域的酶系,作为生物标志物已广泛应用于鱼类环境毒理学研究,其基因或蛋白水平变化能够反映鱼体生理压力和免疫反应(李春杰等, 2014)。当机体受到应激原刺激时,细胞受到损害从而导致变性蛋白数量增加、肽链空间结构改变、蛋白功能丧失。而热休克蛋白(Heat shock proteins,HSPs)是生物体在外界环境应激刺激下诱导生成的一组蛋白质,其中,HSP90可以促进肽链重新折叠,修复变性蛋白,提高细胞对逆境的耐受性(默立宾等,2018)。本研究表明,在最高养殖密度(0.42 kg/m3)条件下厚颌鲂幼鱼肠道CYP1A基因表达水平显著高于最低密度组(0.15 kg/m3)。Liu等(2016)在大菱鲆中的研究显示,较长养殖周期时高密度才会对鱼体产生氧化应激,肝脏CYP1A和HSP70基因表达水平显著上调,而 HSP90基因表达不受影响。本研究与塞内加尔鳎鱼等鱼类中的研究一致,发现养殖密度对HSP90基因表达影响不显著。由此可见,位于内质网和线粒体的CYP1A更易受到密度胁迫的影响,而HSP对密度胁迫的响应则与鱼体种类、基因家族类型密切相关,且敏感性可能低于热应激等胁迫因子。
Nrf2是一种重要的氧化应激敏感性转录因子。动物体在正常生理状态下,Nrf2通过泛素化标记途径降解,当受到氧化应激后,Nrf2游离出来并与抗氧化反应元件结合,促进抗氧化基因的表达,从转录水平调控体内的氧化应激反应。本研究结果显示,最高养殖密度(0.50 kg/m3)条件下,厚颌鲂幼鱼肠道Nrf2基因表达水平显著高于最低(0.15 kg/m3)和适中(0.34 kg/m3)养殖密度组,表明高密度环境让鱼体处于应激状态从而激活了Nrf2信号分子。而Sahin等(2014)在虹鳟(Oncorhynchusmykiss)中的研究也发现,高密度养殖条件下 Nrf2被激活由细胞质易位至细胞核从而导致其蛋白表达水平降低,而抗氧化剂番茄红素使高密度养殖条件下鱼体Nrf2蛋白表达处于较高水平。
锰超氧化物歧化酶(MnSOD)是一种含金属辅基的抗氧化酶,能将氧自由基快速歧化为分子氧(O2)和过氧化氢(H2O2)。虽未有养殖密度对MnSOD基因表达影响的相关报道,但发现其他环境胁迫因子如pH、温度、重金属和氨氮等会调控其 mRNA表达水平,从而参与机体氧化应激反应。本研究发现,最高养殖密度(0.50 kg/m3)处理组厚颌鲂幼鱼MnSOD基因表达水平显著低于适中密度处理组(0.34 kg/m3),表明长期高密度养殖条件下鱼体内氧化应激平衡状态受到影响,从而抑制了抗氧化应激相关基因MnSOD的有效表达,导致鱼体长时间处于应激状态,生长也受到显著影响。同样,Hoseini等(2020)在虹鳟中的研究中也发现,养殖密度过高时会引起鱼体肠道的氧化应激反应。Refaey等(2018)在斑点叉尾的研究中还发现,养殖密度过高时会损伤鱼体肠道结构,如肠道肌层变厚、杯状细胞数量变少、体积变小以及肠道绒毛变短等;Wang等(2020)在大口黑鲈研究中同样发现,高密度组鱼体肠道杯状细胞数量变少、体积变小,肠道肌层变厚但肠道绒毛无显著变化。而Sundh等(2019)研究显示,高密度处理组大西洋鲑肠道屏障功能受到显著影响。由此可见,在高密度养殖条件下肠道结构和功能均受到显著影响,而未来对于养殖密度的研究也应更加关注鱼体的肠道发育状况和健康状态。
4 结论
本研究表明,厚颌鲂幼鱼在体重为0.45~1.36 g阶段时,0.34 kg/m3的养殖密度能让其获得最大生长。当养殖密度达到 0.5 kg/m3时,鱼体不仅饲料利用率下降,生长受到抑制,而且受到氧化应激,表现在肠道氧化应激相关酶活性及基因表达受到显著影响。因此,适宜的养殖密度对于提高厚颌鲂幼鱼苗种培育效率,保证其健康生长至关重要。

