耳石锶标记识别放流群体的可行性研究*
王 硕 张博伦 郭 彪 ① 姜 涛 陈 卫 杨 健 高 燕 曾祥茜
(1. 天津市水产研究所 天津 300457;2. 天津市海洋牧场技术工程中心 天津 300457;3. 中国水产科学研究院淡水渔业研究中心 江苏 无锡 214081)
鱼类在生长发育过程中,水体中的CaCO3在耳石上沉积的同时,其他微量元素也被沉积在耳石中,由于它的非细胞性和代谢惰性,一般不会发生分解或重吸收,这种元素的信息可以一直保存下来,成为记录鱼类生活史的元素指纹(elemental fingerprints)(李秀启等, 2017)。目前,在鱼类耳石中已检测出的元素种类有50多种(熊瑛等, 2015),且主要来源于鱼类生活的水环境和食物(郭弘艺等, 2015; 熊瑛等, 2015)。水环境或食物的元素通过吸收进入血液,再由血液进入内耳淋巴液;最终通过结晶作用将元素沉积在耳石中(Sturrock et al, 2012)。但由于各种元素的性质不同,耳石对不同环境元素的响应有所差别(郭弘艺等, 2015;熊瑛等, 2015)。锶(Sr2+)作为一种硬酸元素,水体环境中和耳石中Sr2+的浓度具有显著的正相关性(Walther et al, 2006)。因此,耳石Sr/Ca比分析一直以来被作为鱼类生境重建和种群鉴定的重要技术手段(王玉堃等,2016; 李孟孟等, 2017a),并逐步在增殖放流效果评估中得以研究应用(李秀启等, 2017; 司飞等, 2019a)。
目前,增殖放流鱼类标记方法中,挂牌标记和被动整合式雷达标要求鱼苗体长较大且适合小规模标记(Waldman et al, 1990; Navarro et al, 2007; 周辉霞等, 2017),而分子标记需要清晰的亲本遗传信息(童爱萍等, 2015)。但目前国内鱼类增殖放流的现状是放流的苗种以小规格苗种为主,放流数量较大、放流企业较多且存在鱼苗遗传背景信息不清的情况。而耳石Sr2+标记具有成本低、标记方法简便易操作、对苗种无损伤、一旦标记不受外界影响, 可以对小规格苗种进行大规模标记等优点,是鱼类标记放流技术研究的一个新热点问题(司飞等, 2019a)。
与淡水及河口鱼类耳石Sr/Ca比和生境中的Sr/Ca比直接相关不同,海水中的Sr/Ca比不是影响海水鱼类耳石Sr/Ca比的主要因素(Brown et al,2009),海水鱼类耳石Sr/Ca比可能受到海水环境中的Sr和Ca的相对浓度、鱼类种类特性、水温、盐度和鱼类生理状态的影响(熊瑛等, 2015)。因此,海水中的Sr2+浓度对海水鱼类耳石Sr/Ca比的影响,需分种类加以区别研究。(Liza haematocheila)作为我国增殖放流的重要品种(杨文波等, 2009)和天津市鱼类增殖放流量最大(7347.302万尾)的一个品种,全面、科学地评估其增殖放流效果,是保证放流工作有效开展的基础(罗刚等, 2015)。放流个体标记回捕法作为目前海洋渔业生物增殖放流效果评估的主要方法(刘璐等, 2014),研究大规模标记小规格苗种的方法是十分有必要的。本研究拟比较不同浓度Sr2+浸泡下,的耳石标记效果,并尝试对的耳石进行双环标记,以探讨耳石Sr2+标记的可行性和不同放流群体识别的可能性,为大规模耳石Sr2+标记放流提供基础数据和技术支撑。
1 材料与方法
1.1 实验用鱼的来源及暂养
实验用鱼为河北省黄骅市宏润水产养殖有限公司繁育的体长为3 cm左右的幼鱼。3000尾幼鱼运回后,暂养于天津兴盛海淡水养殖有限责任公司养殖车间的2个养殖池中,养殖池规格为6.0 m×6.0 m×1.3 m,每个养殖池盛水约为30 m3。暂养期间,每天投喂配合饲料2~3次,日换水量为30%,每周倒池1次。暂养海水为自然海水,盐度为21~23、水温为21℃~22℃、pH为7.83~8.03。
1.2 实验方法
通过向海水中添加SrCl2·6H2O将海水中Sr2+质量浓度分别提升至50、100、200和400 mg/L,其中Sr2+质量浓度为400 mg/L的海水Sr2+浓度处于过饱和状态,海水呈乳白色。
将Sr2+质量浓度为50、100、200和400 mg/L的海水分别注入50 L的实验水族箱中,作为不同Sr2+质量浓度标记组,分别以L5M50、L5M100、L5M200和 L5M400表示;同时,将无添加 SrCl2·6H2O的自然海水单独注入1个50 L的实验水族箱,作为对照组,用L5M0表示。
挑选体长为5 cm左右健康的幼鱼500条,均匀分配到4个标记组和一个对照组,开始实验。整个标记期间,不换水,每天正常投喂2~3次。标记48 h后,分别将每个处理组中全部幼鱼单独转移到一个网箱中进行后期饲养。网箱规格为 1.5 m×1.5 m×1.3 m。待幼鱼长至约10 cm左右时,每个处理组随机挑选5尾用于耳石微化学分析。后期饲养期间,养殖用水和养殖管理同暂养,每天观察幼鱼的死亡状况,并记录。
1.3 双环标记实验
实验开始前,海水中Sr2+质量浓度经电感耦合等离子质谱仪(ICP MS)测定,为7.9 mg/L。通过向海水中添加SrCl2·6H2O将海水中Sr2+质量浓度分别提升至 100和 200 mg/L。
将Sr2+质量浓度为200 mg/L的海水注入到2个50 L的实验水族箱中,并随机挑选体长为3 cm左右健康的幼鱼200尾,均分到2个实验水族箱中。幼鱼在Sr2+质量浓度为200 mg/L的海水中标记96 h后,将所有标记幼鱼转移到2个网箱中继续暂养。标记幼鱼的暂养网箱规格同1.2,网箱置于养殖池中,网箱为透水网衣,网箱中的海水可与养殖池的海水自由交换。标记幼鱼暂养条件同其他幼鱼暂养一致。暂养30 d后,标志幼鱼长至5 cm左右,开始第2次标记。将Sr2+质量浓度为100 mg/L的海水注入2个50 L的实验水族箱中,并随机从第1次标记的幼鱼中挑选体长为5 cm左右健康幼鱼100尾,移入其中一个实验水族箱中进行二次48 h标记;同时挑选体长为5 cm左右未进行标记的健康幼鱼100尾,移入另一个实验水族箱中标记48 h。将200 mg/L的海水标记、双环标记和100 mg/L的海水标记幼鱼分别单独转移到一个网箱中继续暂养。分别用SL3、DL3-5和SL5表示200 mg/L的海水标记、双环标记和100 mg/L的海水标记。整个标记期间,不换水,每天正常投喂2~3次。待幼鱼长至约为10 cm左右时,随机挑选5尾用于耳石微化学分析。
1.4 耳石检测方法
1.4.1 耳石摘取及前处理 利用剪刀、尖头镊等工具将一对矢耳石取出,剔除有机质,分别用去离子水、无水乙醇清洗,置于48孔盒中干燥备用。从一对矢耳石中随机选取一块用于前处理和微化学分析,前处理参照李孟孟等(2017b)的方法。先将耳石用Epofix环氧树脂进行固定包埋,38℃烘干12 h以上。然后,将包埋块用AB胶粘贴于干净的载玻片上,凝固2 h后,使用金刚石磨轮的碾磨机(Discoplan-TS型,Struers公司, 丹麦)切割碾磨。粗磨阶段用500目金刚砂轮碾磨至耳石微露,接着用1200目砂纸精磨至耳石核心暴露,然后用磨抛机(Labo Pol-35, 丹麦Struers公司)装备织布机抛光盘配合抛光液抛光,至耳石表面无明显划痕。最后,将样品放入Milli-Q水中超声清洗5 min后,自然条件下晾干24 h,完全干燥后,使用真空镀膜机(JEE-420, 日本电子株式会社)蒸镀碳膜(36A, 25 s)。
1.4.2 耳石的 EPMA 分析 耳石的电子探针显微分析(electron probe microanalysis, EPMA)参考司飞等(2019a)和杨健等(2010)的方法,利用X射线电子探针微区分析仪((JXA-8100型EPMA,日本电子株式会社)从耳石核心沿耳石最长径至耳石边缘呈直线进行耳石Sr2+元素定量线分析。标准样品使用CaCO3和SrTiO3。定量线分析EPMA的参数设定:加速电压为15 kV,电子束电流为 2.0×10-8A;束斑直径为 3 μm,每点驻留时间为15 s;以间距10 μm连续进行打点测定。所有耳石线分析完后,用电子束在耳石矢状面表面扫描进行面分析。其 EPMA加速电压和电子束电流分别为 15 kV 和 5.0×10-7A,束斑直径为 3 μm,像素为 6 μm×6 μm,每点驻留时间为 30 ms。由于耳石中Sr含量远小于Ca含量,按照国际惯例将Sr/Ca比标准化,即统一用Sr含量/Ca含量×103表示。
1.5 数据处理
采用 Excel 2010和 SPSS 19.0软件对数据进行统计分析,采用单因素方差分析(one-way ANOVA)或χ2检验,P<0.05表示差异显著;利用Excel 2010和SigmaPlot 1.0软件作图。
2 结果与分析
对50、100、200和400 mg/L浸泡组和对照组Sr2+元素在耳石上沉积的面分布进行上机分析。4个标记浓度处理组均出现明显的“高Sr2+标记环”(图1)。

图1 不同Sr2+浓度处理后耳石Sr2+元素面分布结果Fig.1 Mapping analysis of Sr in the otoliths of L. haematocheila marked with Sr solutions of different concentrations
通过定量线分析可知,50、100、200和400 mg/L浸泡组的Sr/Ca比均在距核1100 μm附近出现增高阶段(图 2)。线性分析结果显示,Sr2+质量浓度为 50~400 mg/L,标记时长为 48 h,均被成功标记。
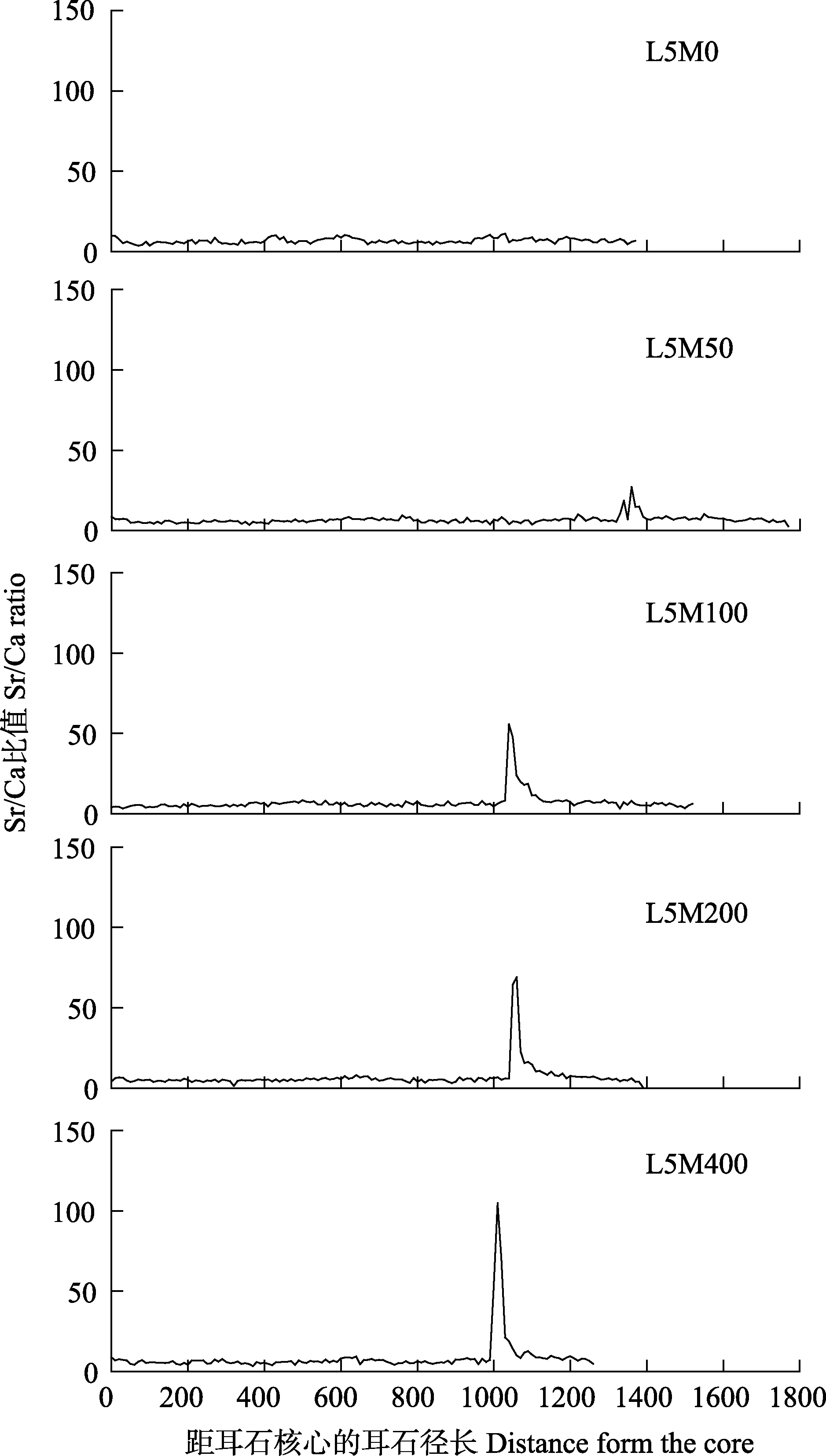
图2 不同处理组耳石样品定量线分析结果Fig.2 The line transect analysis in the marked otoliths of L. haematocheila in different treatments
表1 不同处理组耳石Sr/Ca比变化(平均值±标准误)Tab.1 Chang of Sr/Ca ratio in the marked otoliths of L. haematocheila in different treatments (Mean±SE)

表1 不同处理组耳石Sr/Ca比变化(平均值±标准误)Tab.1 Chang of Sr/Ca ratio in the marked otoliths of L. haematocheila in different treatments (Mean±SE)
注:Ⅰ为Sr/Ca比平稳阶段,Ⅱ为Sr/Ca比显著变化阶段,Ⅲ为Sr/Ca比极大值。同一列数值上不同字母表示差异显著(P<0.05)Note: Ⅰdenotes stationary stage, Ⅱ denotes stages of Sr/Ca ratio significantly changed in otoliths, Ⅲ denotes peak value of Sr/Ca ratio. Different letters in the same column indicate significant differences among different treatments (P<0.05)
组别Treatments Ⅰ阶段Sr/Ca比Sr/Ca ratio of stageⅠⅡ阶段Sr/Ca比Sr/Ca ratio of stageⅡⅢ阶段Sr/Ca比Sr/Ca ratio of stageⅢ标记环宽度Width of marking ring/μm Sr2+峰区均值 为正常均值的倍数Multiples of mean values of high Sr2+ area to average value of normal Sr2+峰值 为正常均值的倍数Multiples of peak value of Sr2+ to average value of normal L5M06.458 2±0.266 0 L5M506.330 2±0.156 8 18.029 1±1.415 5a 27.856 7±1.428 6a54.00±10.29a 2.86±0.25a 4.42±0.27a L5M1006.251 7±0.129 0 20.442 9±1.691 2a 45.420 2±4.000 2b78.00±4.90bc3.29±0.32a 7.32±0.77b L5M2006.191 6±0.293 7 34.137 1±3.791 3b 81.842 4±5.789 7c76.00±7.48ab5.49±0.45b 13.29±0.99c L5M4006.471 1±0.307 0 29.720 8±1.214 4b 109.663 6±5.848 9d100.00±4.08c4.65±0.39b 17.04±1.18d
2.3 双环标记耳石上Sr2+元素EPMA分析结果

图3 双环标记实验耳石Sr2+元素面分布Fig.3 Sr2+ concentrations of mapping analysis in the marked otoliths of L. haematocheila in double ring marking experiment
线性分析结果显示,Sr2+质量浓度为200 mg/L,标记时长为 96 h,体长为 3 cm 的的Sr/Ca比均在距核550 μm附近出现增高阶段。体长为5cm的在Sr2+质量浓度100 mg/L的海水中标记时长为48 h,Sr/Ca比均在距核1100 μm附近出现增高阶段(图4)。双环标记组2次峰值出现明显,彼此间几乎没有影响。

图 4 双环实验耳石样品定量线分析Fig.4 The line transect analysis in the marked otoliths of L. haematocheila in double ring marking experiment
表2 双环标记实验耳石Sr/Ca比变化(平均值±标准误)Tab.2 Change of Sr/Ca ratio in the marked otoliths of L. haematocheila in double ring marking experiment (Mean±SE)

表2 双环标记实验耳石Sr/Ca比变化(平均值±标准误)Tab.2 Change of Sr/Ca ratio in the marked otoliths of L. haematocheila in double ring marking experiment (Mean±SE)
注:Ⅰ为Sr/Ca比平稳阶段,Ⅱ为Sr/Ca比显著变化阶段,Ⅲ为Sr/Ca比极大值;同一行数值上不同字母表示差异显著(P<0.05)Note: Ⅰdenotes stationary stage, Ⅱ denotes stages of Sr/Ca ratio significantly changed in otoliths, Ⅲ denotes peak value of Sr/Ca ratio. Different letters in the same row indicate significant differences among different treatments (P<0.05)
SL3-5组别Treatments SL3第1次标记SL5 First marking 第2次标记Second marking Ⅰ阶段 Sr/Ca比 Ratio of stageⅠ6.511 5±0.201 16.274 1±0.119 66.274 1±0.119 66.251 7±0.129 0Ⅱ阶段 Sr/Ca比 Ratio of stageⅡ32.809 8±1.423 9a32.734 8±1.934 0a20.584 6±1.612 9b 20.442 9±1.691 2bⅢ阶段 Sr/Ca比 Ratio of stageⅢ97.027 8±3.514 7a96.949 7±3.180 8a45.340 2±3.735 8b 45.420 2±4.000 2b标记环宽度 Width of Marking ring/μm 225.50±13.77a217.50±16.52a 78.00±4.90b80.00±3.16b Sr2+峰区均值为正常均值的倍数Multiples of mean values of high Sr2+ area to average value of normal 14.97±0.84a 15.61±0.82a 7.27±0.71b7.32±0.77b Sr2+峰值为正常均值的倍数 Multiples of peak value of Sr2+ to average value of normal 32.81±1.42a 32.73±1.93a 20.58±1.61b20.44±1.69b
3 讨论
由于耳石是一种具有新陈代谢惰性的钙化结构(Campanaet al, 1985),沉积在耳石中的生境元素能永久性保存,其可很好地记录鱼类生境的变迁(Elsdonet al, 2008)。因此,耳石微化学分析一直以来均作为一种重要的技术手段,用于鱼类的生境重建和种群鉴定(王玉堃等, 2016; 李孟孟等, 2017a)。随着学者们对大规模小规格鱼类标记方法的探索,耳石Sr2+标记技术逐步由标记淡水鱼类(李秀启等, 2017)向标记海水鱼类(张辉等, 2015; 司飞等, 2019a)发展。本研究中,4个标记浓度处理组耳石Sr/Ca比均出现一个显著的上升阶段,耳石EPMA面分析也出现明显的“高Sr2+标记环”。这说明通过人为向海水中添加一定浓度Sr2+对耳石进行微化学标记是可行的。
鱼类的耳石随着鱼类的生长而不断生长(邓维德等, 2010),随着耳石的总重量不断增加,一些特定环境如Sr2+标记在耳石中沉积的特定元素相对含量逐渐下降(Yamada et al, 1979; Schroder et al, 1995)。由于原子吸收光谱法(AAS)和电感耦合等离子体质谱(ICP-MS)等检测方法只能检测均一化后的整体耳石样品(司飞等, 2019b),故非常容易出现Sr2+标记随着鱼类生长而消失的假象。与之相比,EPMA可精确分析耳石剖面上不同位置的Sr2+含量沉积情况,从而不受标记鱼生长等限制,可避免上述局限,同时也为开展小规格大规模标记提供了可能。在双环标记实验中,耳石Sr2+元素面分布结果出现层次分明的双环,且双环标记组耳石线性分析结果与对照组基本一致。这说明通过Sr2+标记次数来进行不同放流群体识别是可行的。
外源Sr2+在耳石内沉积量响应性变化存在着一定时滞性(邱晨等, 2019),不同的标记实验其时滞性有所不同(王臣等, 2015; 李秀启等, 2017; 邱晨等,2019)。本研究中,2次实验间隔时间约为20 d,2次标记环之间层次分明。但双环标记时间是否可以进一步缩短,需要结合时滞现象与耳石结构、Sr2+沉积机制及鱼体生长阶段特征等相关性进一步深入研究。
综上所述,耳石Sr2+标记技术可实现小规格大规模标记,也可通过多环标记实现不同放流群体的识别,但是多环标记过程中,不同标记时间所需的最短时间间隔需要通过进一步的研究确定。

