蓝莓花青素对油酸诱导肝细胞脂肪变性小鼠Plin5蛋白表达的影响*
李晨驰,韩萧萧,杨柳,张景允,刘冉阳,杨勤
(贵州医科大学1.病理生理学教研室,2.贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州 贵阳550000)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)指除酒精和其他明确损伤肝脏的因素之外,发生的以弥漫性肝细胞大泡性脂肪变性为主要病理特征的临床病理综合征[1]。目前研究认为,在一定程度上,肝脏脂肪变性是有可能逆转的;而一旦进展为肝炎、肝纤维化,治疗难度将会增大。因此,近年来许多研究都致力于通过不同的手段,包括食疗、药物等改善NAFLD[2]。本课题组前期研究及其他学者的研究发现,蓝莓具有一定的预防和改善脂肪肝的作用,这为NAFLD 的非药物疗法提供了新思路,但其机制尚未完全阐明[3-4]。
脂滴包被蛋白5(Perilipin5, Plin5)是Perilipin 家族的最新成员。已有研究显示,Plin5 作为脂滴形成的关键蛋白之一,在维持细胞内脂质稳态和代谢平衡中具有重要作用[5],且Plin5 的表达受PI3K/Akt 信号通路的影响[6]。同时,有研究发现,富含黄酮类化合物的碧萝芷能够影响油酸诱导的Plin5蛋白表达[7],而蓝莓中含有大量黄酮类化合物——花青素[8]。由此推测蓝莓改善肝脂肪变性的作用可能与蓝莓富含的花青素调节肝细胞Plin5 蛋白的表达有关。
故本研究以油酸(oleic acid, OA)诱导AML12 小鼠肝细胞发生脂肪变性,复制NAFLD 模型,在此基础上观察蓝莓花青素对油酸诱导的肝细胞脂肪变性及损伤是否具有改善作用,并观察Plin5 蛋白表达与脂滴形成的关系。
1 材料与方法
1.1 一般材料与仪器
AML12 小鼠正常肝细胞株购自中国科学院干细胞库,蓝莓花青素购自陕西萃雅佳生物科技有限公司,油酸购自美国Sigma 公司,胎牛血清购自美国Scien Cell 公司,DMEM/F12 培养基购自美国Gbico 公司,油红O 细胞专用染色试剂盒购自北京Solarbio 公司, 甘油醛-3- 磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH)抗体购自武汉ABclonal 公司,Plin5 多克隆抗体购自美国Proteintech 公司, 磷脂酰肌醇3 激酶(phosphoinositide 3-kinase, PI3K)、磷酸化蛋白激酶(phospho-protein kinase B, Akt)抗体购自美国CST 公司,甘油三酯(Triglyceride, TG)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)检测试剂盒购自南京建成科技有限公司,xCELLigence RTCA DP 型实时无标记细胞分析仪(real time cellular analysis,RTCA)购自杭州艾森生物有限公司。
1.2 方法
1.2.1 最佳蓝莓花青素终浓度的确定 AML12 小鼠肝细胞用含10%胎牛血清、1%双抗的DMEM/F12 培养基,在37℃、5%二氧化碳的无菌培养箱中培养。采用实时无标记细胞分析技术检测蓝莓花青素对AML12 细胞增殖的影响。取对数生长期的细胞制成细胞悬液进行计数,接种密度为5×103个/孔(150 μl/孔),设置3个复孔。接种细胞24 h后,以不同终浓度的蓝莓花青素(0 μg/ml、50 μg/ml、100 μg/ml、150 μg/ml、200 μg/ml)培养基培养,并分别设置为0 μg/ml 组、50 μg/ml 组、100 μg/ml 组、150 μg/ml 组、200 μg/ml 组。连续动态监测≥65 h,每15 min 记录1 次。抑制率(%)=(0 μg/ml 组-不同浓度蓝莓花青素组)/0 μg/ml 组×100%。根据实验结果选择对细胞生长抑制非常低的蓝莓花青素浓度(50 μg/ml)作为后续实验的干预浓度。
1.2.2 细胞分组及肝细胞脂肪变性模型复制 取对数生长期细胞,按照每孔1.25×105个/ml 细胞密度接种于6 孔板,分别设置对照组、油酸诱导组、维生素C 组、蓝莓花青素组。对照组常规培养基培养,油酸诱导组、维生素C 及蓝莓花青素组,根据参考文献[9]及预实验结果,选择含0.75 mmol/L 油酸的培养基培养24 h,复制小鼠肝细胞脂肪变性模型。复制成功后,维生素C 组及蓝莓花青素组分别更换含50 μg/ml 维生素C 及50μg/ml 蓝莓花青素的培养基培养24 h。收集细胞,检测各项指标。
1.2.3 ALT、AST、TG 水平检测 细胞按照7.5×105个/ml 密度培养于直径60 mm 培养皿。收集细胞培养液上清,根据试剂盒操作说明进行加样,测定各孔光密度(OD)值。按照液体样本计算公式:绝对OD 值=测定孔OD 值-对照孔OD 值,参考试剂盒标准曲线,检测ALT、AST 活力单位。收集细胞,1 000 r/min 离心10 min,弃上清,留细胞沉淀,分别加入等量PBS 清洗2 次。再次加入PBS,在冰浴条件下将细胞进行超声破碎,制备好匀浆后不离心,按照操作表进行加样,每组重复3 次,测定各孔OD 值。并以BCA 法测定蛋白浓度。按照细胞计算公式:TG 浓度=[(样本OD 值-空白OD 值)/(校准OD 值-空白OD 值)]×校准品浓度(mmol/L)/待测样本蛋白浓度(g/L),检测细胞内TG 含量。
1.2.4 油红O染色 细胞按照每孔1.25×105个/ml密度培养于6 孔板。弃细胞培养液,4%多聚甲醛固定50 min 后PBS 漂洗,油红O 染色1 h,60%异丙醇漂洗10 s,PBS 漂洗,染色。显微镜下拍照。采用ImageJ-ProPlus 6.0 图像分析软件,每组随机选取3 个高倍视野,计算脂滴表达的红色积分光密度(IOD)值。
1.2.5 Western blotting 细胞按照7.5×105个/ml 密度培养于直径60 mm 培养皿。使用RIPA 蛋白裂解液裂解细胞,按照BCA 蛋白定量法计算并制备蛋白样品,向蛋白液中加入5×SDS 蛋白上样缓冲液,取10 μl 上样并使用SDS-PAGE 分离后将蛋白电转至PVDF 膜,用含5%脱脂奶粉的TBST 封闭液封闭1.5 h。TBST 洗膜后,加入稀释后的I 抗[Plin5 为1∶4 000,GAPDH为1∶2 000,PI3K为1∶1 000,P-Akt为1∶2 000]孵育,4℃过夜。次日用TBST 洗净后加入辣根过氧化物酶标记的Ⅱ抗,室温孵育1 h。之后使用ECL 工作液曝光。以IMAGELAB 软件计算阴影值,Plin5、PI3K、P-Akt 与GAPDH 表达量阴影面积的比值作为该蛋白的相对表达量。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步的两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 蓝莓花青素对细胞增殖的影响
用不同浓度的蓝莓花青素培养基处理后,0 μg/ml组和50 μg/ml 组的细胞指数逐渐升高,100 μg/ml、150 μg/ml 组缓慢升高,200 μg/ml 组缓慢升高后下降。0 μg/ml 组、50 μg/ml 组、100 μg/ml 组、150 μg/ml组、200 μg/ml 组细胞指数分别为(2.49±0.07)、(2.45±0.06)、(2.14±0.04)、(1.51±0.060)和(1.42±0.02),经方差分析,差异有统计学意义(F=275.573,P=0.000),100 μ g/ml、150 μ g/ml、200 μ g/ml 组 较0 μg/ml 组下降(P<0.05)。蓝莓花青素处理24 h 后100 μg/ml 组抑制率为14.18%;而50 μg/ml 组 为1.60%,未显示出明显抑制率。因此选择50 μg/ml的蓝莓花青素作为后续实验的干预浓度。见图1。
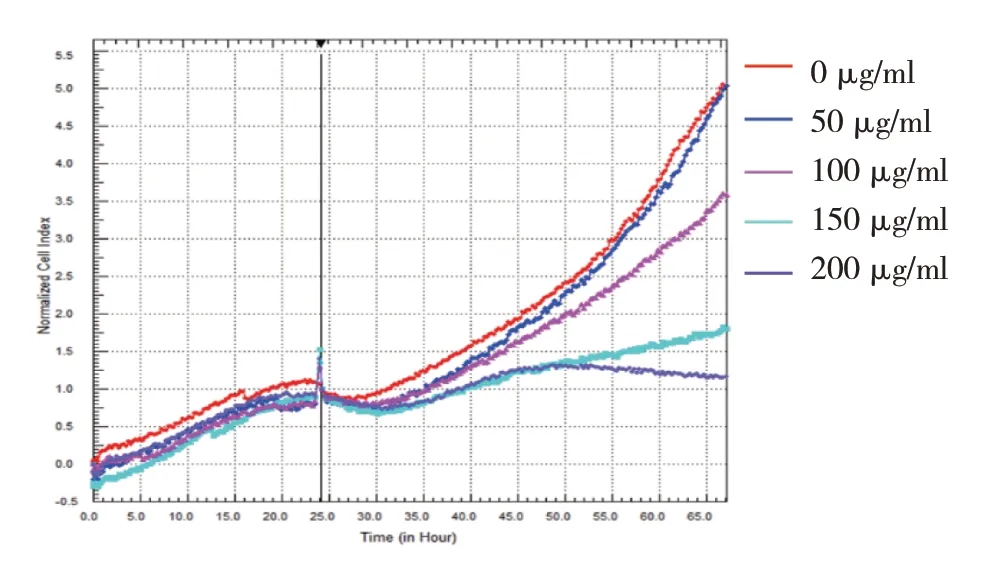
图1 不同浓度蓝莓花青素处理AML12细胞的细胞指数变化趋势
2.2 各组AML12细胞AST、ALT、TG水平比较
各组AML12 细胞ALT、AST、TG 水平比较,经方差分析,差异有统计学意义(P<0.05),油酸诱导组较对照组升高(P<0.05),维生素C 组、蓝莓花青素组较油酸诱导组降低(P<0.05),蓝莓花青素组较维生素C 组降低(P<0.05)。见表1。
表1 各组AML12细胞AST、ALT、TG水平比较(±s)
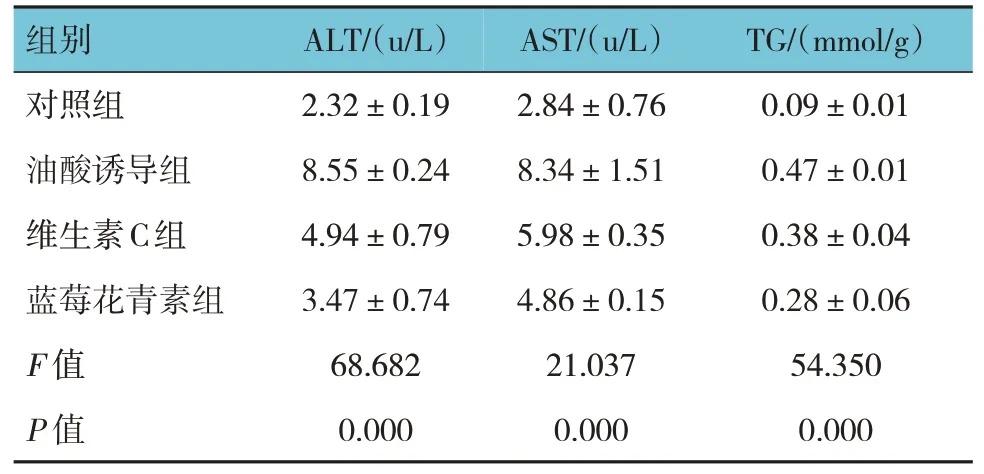
表1 各组AML12细胞AST、ALT、TG水平比较(±s)
组别对照组油酸诱导组维生素C组蓝莓花青素组F 值P 值ALT/(u/L)2.32±0.19 8.55±0.24 4.94±0.79 3.47±0.74 68.682 0.000 AST/(u/L)2.84±0.76 8.34±1.51 5.98±0.35 4.86±0.15 21.037 0.000 TG/(mmol/g)0.09±0.01 0.47±0.01 0.38±0.04 0.28±0.06 54.350 0.000
2.3 脂滴染色结果
对照组细胞几乎没有被油红染料染成红色的脂滴。油酸诱导组细胞胞质内有大量被油红染料染成红色的脂滴,并散在分布于细胞核周围。维生素C 组、蓝莓花青素组可见脂滴不同程度地减少。对照组、油酸诱导组、维生素C 组、蓝莓花青素组的IOD 值分别为(0.04±0.04)、(4.00±0.20)、(2.63±0.21)、(1.17±0.15),经方差分析,差异有统计学意义(F=329.990,P=0.000),油酸诱导组较对照组升高(P<0.05),维生素C 组、蓝莓花青素组较油酸诱导组降低(P<0.05),蓝莓花青素组较维生素C 组降低(P<0.05)。见图2。
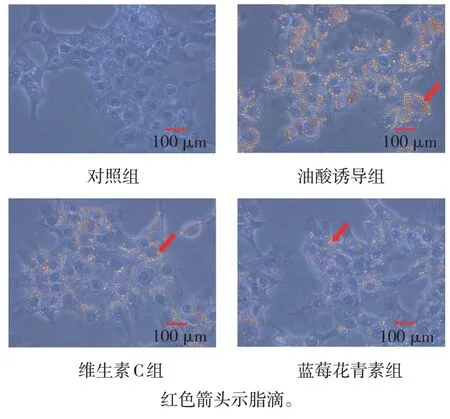
图2 各组AML12细胞中脂滴分布 (油红O染色)
2.4 各组Plin5、PI3K、P-Akt蛋白相对表达量比较
各组Plin5、PI3K、P-Akt 蛋白相对表达量比较,差异有统计学意义(P<0.05)。油酸诱导组较对照组升高(P<0.05),维生素C 组、蓝莓花青素组较油酸诱导组降低(P<0.05),蓝莓花青素组较维生素C 组降低(P<0.05)。见图3、4 和表2。
表2 各组AML12细胞Plin5、PI3K和P-Akt蛋白相对表达量比较 (±s)
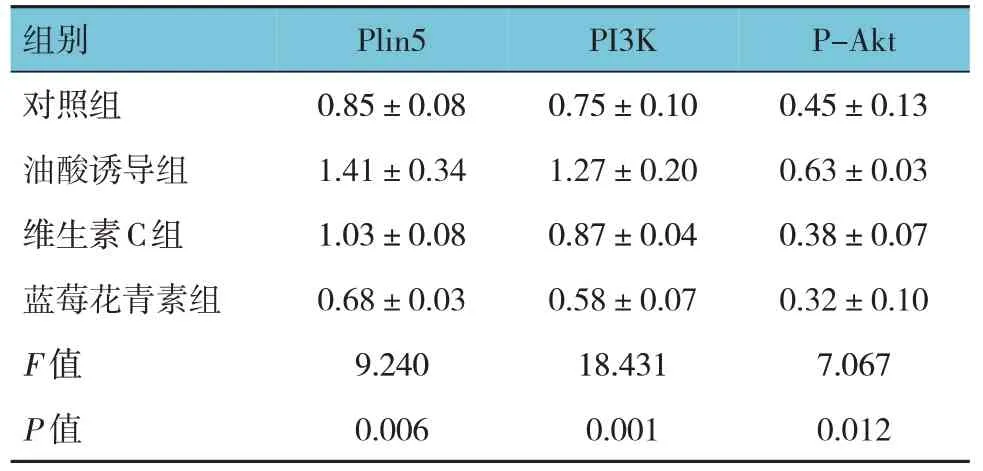
表2 各组AML12细胞Plin5、PI3K和P-Akt蛋白相对表达量比较 (±s)
组别对照组油酸诱导组维生素C组蓝莓花青素组F 值P 值Plin5 0.85±0.08 1.41±0.34 1.03±0.08 0.68±0.03 9.240 0.006 PI3K 0.75±0.10 1.27±0.20 0.87±0.04 0.58±0.07 18.431 0.001 P-Akt 0.45±0.13 0.63±0.03 0.38±0.07 0.32±0.10 7.067 0.012
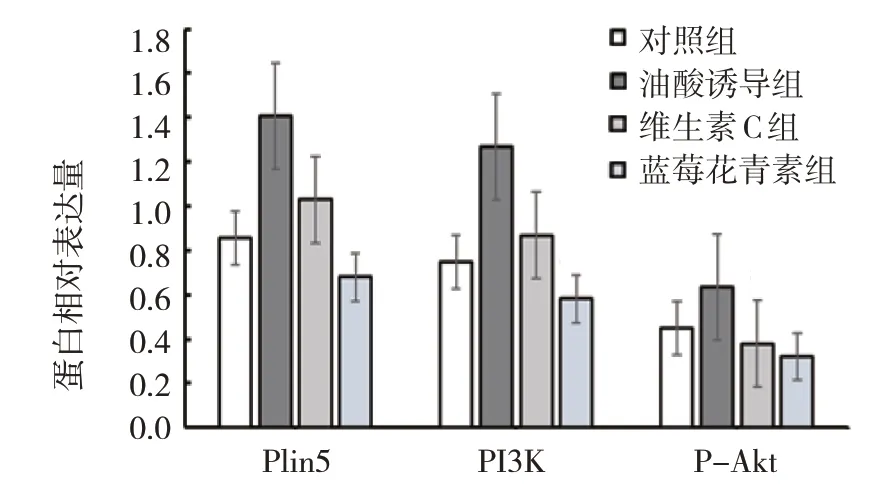
图3 各组AML12细胞Plin5、PI3K和P-Akt蛋白相对表达量比较 (±s)
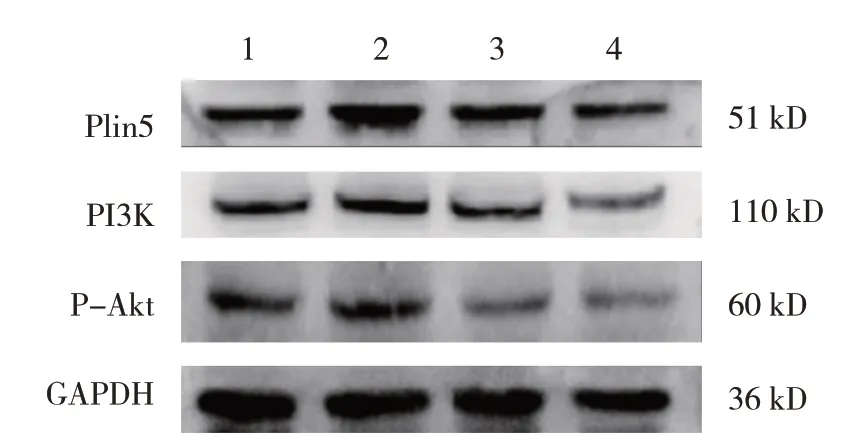
图4 各组AML12细胞Plin5、PI3K和P-Akt蛋白的表达
3 讨论
肝脏作为调节体内脂质平衡的主要器官之一,其脂肪酸主要有两种代谢方式:一是线粒体β 氧化;二是游离脂肪酸与甘油进行酯化形成TG,储存在脂滴[10]。当肝细胞摄入脂肪酸过量时,β 氧化途径受到抑制,脂质沉积加剧,导致脂肪变性[11]。本实验采用较高浓度油酸诱导AML12 细胞后,细胞培养上清液中肝功能损伤指标ALT 和AST 水平、细胞内TG 含量、脂滴数量均显著高于对照组;上述结果提示油酸诱导肝细胞发生明显脂肪变性及损伤,模型复制成功。根据文献报道,黄酮类化合物可以提高细胞抗氧化能力,减轻脂质过氧化损伤,并减少脂质沉积[12]。蓝莓富含多种抗氧化活性物质如黄酮类、多酚类化合物,其中抗氧化主要活性物质——花青素,属黄酮类化合物,是一种水溶性天然色素[8],本实验采用具有抗氧化活性的水溶性维生素C 作为阳性对照,经维生素C 及蓝莓花青素处理后,维生素C 组、蓝莓花青素组细胞培养上清液中ALT、AST 水平以及细胞内TG 含量、脂滴数量较油酸诱导组均降低。提示蓝莓花青素可有效降低肝细胞内脂滴沉积并改善肝细胞损伤,且与维生素C 作用相似。
在肝细胞内脂质以脂滴的形式沉积,而脂滴周围覆盖有多种脂滴蛋白,其中Perilipin 家族蛋白是研究比较广泛的一类脂滴蛋白[13]。目前,Plin1、Plin4 主要表达于脂肪组织中,Plin2、Plin3 可见于许多细胞类型。而Plin5 多表达于脂肪酸氧化代谢旺盛的组织,如心脏、肝脏、骨骼肌等。Plin5 作为新发现的成员,其亚细胞定位主要在脂滴表面[14]。Plin5 能够通过抑制TG 脂解和/或降低脂肪酸氧化,促进细胞内脂质的积累[15]。本实验油酸诱导组Plin5 蛋白表达较对照组显著增加,其表达和脂滴增加一致。LI 等[16]发现经油酸刺激后AML12 小鼠肝细胞中Plin5 的表达呈浓度及时间依赖性升高,与其相似,提示油酸诱导Plin5 蛋白表达促进脂质沉积。维生素C、蓝莓花青素干预后,Plin5 蛋白表达水平相较于油酸诱导组均明显下降,提示维生素C、蓝莓花青素能够抑制油酸诱导的Plin5 蛋白表达,起到减少脂质沉积的作用。同时,研究发现Plin5 蛋白可通过PI3K/Akt 途径促进细胞内脂质蓄积[6]。ZHONG 等[17]研究发现,下调PI3K 可以降低油酸诱导的HepG2 细胞中Plin5 的表达及脂滴沉积。以上研究均提示,脂滴蛋白与PI3K/Akt 信号通路的调控密切相关。
基于“脂质代谢异常加剧肝脏脂肪沉积,进一步发生氧化应激及脂质过氧化,最终导致NAFLD 的发生”这一共识,PI3K/Akt 信号通路将有望成为改善NAFLD 的靶点[18]。近年来,关于PI3K/Akt 在脂质代谢方面的研究不断增多,越来越多的学者认为PI3K/Akt 信号通路能促进脂质合成并抑制脂肪分解,是调节脂质代谢的重要通路[19]。此外,研究发现蓝莓花青素能够影响PI3K/Akt 信号通路蛋白的表达[20]。本研究中油酸诱导组PI3K、P-Akt 蛋白表达相较于对照组显著增加,而维生素C 组、蓝莓花青素组Plin5、PI3K、P-Akt 蛋白表达较油酸诱导组降低,蓝莓花青素组及维生素C 组下调结果一致。由此推测,蓝莓花青素可能通过调节PI3K/Akt信号通路影响Plin5 蛋白的表达,从而调节细胞内脂滴的沉积,但PI3K/Akt 信号通路是直接调控还是间接调控Plin5 蛋白的表达仍需进一步研究。
综上所述,蓝莓花青素在一定程度上可以改善油酸诱导的小鼠肝细胞脂肪变性。在油酸诱导小鼠肝细胞发生脂肪变性时,蓝莓花青素可能通过抑制Plin5 蛋白的表达减少肝脂肪变性。笔者推测其机制是通过蓝莓花青素抑制PI3K/Akt 信号通路使Plin5 蛋白表达下降,减弱Plin5 蛋白促进细胞内脂质积累的功能,达到改善油酸诱导的小鼠肝细胞脂肪变性的目的。但是其详细作用机制,仍需进一步深入研究。

