藁本内酯抗药物诱导的斑马鱼血栓的作用研究
唐惠兰,李姗姗,袁佩灵,江 焱,唐娇娇,林翰文,胡 光
(重庆理工大学 药物化学与分子药理学重庆市重点实验室,重庆 400054)
1 研究背景
根据世界卫生组织统计,在全球所有的致死病因中,由心脑血管疾病引起的死亡数量排第一位,全球每年死于心脑血管疾病的人数约有1 750万[1];在我国,每年的死亡人数高达260万左右,发病率在0.38%~10%[2]。血栓(血管内皮表面形成的块状物)是导致心脑血管疾病的主要病因,诱发血栓形成的主要因素有原发性因素和继发性因素2种。动脉血栓的形成多为血小板活化和发生聚集反应,而深静脉血栓是静脉血栓常见的症状,其形成机制主要是血管壁异常、血流变缓或减少、促血栓形成因子增加等[3]。
近年来,关于抗血栓性疾病药物的基础性研究中,基于动物实验平台探究深静脉血栓的形成是一种常见的研究方法,主要用来进行抗血栓药物的筛选。目前,关于抗血栓药物的开发,抗血小板聚集药物、抗凝血药物和溶血栓药物是3个常见的药物开发种类及研究方向。已上市的抗血栓类西药主要有阿司匹林、氯吡格雷、替格瑞洛等,其中阿司匹林是第一代抗血小板聚集药,具有较为稳定的抗血栓活性,常在实验中被用作抗血栓研究的阳性对照药。而中药研究中常见的抗血栓药物主要包括丹参、水蛭、当归、虎杖、川芎、郁金、延胡索、红花、三棱、莪术等。藁本内酯(ligustilide,LIG,其结构式如图1)是当归的主要活性成分,研究显示,它能很好地改善血液微循环,有助于平滑肌运动,抑制血管新生[4],在整个心脑血管及循环系统中能发挥较强的药理作用,是典型的抗栓药物之一。
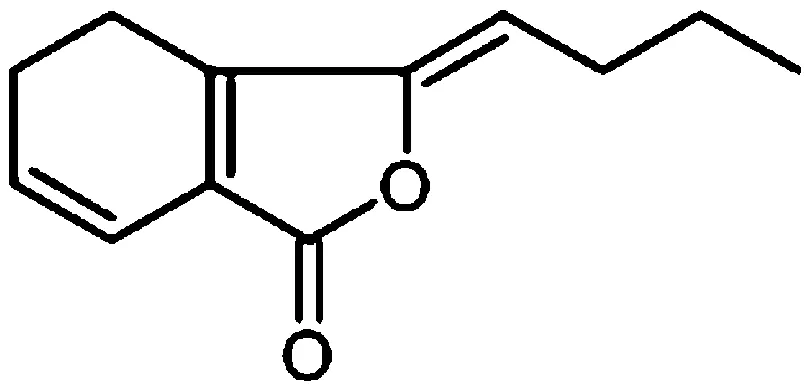
图1 藁本内酯(LIG)结构式
斑马鱼是继大鼠和小鼠后的世界第三大模式动物,其基因测序已基本完成,被广泛地应用于各种体内(in vivo)实验的研究。传统的深静脉血栓形成研究通常以家兔、犬等动物为对象,对其组织器官进行病理学分析。与传统的动物试验模型相比,斑马鱼具有体积小、预测性好、实验成本低、周期短、可比度高等优势;此外,斑马鱼与人类基因组的同源程度高[5-6],在基因水平上,与人类基因组可以达到87%的相似度[7-8],在胚胎早期的心血管系统的发育和人类极其相似,且与人类血液系统的凝血因子和血小板有诸多共同点[9-10],因此用斑马鱼进行试验可以模拟人类血栓的发病过程,得到的结果在一定程度上适用于人体。当前对于斑马鱼血栓模型的研究中,以尾静脉部位的血栓构建为主,同时利用拍照、软件处理等方法进行结果分析[11]。
综上所述,采用斑马鱼胚胎构建药物诱导的血栓模型并对相应的评价方法加以优化,能够为后续的药物开发提供高通量筛选的实验平台。本研究在优化了相应诱导剂给药参数的基础上,以阿司匹林为阳性对照药,研究了LIG的斑马鱼体内抗血栓作用,为抗血栓体内模型的开发及LIG的抗血栓活性验证提供了数据参考。
2 实验材料与方法
2.1 实验动物
实验用斑马鱼购自上海费曦生物科技有限公司,品系为野生型AB系,饲养于本实验室循环养殖系统中。成年斑马鱼的养殖方法参照国家斑马鱼资源中心(CZRC)的相关规定,环境温度控制在25~28 ℃,光照时间为14 h,黑暗时间为10 h。产卵雌鱼和雄鱼比为1∶2。
2.2 主要试剂和仪器
LIG,购自成都普菲德生物技术有限公司;苯肼(PH)、(±)-肾上腺素盐酸盐(AH)、3-3’-二甲氧基联苯胺、阿司匹林购自上海阿拉丁生化科技股份有限公司;全自动智能型霉菌培养箱;尼康E100双目光学显微镜;Olympus正置荧光显微镜成像系统。
2.3 邻联茴香胺染色方法
用3-3′二甲氧基联苯胺、无水乙醇、双氧水、无水乙酸钠配制邻联茴香胺染色液,斑马鱼胚胎经过诱导剂和给药处理后,转移至邻联茴香胺染色液中避光染色一定时间(不同染色时间见表2、4),染色处理完成后吸出染色液,用适量DMSO迅速清洗3次,在荧光显微镜下拍照并保存图片。
2.4 PH诱导斑马鱼血栓模型相关参数的优化
根据单因素实验考察分析,设计正交实验优化PH诱导斑马鱼血栓模型的4个相关参数:PH浓度、诱导时间、染色时间、鱼龄。4个参数的具体选择情况如表1所示:PH的浓度水平为0.75、1.5、3.0 μmol/L,血栓诱导时间水平为18、24、30 h;邻联茴香胺染液染色时间为25、30、35 min;鱼龄水平为2、3、4 dpf。在斑马鱼胚胎发育至1 dpf时,向斑马鱼胚胎培养皿中加入0.2 mmol/L的1-苯基-2硫脲(PTU)处理24 h以抑制黑色素形成。在培养环境下选取生理状况正常、活泼性好的幼鱼进行实验,并将其随机放置于24孔板中,每孔放置10条,设置1个空白组(胚胎培养水)、1个溶剂组(0.1 %乙醇)、9个正交设计实验组,取不同亲本斑马鱼重复实验3次,正交实验组设计如表2所示。

表1 PH诱导斑马鱼血栓模型参数优化的正交实验因素水平表
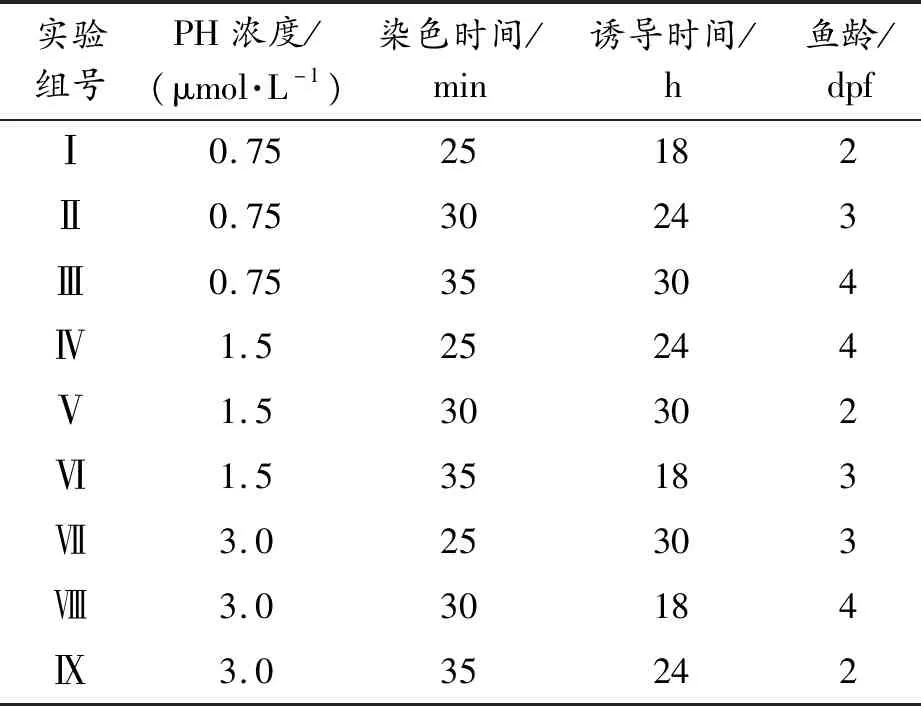
表2 PH诱导斑马鱼血栓模型参数优化的正交实验设计表
2.5 AH诱导斑马鱼血栓模型相关参数的优化
AH正交实验方法采用与2.4节中类似的实验设计,选取AH浓度为7.5、15、30 μmol/L;血栓诱导时间为12、16、20 h;邻联茴香胺染液染色时间为25、30、35 min;斑马鱼的不同鱼龄为2、3、4 dpf,如表3所示。正交实验四因素三水平表设计如表4所示。

表3 AH诱导斑马鱼血栓模型参数优化的正交实验因素水平表

表4 AH诱导斑马鱼血栓模型参数优化的正交实验设计表
2.6 LIG对斑马鱼血栓的作用探究
2.6.1LIG对PH诱导斑马鱼血栓的干预
在向1 dpf的斑马鱼胚胎加入0.2 mmol/L的PTU处理1 d后,选取生理状况、活动状况优良的2 dpf幼鱼胚胎,随机放置于24孔板中,每组10条。设置6个实验组:空白对照组,诱导剂(PH)组,阳性对照(PH+阿司匹林)组,LIG药物组(PH+20 μmol/L、40 μmol/L、60 μmol/L LIG)。其中,在斑马鱼处于48 hpf时,诱导剂组用0.75 μmol/L苯肼诱导24 h,阳性对照组于42 hpf时,加入22.5 mg/L阿司匹林6 h,再用苯肼诱导24 h;LIG药物组在27 hpf时给药21 h后,再用苯肼诱导24 h。取不同亲本幼鱼重复试验3次,拍照保存染色结果图。
2.6.2LIG对AH诱导斑马鱼血栓的干预
实验方法与2.6.1中的类似,设置6个实验组:空白对照组,诱导剂(AH)组,阳性对照(AH+阿司匹林)组,LIG药物组(AH+20 μmol/L、40 μmol/L、60 μmol/L LIG)。其中,在斑马鱼处于48 hpf时,诱导剂组用15 μmol/L盐酸肾上腺素诱导16 h;阳性对照组处于42 hpf时,加入22.5 mg/L阿司匹林6 h后,用盐酸肾上腺素诱导16 h;LIG药物组在27 hpf时,给药21 h后用盐酸肾上腺素诱导16 h,其余实验操作方法与2.6.1相同。
2.7 实验数据的处理
尾部血栓定量分析:药物诱导使斑马鱼尾部血流发生聚集现象,因而生成血栓;采用Image-Pro Plus 6.0软件对已拍照的图片进行尾部染色面积计算,通过尾部染色面积S定量分析血栓形成情况;统计学结果需采用SPSSAU project(2020)进行数据的处理和分析,2组实验数据比较采用t检验,多组间比较用方差分析,P<0.05有统计学意义。
3 结果
3.1 药物诱导斑马鱼血栓模型参数优化的结果
3.1.1PH正交实验
对PH的正交实验数据进行极差分析,如表5所示,极差:诱导时间>染色时间>PH浓度>鱼龄,说明PH诱导时间对斑马鱼尾部血栓形成具有最重要的影响,其次是染色时间,而PH浓度和鱼龄对尾部血栓的影响较小且两者比较接近。根据表中均值K的数据可知,PH诱导的最优条件为PH浓度0.75 μmol/L,诱导时间24 h,染色时间35 min,鱼龄2 dpf。

表5 PH正交实验结果
3.1.2AH正交实验
对AH正交实验结果所得数据的极差分析可得,极差:鱼龄>AH浓度>诱导时间>染色时间,即影响斑马鱼血栓形成的主要因素是鱼龄和AH浓度,染色时间和诱导时间次之。根据各因素的均值K可知,AH最佳诱导条件是浓度15 μmol/L,诱导时间16 h,染色时间30 min,鱼龄4 dpf,如表6所示。

表6 AH正交实验结果
3.2 LIG抑制斑马鱼血栓形成的实验结果
3.2.1以PH为诱导剂的实验结果
如图2所示,与空白对照组相比,诱导剂组心脏染色强度降低而尾部染色增强,说明尾部血流出现聚集现象而形成血栓,PH试剂诱导斑马鱼血栓建模成功;由统计学分析(图3)可知,阳性对照组及20 μmol/L与40 μmol/L的LIG给药组的斑马鱼尾部染色强度与诱导剂组相比,都呈现出了显著差异(P<0.05),说明阿司匹林和20 μmol/L与40 μmol/L的LIG能够有效降低PH诱导的斑马鱼血栓形成;60 μmol/L的LIG给药组与诱导剂组相比没有显著性差异。具体情况如下:加入阿司匹林的阳性对照组比诱导剂组的尾部染色面积小,且心脏染色面积有部分增加;加入LIG的给药组与诱导剂组相比,20 μmol/L和40 μmol/L的LIG能明显(P<0.001)减少斑马鱼尾部血栓形成的面积,心脏染色面积明显增强;20 μmol/L和40 μmol/L LIG给药组2组间抗血栓效果无明显差异;而60 μmol/L LIG给药组与诱导剂组相比,斑马鱼尾部血栓形成的面积没有显著性差异。此外,实验结果显示LIG 20 μmol/L和40 μmol/L给药组的尾部血栓面积也显著性低于阳性对照组,但由于LIG与阿司匹林的给药浓度、时长等参数不同,所以无法进一步比较哪种药物抑制斑马鱼尾部血栓面积效果更好。综上所述,20 μmol/L和40 μmol/L LIG能够显著降低PH诱导的斑马鱼尾部血栓形成。图2中(A1)~(A4)分别为空白对照组,PH诱导剂组,阳性对照组,40 μmol/L LIG给药组;(B1)~(B4)分别为空白对照组,PH诱导剂组,阳性对照组,40 μmol/L LIG给药组。

图2 PH诱导的斑马鱼血栓模型各组染色效果图
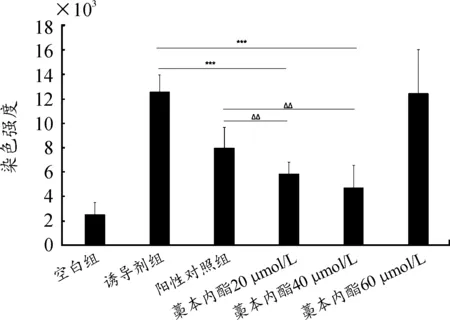
注:与诱导剂组相对比,***P<0.001;与阳性对照组相比,ΔΔP<0.01
3.2.2以AH为诱导剂的实验结果
如图4所示,与空白对照组相比,诱导剂组的斑马鱼心脏染色强度降低而尾部染色增强,说明在斑马鱼尾部形成血栓,AH诱导的斑马鱼血栓模型建模成功;同3.2.1统计学方法分析(图5),阳性对照组及20 μmol/L与40 μmol/L的LIG给药组的斑马鱼尾部染色强度与诱导剂组相比,都呈现出了显著性差异(P<0.05),说明阿司匹林和20 μmol/L与40 μmol/L的LIG都能有效降低AH诱导的斑马鱼血栓形成。

注:与诱导剂组相比,***P<0.001;与阳性对照组相比,ΔP<0.05

图4 AH诱导的斑马鱼血栓模型各组染色效果图
具体情况如下:加入阿司匹林的阳性对照组比诱导剂组的斑马鱼尾部染色面积小,心脏染色面积增加;加入LIG的给药组与诱导剂组相比,20 μmol/L和40 μmol/L的LIG给药组能显著(P<0.001)减少斑马鱼尾部的血栓形成面积,增加心脏染色面积,而20 μmol/L和40 μmol/L LIG给药组之间抗血栓效果并无显著性差异;60 μmol/L LIG给药组与诱导剂组相比无显著性差异。此外,实验结果显示:40 μmol/L的LIG给药组的尾部血栓面积显著(P<0.05)低于阳性对照组,但由于LIG与阿司匹林的给药浓度、时长等参数不同,所以无法进一步比较在该模型中哪种药物抑制斑马鱼尾部血栓面积效果更好。综上所述,20 μmol/L和40 μmol/L LIG在AH诱导的斑马鱼血栓模型中,能显著抑制血栓的形成。(A1)~(A4)分别为空白对照组,AH诱导剂组,阳性对照组,40 μmol/L LIG给药组;(B1)~(B4)分别为空白对照组,AH诱导剂组,阳性对照组,40 μmol/L LIG给药组。
4 讨论
本实验采用化学试剂诱导法,利用PH的强氧化作用[12]对血管造成损伤和AH的刺激血小板高度异常聚集作用[13],诱导斑马鱼血栓的形成,并在4 d内完成药物的抗血栓作用。实验所用斑马鱼鱼龄小、药物吸收快、观察方便,相较于在传统大型实验动物上采用物理、化学等方法建立血栓模型而言,血栓形成时间更短,节约研究时间。
在实验过程中,可以观察到加入诱导剂后的斑马鱼活动状态逐渐变差,心脏血流速度减缓;由斑马鱼血栓模型诱导参数结果分析可知,PH诱导18 h、AH诱导12 h时,在显微镜下能直接观察到斑马鱼尾部有明显的血栓形成,且随着诱导时间的增加,血栓形成数量先增加后减少,心脏染色强度与尾部血栓形成情况相反[14],这与国家专利(国家专利号:201110126427.2)报道的结果相符[15]。在预实验中,通过对PH和AH诱导浓度的筛选试验结果分析,发现部分较高浓度的诱导剂诱导的血栓形成效果不及较低浓度,如0.75 μmol/L的PH诱导效果优于3 μmol/L的PH诱导效果,15 μmol/L的AH诱导效果比30 μmol/L诱导效果更好,这些都可能与诱导剂浓度过高可能引起斑马鱼生理状态大幅改变相关。
本课题组还在预实验中对PTU的给药时长进行了考察,即在加入PTU后,观察斑马鱼表面黑色素抑制的恢复情况。96 hpf时,黑色素基本没有恢复,104 hpf时,在鱼的第一背鳍和第二背鳍附近开始有明显的黑色素恢复,120 hpf时,在鱼的背部生成大面积黑色素。因此实验中选用的斑马鱼胚胎不宜超过4 dpf,以减轻黑色素的恢复对实验观察的影响,这也是本研究在AH诱导斑马鱼血栓模型组的正交实验设计优化参数中,虽然得到了鱼龄为4 dpf为最优参数,但在LIG的给药实验中,依然选择在2 dpf附近的时期进行给药的原因之一;另一个原因是考虑到斑马鱼作为高通量筛选模型,时间短、筛选效率高,因此最后还是选择了2 dpf左右作为实际LIG的给药处理时期,以缩短试验周期,体现高通量的特色。
LIG能对血管内皮细胞产生保护作用[16],因此针对本实验2种诱导剂构建的血栓模型能产生一定作用效果。据有关报道,LIG在10 μmol/L的低浓度下作用效果不佳,而80 μmol/L浓度时对斑马鱼会产生一定毒性,100 μmol/L浓度就能抑制鱼卵孵化、影响鱼体形态发育[17]。在本实验中,20 μmol/L和40 μmol/L LIG对斑马鱼尾部血栓有显著抑制作用,然而在浓度为60 μmol/L时,有些斑马鱼已经开始出现游动缓慢、尾巴弯曲、心脏水肿,甚至死亡等现象(死亡率30%~40%),体现出了较大的毒性作用,这也可能是由于60 μmol/L的LIG的抗血栓效果不如20、40 μmol/L的LIG。
综上所述,本研究采用PH和AH通过损伤斑马鱼血管内皮表面诱导血栓模型,通过正交实验设计找到了建立模型的诱导剂浓度、诱导时间、染色时间、鱼龄的最佳参数;同时通过该模型发现20 μmol/L和40 μmol/L的LIG在斑马鱼体内具有一定的抗血栓效果,对采用斑马鱼模型评价药物的抗血栓活性及LIG的体内抗血栓研究提供了一定的数据支持。

